技术分享:血管内皮细胞在稳态和疾病中的增殖动力学
严重的内皮细胞(EC)损伤和丧失会导致多种心血管疾病,如动脉粥样硬化、高血压和糖尿病引起的严重肢体缺血。内皮细胞增殖或内皮祖细胞(EPC)的分化是损伤血管新生内皮的主要来源[1]。在血管修复和新血管形成过程中,组织内的内皮细胞增殖是新内皮细胞生成的主要途径[2]。不同内皮细胞亚群之间的基因表达和功能具有异质性。单细胞转录组分析已揭示几个功能不同的主动脉内皮细胞亚群,并确定了它们从血管内皮祖细胞到分化细胞的谱系层级[3]。然而,由于内皮细胞的增殖率较低,同时缺少可靠的细胞增殖记录方式,目前评估大血管如动脉中内皮细胞生成的动力学具有挑战性,以及在稳态和疾病状态下内皮细胞增殖动力学的基本信息知之甚少。
血液流动的机械力是影响血管形态发生、发育和维持正常功能的关键因素[4]。内皮细胞伸长和重定向通常与血流诱导的剪切应力方向平行[5, 6]。虽然体外系统可以模拟不同类型的剪切应力,但内皮细胞增殖是如何受到体内复杂环境和血流模式的影响尚不清楚。机械力也可调节细胞分裂方向[7, 8]。然而,血流剪切应力作为一种机械力,是否会影响体内内皮细胞增殖和成体组织中的细胞重排,目前尚不完全清楚。
2023年12月,Circulation上报道了一项科研成果,利用体内实时无缝记录内皮细胞(EC)增殖的遗传示踪系统、单细胞RNA测序等方法揭示动脉稳态和疾病过程中内皮细胞增殖情况及调控机制。遗传示踪系统显示,成年小鼠每月约有3%的主动脉内皮细胞发生增殖,其细胞分裂的方向平行于主动脉血流方向,并由机械传感蛋白Piezo1调节。单细胞RNA测序分析鉴定出4个具有不同增殖活性的主动脉内皮细胞亚群,其中EC-1具有更强的细胞增殖能力和干细胞标志物如Sca1、Sox18的富集表达。Hippo/VEGF信号通路调节大血管内皮细胞的增殖。在疾病背景下,EC-1亚群的增殖活性发生了改变,在高血压模型中增加,在糖尿病中减少。该研究有助于加深人们对调控血管生物学基本过程的细胞和分子机制的理解[9]。
首先,研究者构建遗传示踪系统,评估其示踪主动脉细胞增殖的效果。Ki67是细胞周期标志物,已广泛用于评估细胞增殖[10]。Ki67是瞬时表达在正在发生增殖事件的细胞,即其免疫染色反映了给定时间点的细胞增殖事件,但对于主动脉内皮这种低增殖率的细胞检出效果较差。与此不同,随着时间的推移,Ki67表达细胞的遗传示踪可以记录一个时间窗口内的所有细胞增殖事件(图一A)。因此,研究者构建了R26-DreER;Ki67-CrexER; R26-GFP(ProTracer)小鼠[11],在他莫昔芬作用下诱导Dre-rox重组,将Ki67-CrexER转换为组成型活性的Ki67-Cre,如果随后发生增殖,Ki67被激活以驱动Cre表达,导致报告基因(R26-GFP)的永久性GFP表达,从而在加药后记录长时程细胞增殖事件(图一B)。与传统的Ki67-CreER;R26-GFP相比,ProTracer具有明显的优势,在他莫昔芬处理的初始点后,ProTracer能够在长时间窗口内对细胞增殖进行时间无缝记录。为了比较这两种系统,研究者分别在小鼠他莫昔芬处理后的第1、2、3、4、8和12周收集主动脉(图一C),通过背中线纵向解剖主动脉,进行内皮细胞核标志物ERG的组织染色,以及双光子显微镜成像检测(图一D)。首先收集他莫昔芬处理后5天的ProTracer小鼠主动脉,正如预期,在如此短的时间内标记的内皮细胞核是稀疏的,几乎所有GFP+ 克隆都由2个细胞组成(图一E和F),证明了基于Ki67的ProTracer系统记录的细胞增殖事件。随后,研究者发现ProTracer小鼠主动脉中GFP+ 内皮细胞的数量随着时间的推移逐渐增加,而在传统系统的小鼠中没有(图一G和H)。从数量上讲,在他莫昔芬处理后12周,ProTracer主动脉中平均检测到约1500个GFP+ 内皮细胞,约占ERG+ 内皮细胞的10%(图一I)。在未使用他莫昔芬处理的ProTracer主动脉中没有看到GFP+ 内皮细胞(图一J),排除了遗传示踪系统的泄漏。以上数据表明,ProTracer可很好地用于遗传示踪主动脉细胞的增殖。
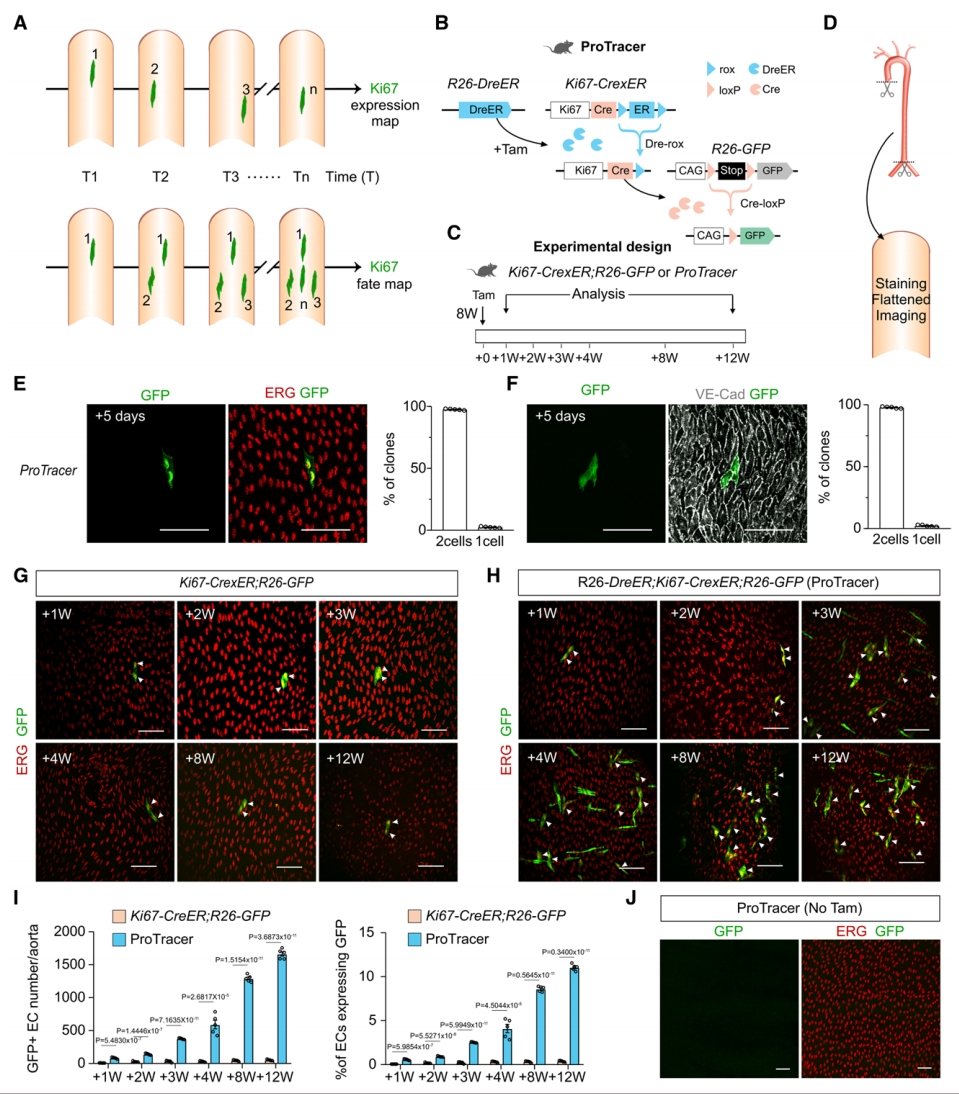
图一 ProTracer示踪主动脉细胞增殖[9]
由于ProTracer同时记录了所有细胞类型的增殖,于是,研究者构建了内皮细胞特异性ProTracer,以更好研究内皮细胞增殖。用Ki67-CrexER与内皮细胞特异性Cdh5-DreER;R26-GFP小鼠杂交获得EC-ProTracer(图二A)。用他莫昔芬处理8周龄小鼠,然后在1、2、3、4、8和12周收集主动脉(图二B)。免疫染色显示,随着时间的推移,EC-ProTracer主动脉中GFP+ 内皮细胞逐渐增加,在第12周,检测到约8%的主动脉内皮细胞表达GFP,数量约为1200个(图二C和D)。大多数内皮细胞克隆由一对细胞组成,研究者测量内皮细胞分裂方向与血流方向的关系,发现主动脉的大多数内皮细胞分裂在方向上与血流是平行的,而大静脉如下腔静脉(IVC)的内皮细胞分裂主要在垂直方向(图二E和F)。IVC中表达GFP的内皮细胞显著高于主动脉(图二G)。以上数据表明,EC-ProTracer可以定量记录稳态下大血管内皮细胞的增殖,并额外提供了内皮细胞分裂方向与血流方向的关系信息(图二H)。
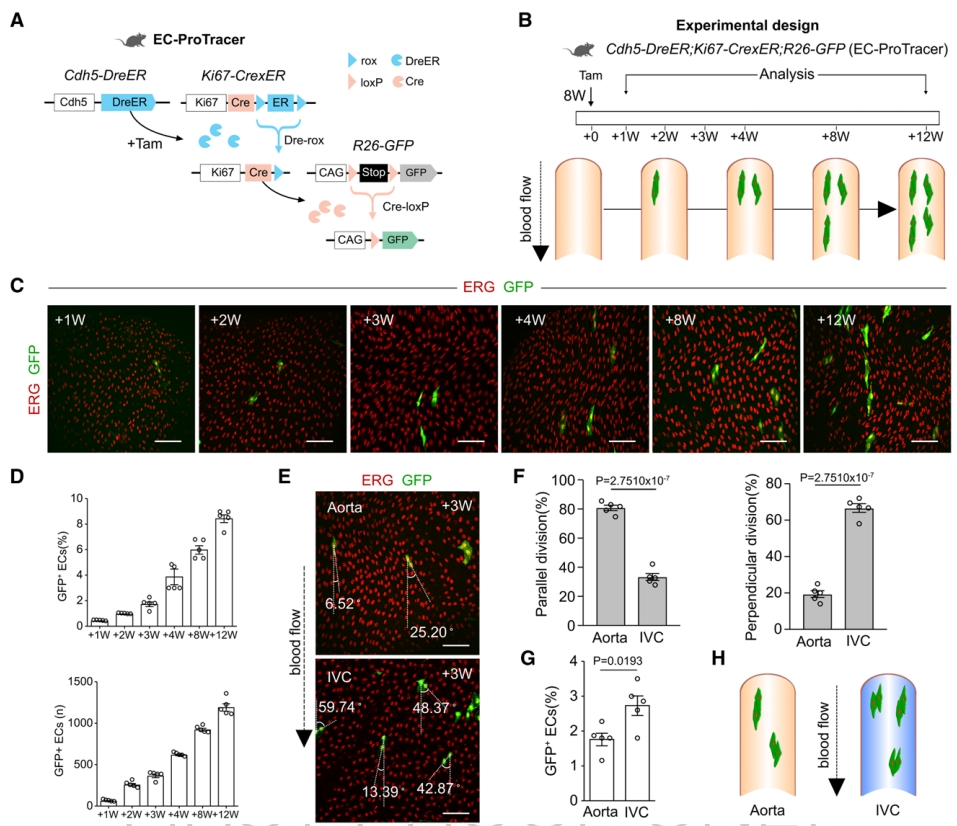
图二 ProTracer对内皮细胞特异性增殖的遗传示踪[9]
Piezo1是一种血液流动的机械传感器,通过钙的流入使得内皮细胞响应剪切应力和空间重排[12]。于是,研究者探究Piezo1是否参与大血管内皮细胞增殖和分裂方向的调节。构建了Piezo1-GFP敲入小鼠(图三A),免疫染色显示,GFP在主动脉内皮细胞强烈表达,但在静脉内皮细胞中不表达(图三B)。为了对Piezo1进行功能评估,在体内同时进行基因敲除和示踪细胞增殖,研究者进一步构建了条件性基因敲除小鼠Piezo1-rox(图三C),将其和ProTracer小鼠杂交,获得R26-DreER;Piezo1-rox/rox;Ki67-CrexER;R26-GFP(Piezo1-KO)小鼠,注射他莫昔芬后8周收集主动脉和IVC进行分析,并使用R26-DreER;Ki67-CrexER;R26-GFP(Piezo1-WT)小鼠作为对照(图三D和E)。与Piezo1-WT相比,Piezo1-KO主动脉中Piezo1 mRNA显著减少(图三F)。在主动脉和IVC中,两组的GFP+ 内皮细胞数量和比例没有显著差异(图三G和H),表明内皮细胞增殖不受Piezo1的调节。但是,与Piezo1-WT组相比,Piezo1-KO的内皮细胞平行分裂百分比显著降低,垂直分裂百分比显著增加(图三I)。并且这种分裂方向的改变仅在主动脉中观察到,而在IVC中没有(图三J),以上数据表明,Piezo1在主动脉内皮细胞中起着关键和特定的作用,以调节内皮细胞分裂响应机械力而发生的空间重排。
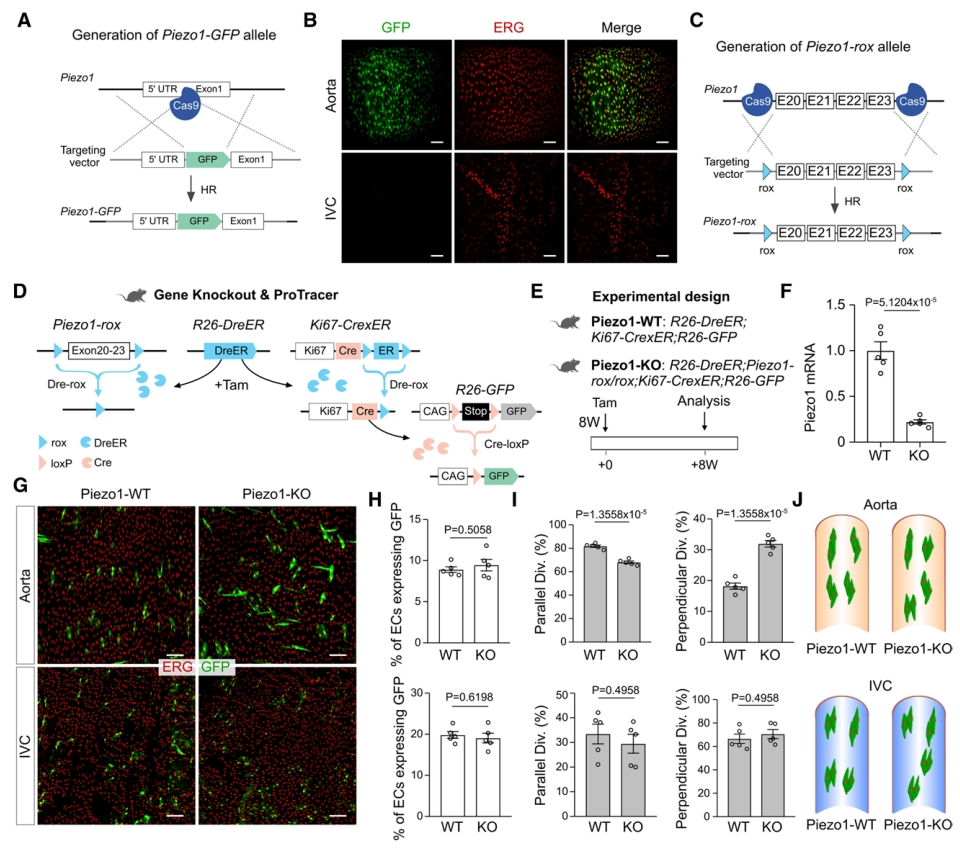
图三 Piezo1介导血流量调节的内皮细胞分裂空间重排[9]
接着,研究者检测内皮细胞的异质性及其增殖能力。他莫昔芬处理8周后从ProTracer小鼠中分离主动脉内皮细胞进行单细胞转录组测序,tSNE分析显示大于10种不同的细胞类型,包括内皮细胞、间充质细胞、平滑肌细胞和免疫细胞,对应的特异性标志物都显著性富集表达(图四A和B)。内皮细胞可分为至少4种不同的内皮细胞亚群(图四C),尽管EC-1仅占总内皮细胞的34.59%(图四D),但其包含了70%的增殖内皮细胞(GFP)(图四E和F)。EC-1主要富集ATP合成和代谢过程相关的基因表达。EC-1细胞中,9.89%被GFP标记,是其他亚群的3到6倍(图四G)。拟时序分析发现EC-1和EC-2细胞表现出分化程度较低的状态(图四H)。通过差异表达基因分析,发现EPC标志物Sox18和Sca1在EC-1细胞中高度富集(图四I和J)。为评估主动脉Sca1+ 内皮细胞在稳态过程中的作用,使用Sca1-CreER;R26-tdT示踪表达Sca1的细胞(图四K和L),发现他莫昔芬处理12周后tdT标记的内皮细胞百分比显著增加(图四M和N)。以上数据表明,EC-1是一个具有高增殖能力的内皮细胞亚群。
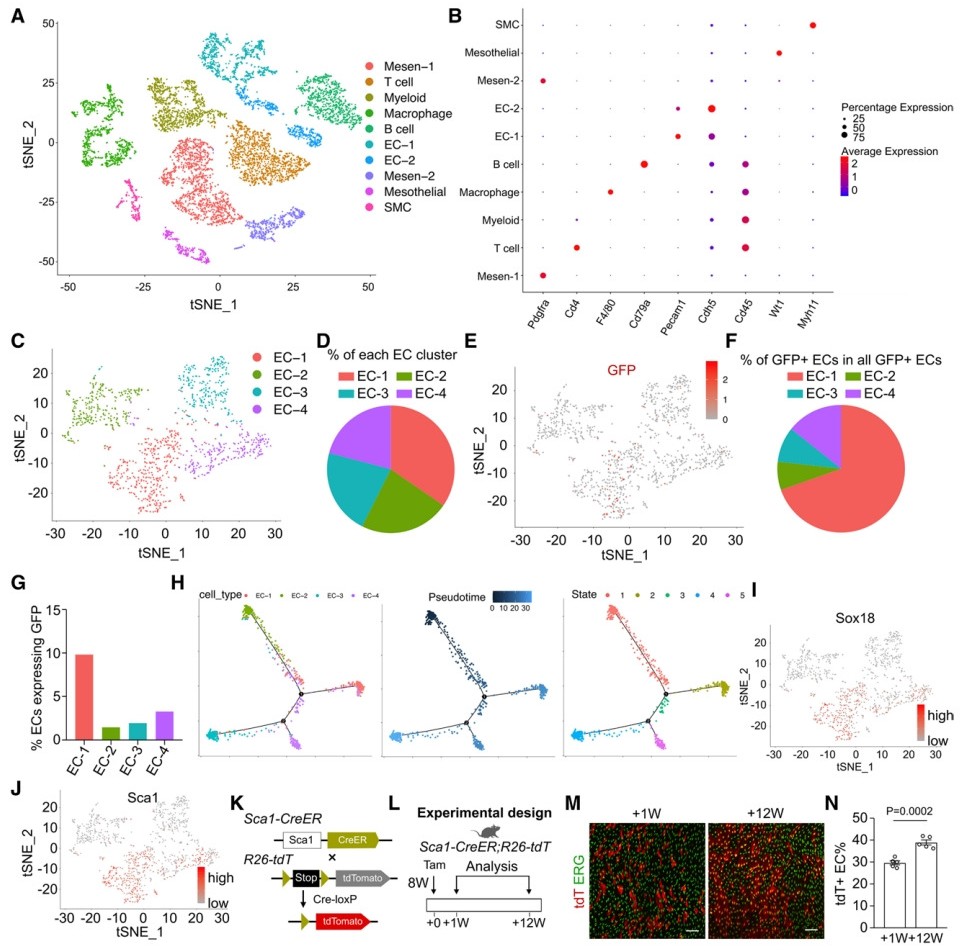
图四 揭示具有高增殖能力的内皮细胞亚群[9]
为了探究影响内皮细胞增殖的分子机制,研究者对4个内皮细胞亚群分析,发现血管内皮生长因子受体2(VEGFR2,也称为Kdr)在EC-1亚群中高度富集(图五A)。接下来,研究者使用ProTracer系统和条件性基因敲除来研究VEGF信号是否调节主动脉内皮细胞的增殖。使用CRISPR/Cas9产生Kdr-rox小鼠,并与ProTracer小鼠杂交得到R26-DreER;Kdr-rox/rox;Ki67-CrexER;R26-GFP(Kdr-KO)小鼠(图五B和C)。相比对照Kdr-WT小鼠,他莫昔芬处理后,Kdr-KO主动脉细胞Kdr的表达显著降低(图五D)。4周后收集主动脉和IVC进行分析,发现与Kdr-WT组相比,Kdr-KO小鼠两种血管的内皮细胞增殖都显著减少(图五E和F),表明Kdr是大血管内皮细胞正常增殖所必需的(图五G)。有研究报道Hippo通路效应器Yap1积极参与细胞对机械力的反应[13]。同样地,研究者产生了Yap1-KO小鼠(图五H和I)。他莫昔芬处理后,Yap1-KO小鼠主动脉细胞中的Yap表达显著降低(图五J)。主动脉和IVC中内皮细胞增殖显著减少(图五K和L),表明Yap1也是大血管内皮细胞正常增殖所必需的(图五M)。基于此,研究者推测内皮细胞中VEGF和Hippo通路之间具有潜在遗传调控,发现在Yap1-KO 内皮细胞中,Kdr表达显著减少,而在Kdr-KO 内皮细胞中,Yap1表达没有显著改变(图五N和O),表明在内皮细胞中,Kdr的表达部分受Yap1的调节。以上数据表明,VEGF和Hippo通路调节大血管内皮细胞的增殖。
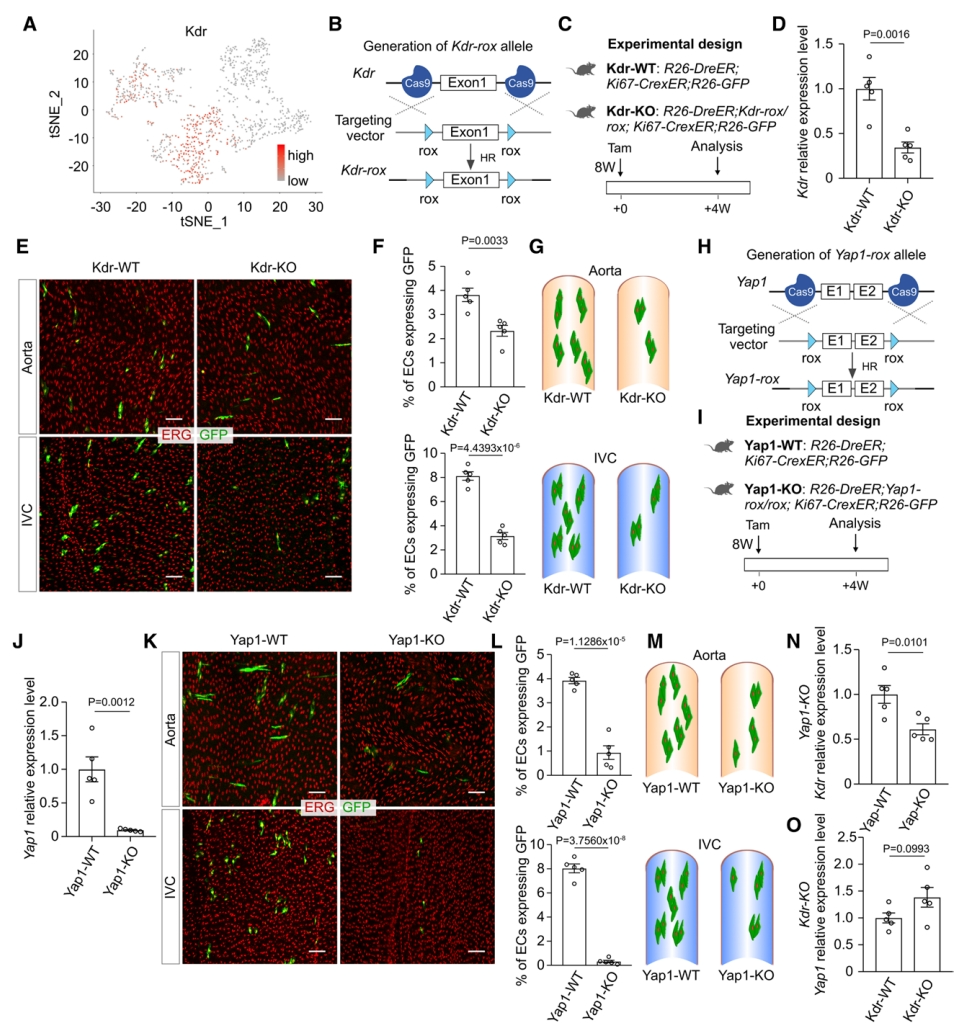
图五 Hippo/VEGF信号通路调节内皮细胞增殖[9]
最后,研究者使用ProTracer评估糖尿病和高血压疾病模型中的内皮细胞增殖。使用高糖高脂饮食(HFHSD)喂食EC-ProTracer小鼠,模拟2型糖尿病模型(T2D),并用正常饮食的相同基因型小鼠作为对照(图六A)。T2D组的体重和血糖均显著高于对照组(图六B和C);口服糖耐量测试显示,T2D组的血糖显著高于对照组(图六D);曲线下面积显著高于对照组(图六E),证明成功建立了2型糖尿病模型。他莫昔芬处理后4周收集组织,发现T2D组的主动脉和IVC中GFP+ 内皮细胞显著下降(图六F和G),但两组的内皮细胞分裂方向没有显著差异(图六H-J)。通过内皮细胞增殖或EPC分化的血管再生是改善糖尿病引发缺血的潜在治疗方法[14]。因此,研究者使用Ly6C作为EC-1细胞的特异性标志物,对EC-ProTracer小鼠主动脉的Ly6C+ EC-1细胞和Ly6C– EC进行流式分析,发现虽然T2D组EC-1细胞的百分比显著增加(图六K和L),但其增殖能力显著降低(图六K和M),尽管EC-1亚群在糖尿病模型中仍表现出比其他内皮细胞更高的增殖能力(图六N)。
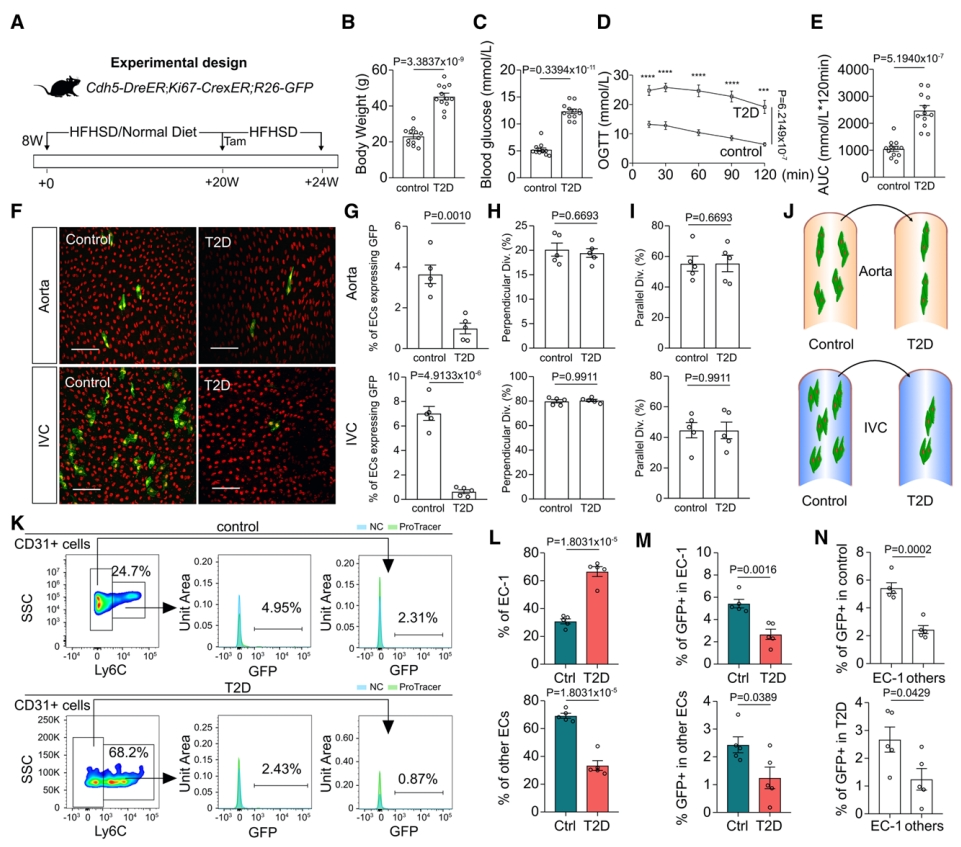
图六 2型糖尿病小鼠的异常内皮细胞增殖[9]
类似地,研究者在EC-ProTracer小鼠中用AngII诱导高血压模型。AngII处理后,收缩压和舒张压均显著升高(图七A和B),证明高血压模型的成功建立。他莫昔芬处理4周后收集的大血管显示主动脉中GFP+ 内皮细胞显著增加,但IVC中显著减少(图七C),表明动脉和静脉内皮细胞对AngII诱导的高血压的增殖反应不同(图七D)。与对照组相比,高血压组在主动脉和IVC的内皮细胞平行分裂增加(图七E-G)。同样分析EC-1细胞的变化,发现EC-1细胞的百分比在高血压组中显著增加(图七H和I),并且增殖率显著增加(图七H和J)。然而,相对于其他亚群,EC-1亚群的较高增殖能力在高血压组中不再保持(图七K),表明其他内皮细胞亚群响应高血压反应增加了增殖。
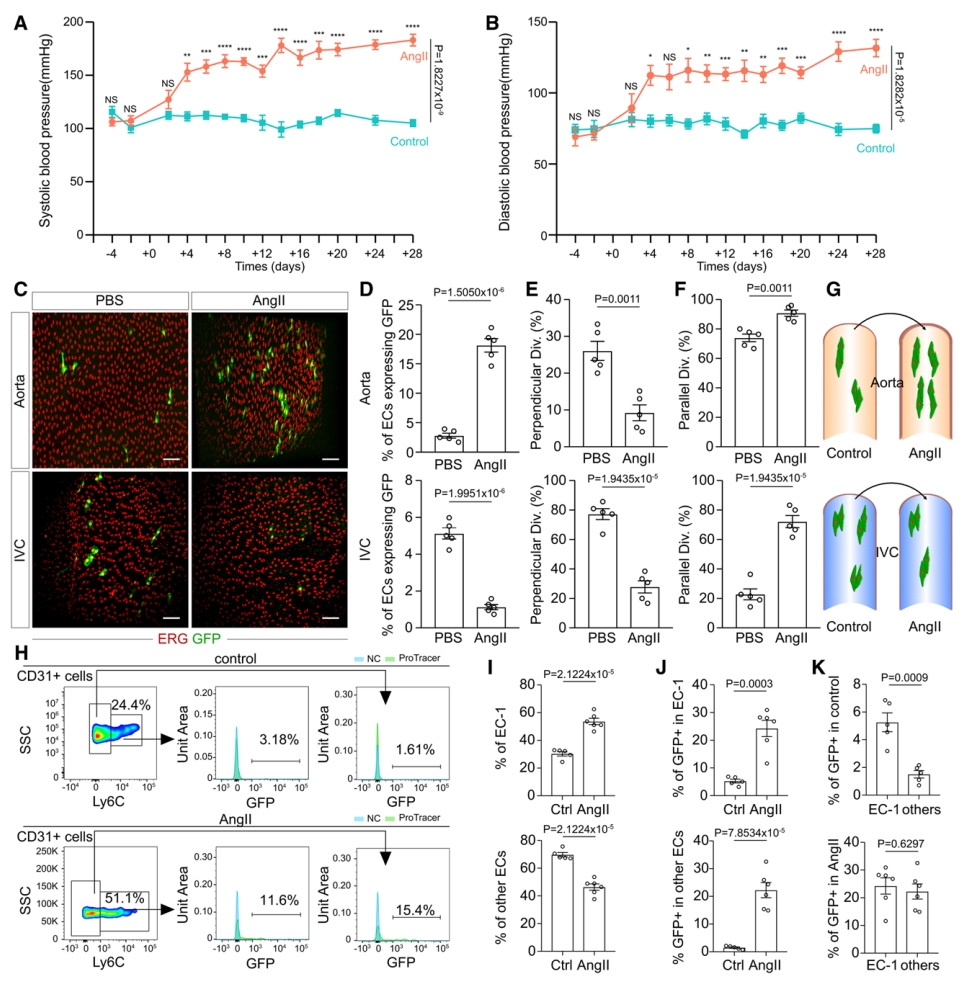
图七 高血压小鼠的异常内皮细胞增殖[9]
综上所述,研究者利用双同源重组系统构建一种可以长时程不间断捕捉体内内皮细胞增殖的技术ProTracer,揭示了在稳态、高血压和糖尿病状态下主动脉内皮细胞的增殖情况,还揭示了血流剪切应力是调节内皮细胞增殖和内皮细胞定向分裂的重要机械力。并在ProTracer鼠基础上分别构建了基因敲除Kdr或Yap1,发现主动脉和静脉的内皮增殖信号均显著降低,即Hippo/VEGFR2通路调控大血管内皮细胞的增殖。通过scRNA-seq分析揭示了稳态和高血压、糖尿病状态下大血管内皮细胞增殖的异质性,寻找到一群具有高增殖潜能的内皮细胞亚群EC-1,并探讨了影响其增殖的分子机制,为以后预防高血压、糖尿病的血管病变提供新思路。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Bai X, Wang X, Xu Q: Endothelial damage and stem cell repair in atherosclerosis. Vascular pharmacology 2010, 52(5-6):224-229.
2. He L, Huang X, Kanisicak O, Li Y, Wang Y, Li Y, Pu W, Liu Q, Zhang H, Tian X et al: Preexisting endothelial cells mediate cardiac neovascularization after injury. The Journal of clinical investigation 2017, 127(8):2968-2981.
3. Kalluri AS, Vellarikkal SK, Edelman ER, Nguyen L, Subramanian A, Ellinor PT, Regev A, Kathiresan S, Gupta RM: Single-Cell Analysis of the Normal Mouse Aorta Reveals Functionally Distinct Endothelial Cell Populations. Circulation 2019, 140(2):147-163.
4. Gebala V, Collins R, Geudens I, Phng LK, Gerhardt H: Blood flow drives lumen formation by inverse membrane blebbing during angiogenesis in vivo. Nature cell biology 2016, 18(4):443-450.
5. Mylvaganam S, Plumb J, Yusuf B, Li R, Lu CY, Robinson LA, Freeman SA, Grinstein S: The spectrin cytoskeleton integrates endothelial mechanoresponses.Nature cell biology 2022, 24(8):1226-1238.
6. Dewey CF, Jr., Bussolari SR, Gimbrone MA, Jr., Davies PF: The dynamic response of vascular endothelial cells to fluid shear stress. Journal of biomechanical engineering 1981, 103(3):177-185.
7. Godard BG, Heisenberg CP: Cell division and tissue mechanics. Curr Opin Cell Biol 2019, 60:114-120.
8. Tang Z, Hu Y, Wang Z, Jiang K, Zhan C, Marshall WF, Tang N: Mechanical Forces Program the Orientation of Cell Division during Airway Tube Morphogenesis. Dev Cell 2018, 44(3):313-325.e315.
9. Li Y, Liu Z, Han X, Liang F, Zhang Q, Huang X, Shi X, Huo H, Han M, Liu X et al: Dynamics of Endothelial Cell Generation and Turnover in Arteries During Homeostasis and Diseases. Circulation 2024, 149(2):135-154.
10. You X, Chen Q, Yuan D, Zhang C, Zhao H: Common markers of testicular Sertoli cells. Expert review of molecular diagnostics 2021, 21(6):613-626.
11. He L, Pu W, Liu X, Zhang Z, Han M, Li Y, Huang X, Han X, Li Y, Liu K et al: Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 2021, 371(6532):eabc4346.
12. Li J, Hou B, Tumova S, Muraki K, Bruns A, Ludlow MJ, Sedo A, Hyman AJ, McKeown L, Young RS et al: Piezo1 integration of vascular architecture with physiological force. Nature 2014, 515(7526):279-282.
13. Wang L, Luo JY, Li B, Tian XY, Chen LJ, Huang Y, Liu J, Deng D, Lau CW, Wan S et al: Integrin-YAP/TAZ-JNK cascade mediates atheroprotective effect of unidirectional shear flow. Nature 2016, 540(7634):579-582.
14. Leung OM, Li J, Li X, Chan VW, Yang KY, Ku M, Ji L, Sun H, Waldmann H, Tian XY et al: Regulatory T Cells Promote Apelin-Mediated Sprouting Angiogenesis in Type 2 Diabetes. Cell reports 2018, 24(6):1610-1626.



