技术分享:跨内皮迁移的中性粒细胞通过Piezo1-Nox4增强杀菌功能
以中性粒细胞为主的多形核白细胞(PMN),是抵御细菌和真菌等病原体感染的第一道防线[1, 2],特别是在肺部防御空气传播的刺激物和病原体时[3, 4]。血管由单层内皮细胞排列,血管内皮细胞界于血液和间质组织之间发挥其屏障作用。循环PMN一旦接收到感染组织释放的化学趋化信号,就能穿过约束性内皮粘附连接(AJ)和肺泡上皮屏障,到达肺间质执行功能[5, 6]。跨内皮连接的路径负责大约90%的PMN内皮屏障迁移。然而,人PMN直径为8.7-13 μm,相对于大多数连续内皮屏障的4 nm平均直径大了许多[6, 7]。因此,在穿过AJ窄缝孔隙的迁移过程中,PMN质膜必然会经历高强度的张力和拉伸。这种AJ连接处的物理约束可能会影响PMN的迁移和功能特性,例如影响其杀灭细菌和宿主防御功能。
PMN的一种重要宿主防御功能是通过蛋白酶和产生活性氧(ROS)来激活自身吞噬机制并杀死病原体。细菌杀伤主要由烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶和吞噬溶酶体驱动,后者是具有氧化和溶解特性的细胞器[8]。PMN表达多种NADPH氧化酶亚型如NOX1、NOX2和NOX4来产生ROS[9],其先天免疫功能可通过经典的NOX2激活机制来介导杀死细菌和真菌[10, 11]。但其他NOX亚型在PMN抗菌功能中的作用和机制仍知之甚少。
2024年1月,Immunity期刊报道了一项研究,证明PMN在穿过约束性内皮连接时产生的机械信号对于增强自身的宿主防御功能具有重要作用。具体而言,PMN在跨内皮迁移过程中产生的膜张力触发了Piezo1机械门控和Ca2+ 内流,后者诱导了NADPH氧化酶NOX4的表达,进而增强了PMN在组织中的细菌杀伤和宿主防御功能[12]。
首先,研究者探究PMN的跨内皮迁移行为是否影响其功能。使用CatchupIVM-red小鼠来示踪PMN,该小鼠在PMN特异性基因座Ly6G的驱动下共表达Cre重组酶和荧光蛋白td-Tomato。为了区分迁移性(TM)和非迁移性(Non-TM)PMN,在小鼠处死前2分钟,利用静脉注射(i.v.)BV421荧光团偶联的a-Ly6G抗体对血管内的PMN进行活体染色,使得血管内的非迁移PMN表现为BV421和td-Tomato双阳性,而迁移PMN为td-Tomato单阳性(图一A和B)。小鼠吸入脂多糖(LPS)后,可诱导PMN从肺微血管迁移到血管外空间,观察到td-Tomato+ PMN积聚在血管和肺组织中(图一A-C)。随着LPS暴露时间的延长,迁移PMN的比例增加(图一C)。接着,研究者比较这两种PMN体外吞噬清除大肠杆菌的能力(图一D)。与非迁移PMN相比,迁移PMN具有近两倍的GFP大肠杆菌清除能力,并且反应持续达180分钟(图一E)。
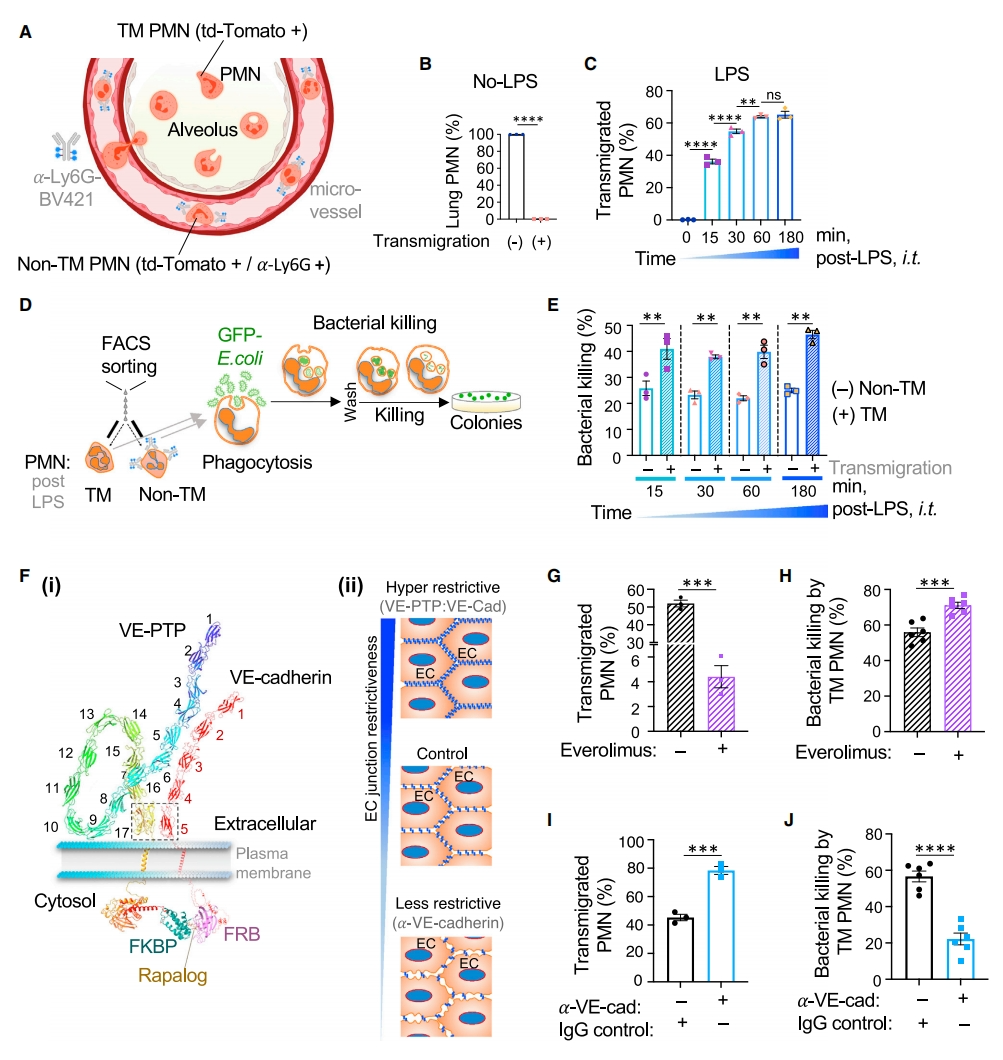
图一 PMN的跨内皮迁移促进其杀菌活性[12]
研究者进一步使用转基因小鼠模型来增强AJ屏障,该小鼠模型同时表达VE-cadherin-FKBP和VE-PTP-FRB,在雷帕霉素类似物依维莫司的介导下,不可逆地稳定了VE-cadherin和VE-PTP之间的相互作用(图一Fi),使得内皮屏障的约束力增加(图一Fii)。另外,使用VE-cadherin阻断抗体打开AJ,可减小约束力,促使屏障更具渗透性(图一Fii)。研究者采用依维莫司处理小鼠,观察到相比对照组小鼠,增加内皮屏障约束力导致迁移PMN的数量显著减少(图一G),但是杀菌能力反而增强(图一H)。相反,采用VE-cadherin阻断抗体减小内皮屏障约束力,增加了迁移PMN的数量(图一I),同时降低了杀菌能力(图一J)。以上实验表明,内皮连接约束力是迁移PMN增强杀菌能力的关键因素。
接下来,研究者使用微流体方法体外测试PMN迁移前后的功能表型变化。在该系统中,PMN分别通过直径为5 μm或200 μm的两种孔隙(图二A)。与200 μm孔隙相比,通过5 μm孔隙的PMN显示出更强的细菌杀伤作用(图二B)。随后,测试化学引诱剂fMLP诱导PMN迁移通过不同孔径Transwell膜,发现通过越小孔径的PMN具有越强的细菌杀伤作用(图二D和E)。进一步探究迁移PMN的增强细菌杀伤表型,将通过微流体系统不同孔径的小鼠骨髓PMN移植到受体小鼠中,气管内滴注铜绿假单胞菌,16小时后检测肺部感染情况(图二F)。结果显示,与200 μm孔隙相比,穿过5 μm孔隙的PMN的细菌清除率显著增加(图二G和H)。以上数据表明,PMN迁移穿过比体型更小的微流体孔隙后,其杀菌功能显著增强。
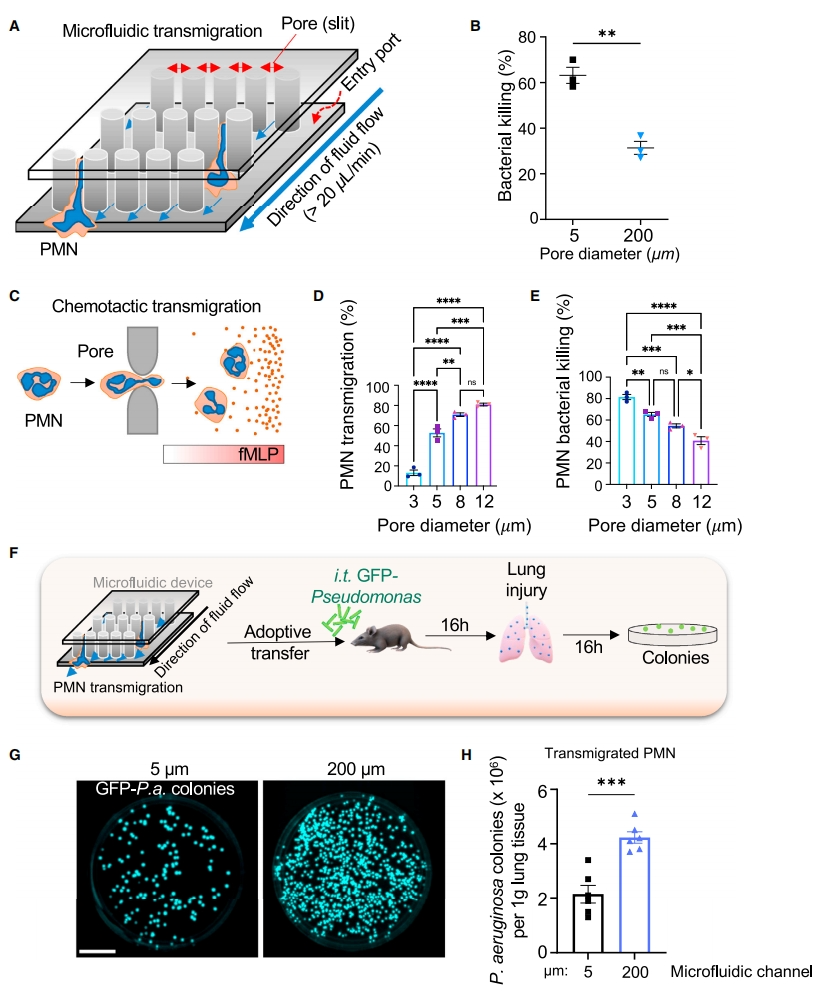
图二 PMN迁移穿过微流体约束性孔隙可增强其杀菌活性[12]
机械传感器Piezo1是一种表达在PMN的非选择性Ca2+ 通道[13]。PMN在穿过AJ的迁移过程中经历了高强度的张力和拉伸。于是,研究者探究Piezo1是否在其中发挥作用。使用Ca2+ 指示剂GCaMP6f进行活体钙成像,观察到PMN中的周期性胞质Ca2+ 瞬变仅发生在迁移期(图三A-C)。当细胞离开连接处时,反应减弱(图三B和C)。使用PiezoI1 shRNA转染HL-60细胞来源的PMN,发现Piezo1耗竭降低了迁移中PMN的Ca2+ 内流(图三D-F)。为评估穿过AJ的PMN是否能产生足够的张力激活Piezo1,使用计算模型分析平均直径8.5 μm人PMN的膜张力变化,发现在PMN与连接点接触的迁移阶段,膜张力增加(图三G)。PMN所经历的最大膜张力与孔径大小成反比(图三H),并随着推动PMN通过连接所需的总外力而增加(图三H)。以上数据表明,在PMN跨内皮连接的迁移过程中,Piezo1感应膜张力诱导了Ca2+ 信号传导。
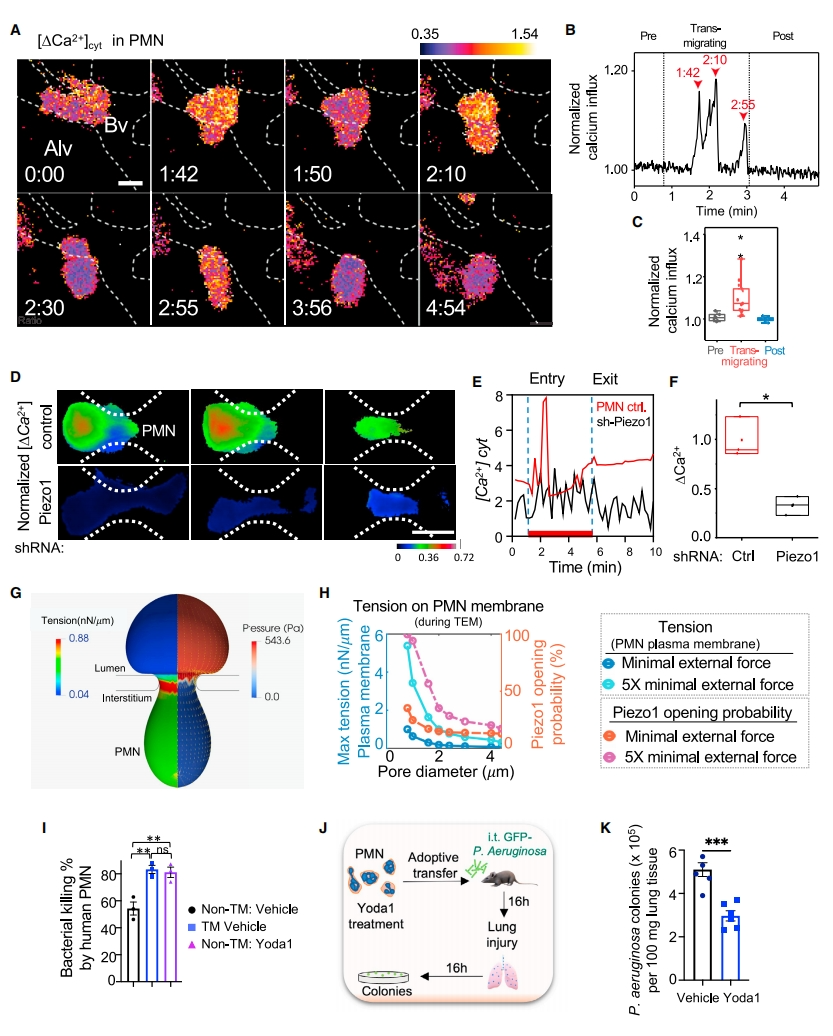
图三 PMN跨内皮连接迁移通过Piezo1激活其钙信号传导[12]
为确定增强的PMN杀菌功能与Piezo1之间的关系,研究者用Piezo1激活剂Yoda1处理新分离的人外周血PMN,发现与对照组相比,Yoda1处理的非迁移PMN具有与迁移PMN相似的杀菌活性增强(图三I)。此外,用Yoda1预处理的小鼠骨髓PMN同样提高了小鼠肺部铜绿假单胞菌的清除率(图三J和K)。进一步研究Piezo1激活对PMN杀菌活性的作用,将Piezo1fl/fl与含有Ly6G-Cre的CatchupIVM-red小鼠杂交,产生纯合的PMN特异性Piezo1缺失小鼠(Piezo1△PMN)。PMN中Piezo1缺失对外周血的PMN数量没有显著影响,也不会改变骨髓PMN的成熟度。与对照组相比,Piezo1△PMN小鼠在感染后肺部具有更多的假单胞菌(图四A-D),更严重的炎症性肺损伤(图四E和F),以及更高的小鼠死亡率(图四G)。分析肺中铜绿假单胞菌病灶和PMN之间的距离,发现与对照组相比,PMN中Piezo1缺失不会改变其吞噬细菌的能力,并且定位在更靠近细菌的位置(图四H-J)。尽管Piezo1△PMN小鼠肺中含有更多的PMN,但PMN与铜绿假单胞菌的数量比值却显著降低(图四K)。Piezo1△PMN小鼠的另一个重要表型是它们不能形成中性粒细胞外陷阱(NET)来响应铜绿假单胞菌的攻击。在LPS诱导炎症性肺损伤模型中,发现Piezo1缺失导致PMN的迁移速度从3 μm/min降低到0.8 μm/min(图四L-N)。以上数据表明,PMN中Piezo1的表达对于介导杀菌、NET形成和迁移功能至关重要。
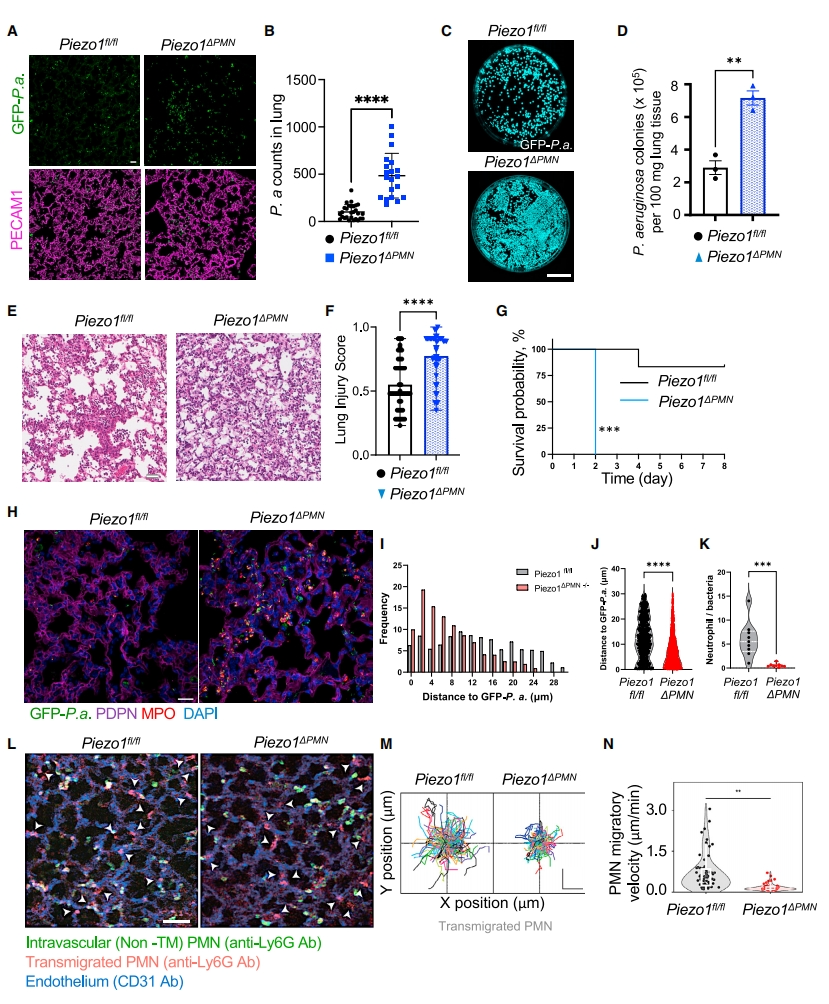
图四 Piezo1在迁移PMN中的激活增加其杀菌活性[12]
研究者对迁移PMN与非迁移PMN进行转录组分析,发现两者在野生型WT和Piezo1△PMN小鼠中显示出不同的转录组特征(图五A-F)。NOX4,一种在吞噬溶酶体中产生过氧化氢的亚型在迁移PMN中上调,但在Piezo1△PMN小鼠迁移PMN中降低(图五E和F),表明Piezo1激活和NOX4表达之间的联系。IPA通路分析显示,改变最多的杀菌反应途径包括急性期反应信号、病原体识别、先天和适应性免疫反应、Hif1a和Ca2+ 信号传导(图五G)。经FACS验证,WT小鼠的迁移PMN显示CD10和CD47上调,而这些变化在Piezo1△PMN小鼠中减少(图五I和K)。Piezo1△PMN小鼠的迁移PMN显示出CXCR4显著上调(图五H)以及CD11b表达减少(图五J)。以上数据表明,迁移PMN激活了一系列转录程序,其中一些程序因Piezo1的缺失而改变。
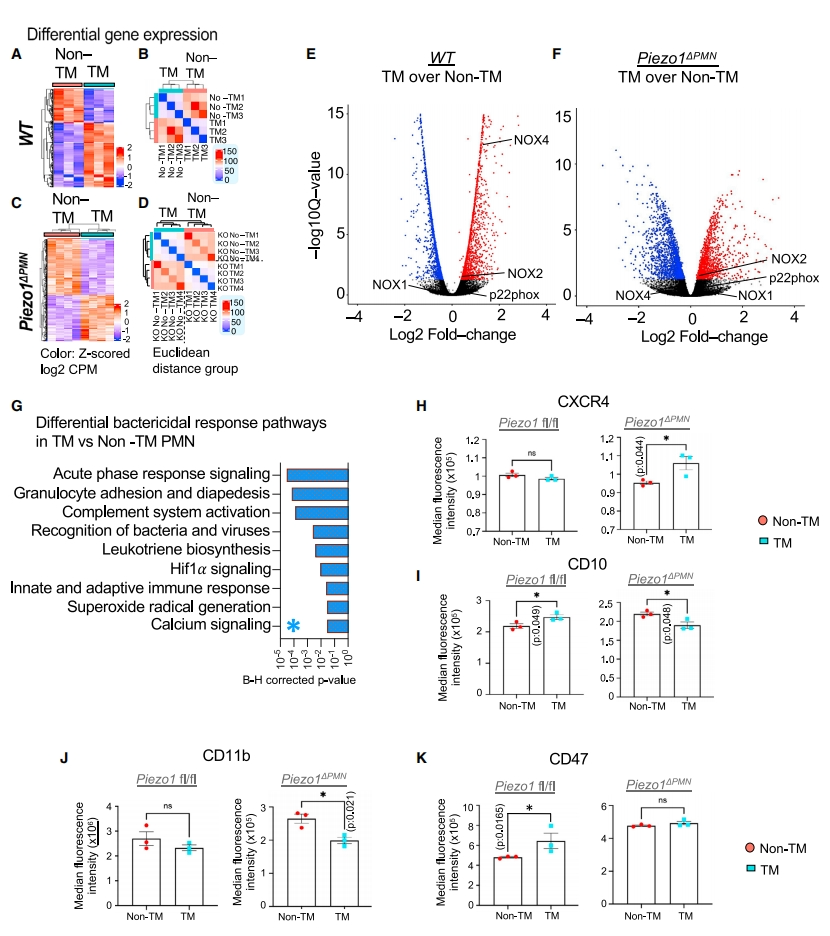
图五 小鼠肺中迁移和非迁移PMN的转录组分析[12]
最后,研究者探究Piezo1-NOX4信号传导的必要性。分析LPS处理模型的迁移和非迁移PMN中Nox亚型的表达情况,发现迁移PMN中Nox2和Nox4的mRNA表达上调(图六A),Piezo1缺失仅干扰了Nox4的上调(图六B)。Yoda1处理同样增加了PMN的Nox4 mRNA和蛋白的表达(图六C和D)。Piezo1敲降使得通过5 μm较小孔径PMN的NOX4表达显著减少(图六E)。使用NOX1和NOX4的双重抑制剂GKT137831或使用NOX4 siRNA预处理PMN,随后通过5 μm孔隙,发现PMN的杀菌活性显著降低(图六F和G)。在PMN特异性缺失Nox4(Nox4△PMN)的小鼠模型中,感染肺中假单胞菌集落的数量也显著增加(图六H和I)。此外,Piezo1或NOX4的敲降都显著减少了迁移PMN中ROS的产生(图六J)。以上数据表明,Piezo1通过上调NOX4表达来增强迁移PMN的宿主防御功能。
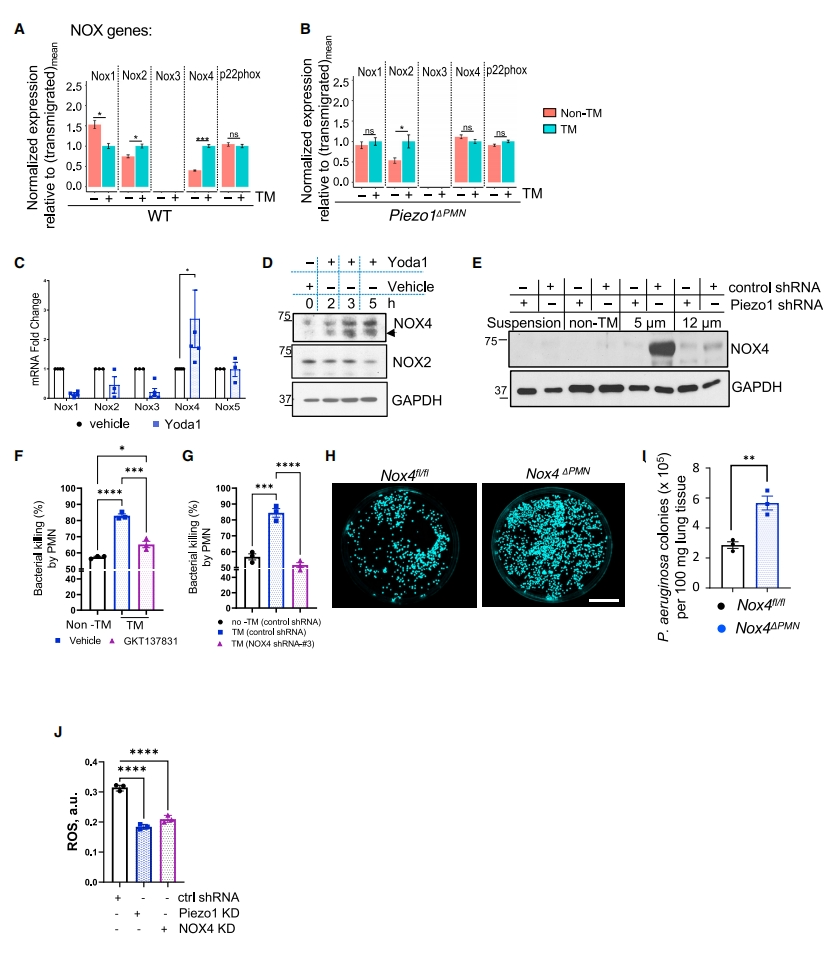
图六 Piezo1上调NOX4表达增强迁移PMN的杀菌活性[12]
综上所述,该研究使用了多种方法来研究PMN在穿过约束性内皮连接期间产生的机械信号在增强PMN宿主防御功能中的作用。PMN质膜上的机械传感器Piezo1在跨内皮迁移过程中感知到机械力的增加,诱导钙离子信号转导,激活NADPH氧化酶亚型NOX4的表达,进而增强PMN穿过内皮细胞进入组织后的杀菌功能。该研究表明通过激活Piezo1可增强PMN的杀菌活性,提示其可作为一种治疗炎症性疾病有效策略的可能性。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Degrossoli A, Müller A, Xie K, Schneider JF, Bader V, Winklhofer KF, Meyer AJ, Leichert LI: Neutrophil-generated HOCl leads to non-specific thiol oxidation in phagocytized bacteria. Elife 2018, 7:e32288.
2. Dziarski R, Platt KA, Gelius E, Steiner H, Gupta D: Defect in neutrophil killing and increased susceptibility to infection with nonpathogenic gram-positive bacteria in peptidoglycan recognition protein-S (PGRP-S)-deficient mice. Blood 2003, 102(2):689-697.
3. Balamayooran G, Batra S, Fessler MB, Happel KI, Jeyaseelan S: Mechanisms of neutrophil accumulation in the lungs against bacteria. American journal of respiratory cell and molecular biology 2010, 43(1):5-16.
4. Sekheri M, El Kebir D, Edner N, Filep JG: 15-Epi-LXA(4) and 17-epi-RvD1 restore TLR9-mediated impaired neutrophil phagocytosis and accelerate resolution of lung inflammation. Proceedings of the National Academy of Sciences of the United States of America 2020, 117(14):7971-7980.
5. Nourshargh S, Alon R: Leukocyte migration into inflamed tissues. Immunity 2014, 41(5):694-707.
6. Mittal M, Nepal S, Tsukasaki Y, Hecquet CM, Soni D, Rehman J, Tiruppathi C, Malik AB: Neutrophil Activation of Endothelial Cell-Expressed TRPM2 Mediates Transendothelial Neutrophil Migration and Vascular Injury. Circulation research 2017, 121(9):1081-1091.
7. Muller WA: Mechanisms of leukocyte transendothelial migration. Annual review of pathology 2011, 6:323-344.
8. Lee WL, Harrison RE, Grinstein S: Phagocytosis by neutrophils. Microbes and infection 2003, 5(14):1299-1306.
9. Panday A, Sahoo MK, Osorio D, Batra S: NADPH oxidases: an overview from structure to innate immunity-associated pathologies. Cellular & molecular immunology 2015, 12(1):5-23.
10. O'Neill S, Brault J, Stasia MJ, Knaus UG: Genetic disorders coupled to ROS deficiency. Redox biology 2015, 6:135-156.
11. Buvelot H, Posfay-Barbe KM, Linder P, Schrenzel J, Krause KH: Staphylococcus aureus, phagocyte NADPH oxidase and chronic granulomatous disease. FEMS microbiology reviews 2017, 41(2):139-157.
12. Mukhopadhyay A, Tsukasaki Y, Chan WC, Le JP, Kwok ML, Zhou J, Natarajan V, Mostafazadeh N, Maienschein-Cline M, Papautsky I et al: trans-Endothelial neutrophil migration activates bactericidal function via Piezo1 mechanosensing. Immunity 2024, 57(1):52-67.e10.
13. Murthy SE, Dubin AE, Patapoutian A: Piezos thrive under pressure: mechanically activated ion channels in health and disease. Nature reviews Molecular cell biology 2017, 18(12):771-783.



