技术分享:癌症治疗新思路——阻断糖核苷酸清除
代谢改变是癌症的一个标志,从而支持癌症在各种应激状态下的快速增殖与存活等功能[1]。一些代谢活动具有重要的解毒作用,可防止有毒代谢中间产物的过度积累[2]。癌细胞中存在着一种“厨房水槽”模型,就像只有打开水龙头时才需要排水一样,只有因高代谢产生有毒代谢物的细胞才需要解毒酶[3]。因此,靶向癌细胞存活所必需但在正常细胞中可有可无的代谢途径具有重要治疗潜力。然而,鉴别这些代谢途径仍是一个挑战,这对癌症治疗具有重要意义。
2023年10月,Nature期刊上报道了一种靶向糖核苷酸生物合成途径来治疗癌症的新思路,该代谢途径仅针对癌细胞,并不影响正常细胞。酶UXS1作为一种解毒剂,仅在高表达UGDH的细胞中是必需的。UXS1不仅可以清除UGDH的产物UDPGA,而且通过对UGDH的负反馈作用来抑制UDPGA生产。过量的UDPGA会破坏高尔基体的形态和功能,阻碍EGFR等表面受体向质膜的转运,进而降低细胞的信号传导能力。UGDH在包括肺腺癌在内的几种癌症中表达升高,并在化疗耐药选择过程中进一步增强表达。因此,这些癌细胞选择性地依赖UXS1解毒UDPGA,揭示靶向UXS1可用于治疗UGDH高表达的癌症[4]。
首先,为寻找癌细胞存活所必需但在正常细胞中可有可无的代谢途径,研究者使用癌症细胞系依赖性的DEPMAP数据库来挖掘具有不同重要性的代谢酶,这些代谢酶是某些癌症细胞系存活所需的,而其他细胞系则不需要[5]。根据对细胞存活的要求,在产生高水平底物的细胞中鉴定候选解毒酶,即酶E2仅在高表达酶E1的细胞中是必需的,需要E2清除E1产生的有毒代谢物(图一a)。结果发现,对于必需酶之一的UXS1,其紧邻的上游基因UGDH,是与UXS1需求最相关的基因(图一b-d)。UGDH产生糖核苷酸UDPGA,后者是一种多功能代谢物,作用于糖基化反应的底物,并与各种外来物质结合,将其从细胞中排出[6]。高尔基酶UXS1可以将UDPGA转化为糖核苷酸木糖[7]。于是,研究者猜测UGDH的产物UDPGA是一种有毒代谢物,只有表达高水平UGDH产生大量UDPGA的细胞才会依赖UXS1进行解毒。为了证实这个猜想,研究者在19个不同组织来源、不同UGDH mRNA表达水平的癌细胞系中,通过慢病毒转导CRISPR-Cas9敲除UXS1(UXS1 KO),发现敲除UXS1只对表达高水平UGDH的细胞系有害,且UXS1 KO具有靶向性(图一e-g)。研究者还构建了多西环素(dox)诱导的UXS1敲除细胞系(iKO),结果显示UXS1的敲除导致细胞周期缺陷和细胞凋亡(图一h和i)。以上数据表明,UXS1敲除仅选择性影响具有高UGDH表达水平的癌症细胞,于是研究者将酶UXS1作为候选解毒剂。
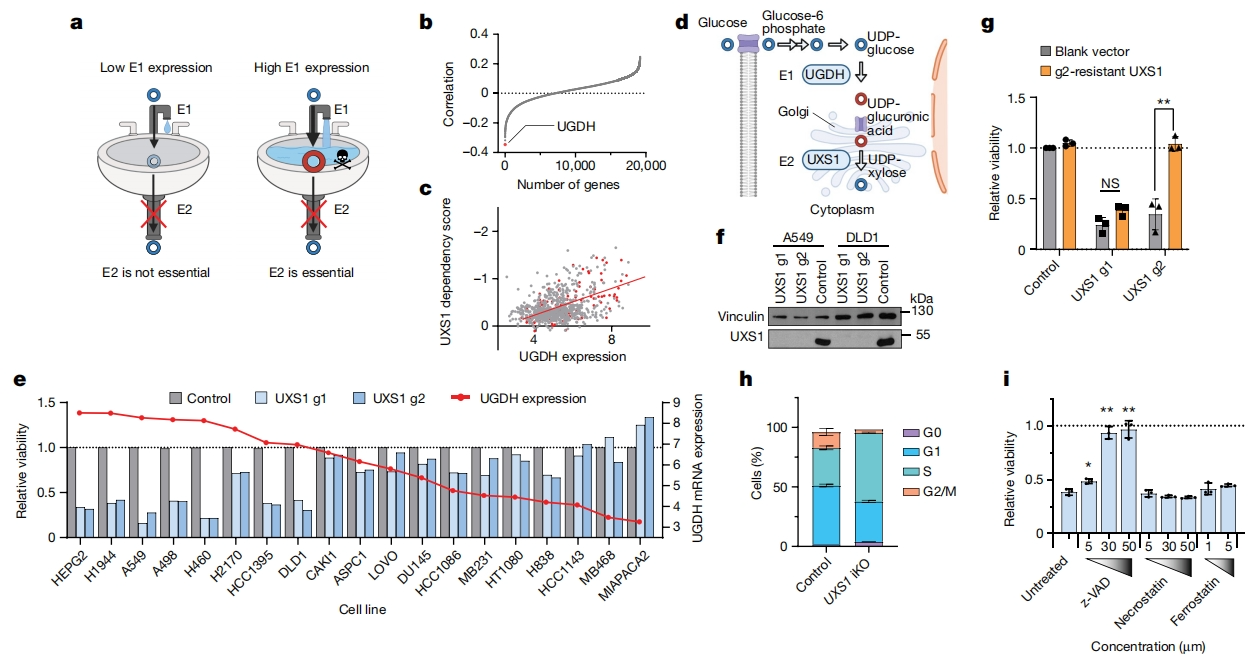
图一 UXS1以细胞特异性表达UGDH的方式对细胞存活至关重要[4]
接下来,研究者分析UXS1 KO毒性的两个潜在机制。其一,UXS1底物的积累可能是有毒的;其二,UXS1下游产物的缺失可能是有害的。为此,研究者通过液相色谱-质谱法(LC-MS)发现UXS1敲除后,细胞内以时间依赖的方式导致了大约70倍的UDPGA积累,而其他几种UDP糖类没有受到实质性影响(图二a)。使用标记的[U-13C]葡萄糖进行追踪,证实UXS1 KO导致UDP-木糖的形成完全消失(图二b和c)。为测试“厨房水槽”模型(图二d),研究者破坏UGDH以防止UDPGA的产生(图二e),这完全保护了A549和DLD1细胞免受UXS1敲除的毒性影响(图二f和g)。类似的,用一种通过葡萄糖醛酸化从而消耗UDPGA的药物4MU处理,也能将这些细胞从UXS1敲除毒性中拯救出来(图二h)。通过过表达UGDH促使原本低UGDH表达、对UXS1 KO毒性不敏感的细胞也变得敏感(图二i和j)。在UXS1 KO细胞中,随着UDP-木糖产量的损失,UDPGA的产生速率大大增加,这意味着UGDH的活性增加(图二k)。这与之前的报道一致,即UDP-木糖可在负反馈回路中抑制UGDH活性[8]。在UXS1 KO细胞中观察到的UDPGA积累是UXS1对UDPGA的清除缺失和更高的UGDH活性协同导致的(图二l)。以上数据表明,UXS1可以防止毒性UDPGA的积累。
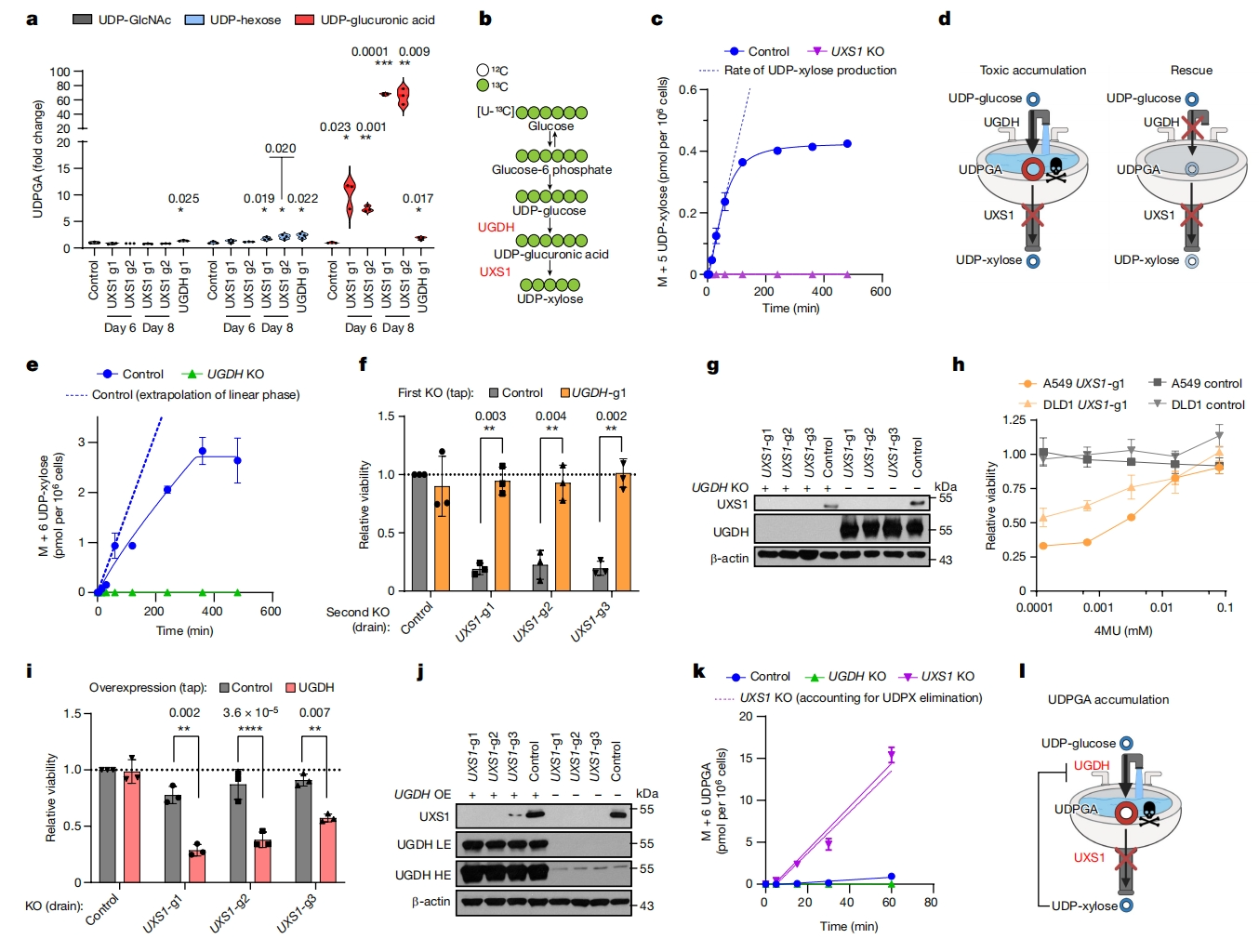
图二 UGDH产生的UDPGA需要UXS1进行解毒[4]
下一步,研究者探索UXS1缺失后的UDPGA积累对细胞毒性的作用机制。对UXS1 KO癌细胞进行mRNA测序,基因集富集分析表明,UXS1 KO后诱导了与高尔基体功能相关的基因表达,以及下调了细胞周期和DNA损伤修复反应基因(图三a)。免疫标记和电子显微镜显示,UXS1的缺失显著改变了高尔基体的形态,导致高尔基体的顺式、反式和中间成分异常扩散到整个细胞的多个区域(图三b-d)。使用4MU或UGDH KO消耗UDPGA,挽救了UXS1 KO细胞中的高尔基体形态,表明高尔基体形态改变是UDPGA积累的结果(图三e)。分析UXS1缺失后A549细胞的N-连接和O-连接糖基化谱,发现糖基化模式总体发生变化(图三f)。高尔基体是细胞表面蛋白的末端糖基化和运输的场所,如在癌症生物学中具有重要作用的生长因子受体和其他表面标志物[9]。因此,研究者检测各种细胞表面受体EGFR、CD44、FGFR1、FGFR4和IGF1R是否存在糖基化缺陷,发现UXS1的缺失导致所有这些受体的凝胶迁移增加,表明糖基化有缺陷(图三g),提示UXS1缺失引起的高尔基体功能障碍,阻碍了细胞表面重要糖蛋白的正常成熟。EGFR是一种上游致癌信号组分,是非小细胞肺癌和胶质母细胞瘤等癌症增殖和生存所必需的[10]。敲除UXS1导致EGFR在细胞膜上缺失,整体表达水平下降(图三h和i)。此外,研究者还检测了UXS1 iKO细胞对EGF有丝分裂原的反应能力,缺乏UXS1的细胞不能对EGF作出正确的反应,不能进行EGFR的自磷酸化,这是EGFR信号级联的典型初始步骤(图三j)。以上数据表明,UXS1缺失后UDPGA的积累改变了高尔基体的结构和功能。
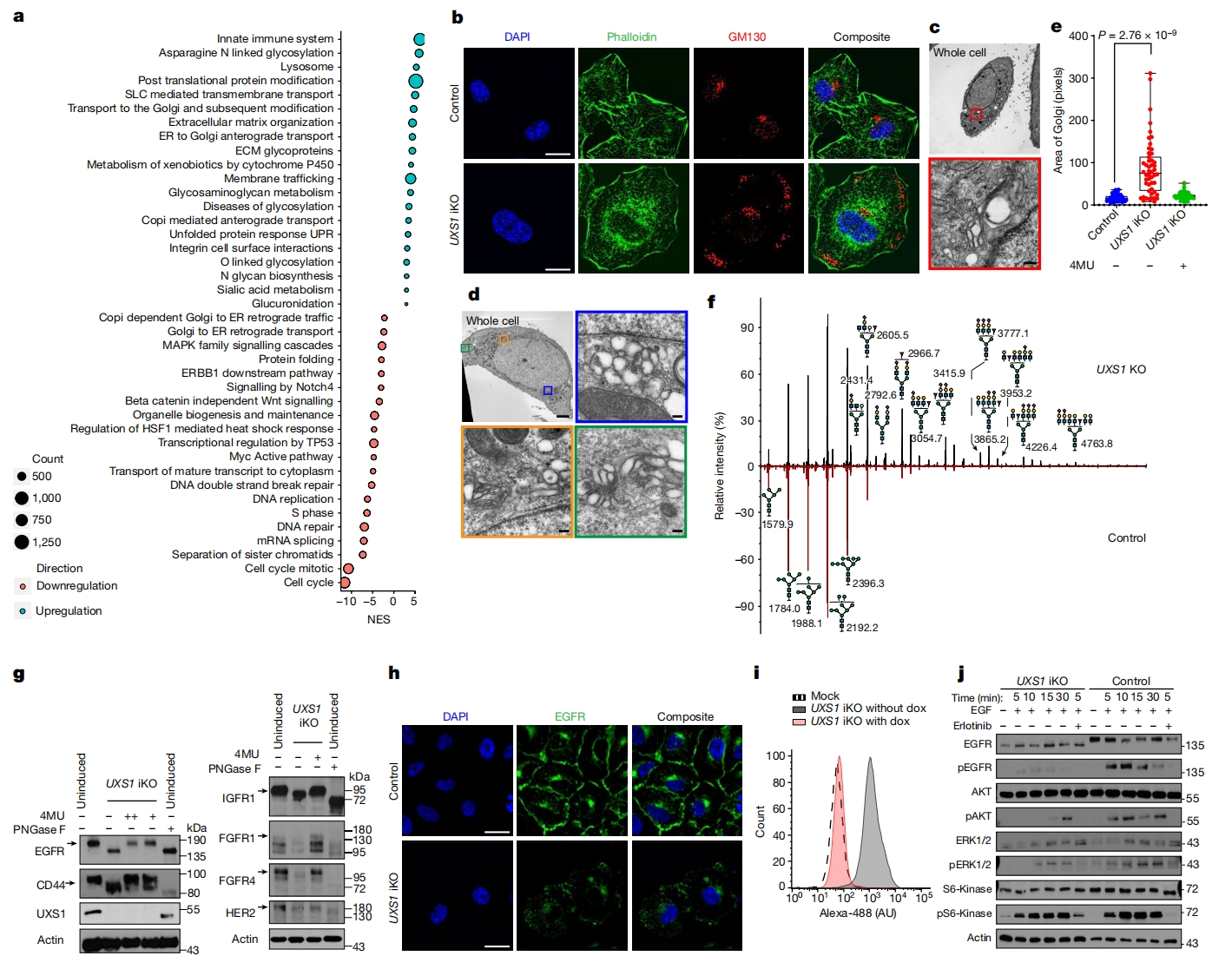
图三 UDPGA积累导致高尔基体功能障碍[4]
最后,研究者探究UXS1缺失对体内肿瘤的效果。使用dox诱导三种皮下异种移植物模型的UXS1 KO。对于两个UGDH高表达的细胞系A549和H460,UXS1缺失导致肿瘤生长迟缓,并显著延长小鼠生存期(图四a和b,d和e)。在UGDH低表达细胞系HT1080中,UXS1缺失对肿瘤生长和总生存率没有影响(图四c和f)。以上数据表明,靶向UXS1具有肿瘤治疗潜力,其效果取决于肿瘤的高UGDH状态。
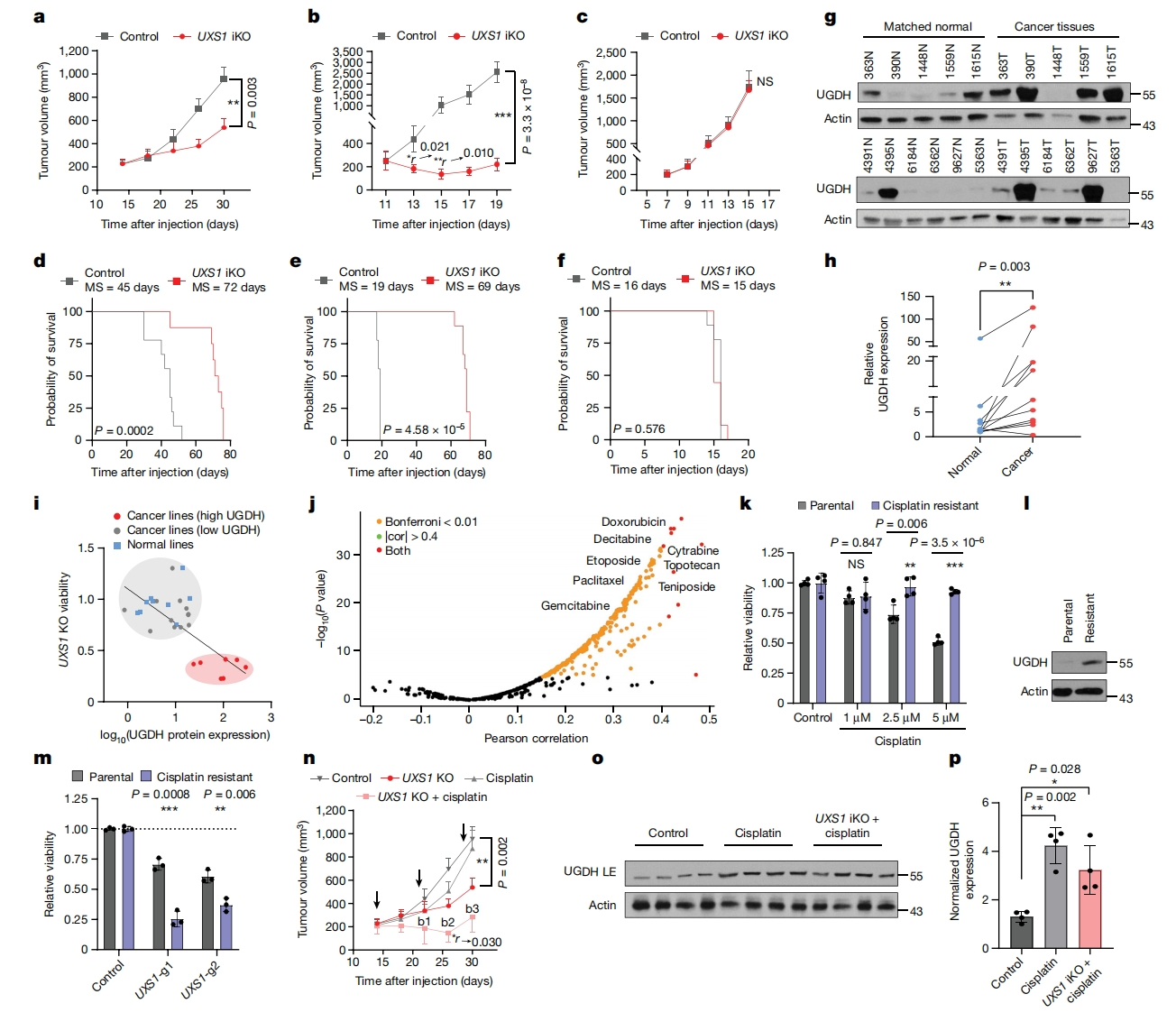
图四 UXS1是一种癌症选择性治疗靶点[4]
研究者通过比较肿瘤和邻近正常组织,观察到肺癌和乳腺癌中的UGDH升高,表明靶向UXS1会损伤癌细胞,而不会伤害正常细胞(图四g和h),非癌(原代或永生)细胞系的UGDH低水平也使得它们对UXS1 KO不敏感(图四i)。分析发现,UGDH表达升高与许多药物的耐药增加相关,包括阿霉素、紫杉醇和吉西他滨(图四j)。于是,研究者研究化疗药物的暴露是否诱导UGDH,分别建立肺癌细胞系(H2170)、三阴性乳腺癌系(MDAMB231)和患者来源的类器官(TPN1和TPN2)的顺铂耐药细胞株。与原细胞株相比,这些耐药细胞株显示了UGDH的高表达以及对UXS1 KO的敏感性增加(图四k-m)。在A549异种移植模型中,化疗诱导了肿瘤中的UGDH高表达,并与UXS1 iKO协同抑制肿瘤生长(图四n-p)。以上数据表明,癌细胞的化疗耐药亚群或接受化疗药物治疗的癌细胞可诱导UGDH高表达,进而靶向UXS1可能对这些癌细胞有害,可作为一个癌症治疗靶点。
综上所述,该研究发现UXS1清除UDPGA是某些细胞维持高尔基体稳态的关键条件,且只有高表达UGDH的细胞才需要这种解毒功能。相对于健康细胞,多种类型癌细胞的UGDH都表达升高,并且仅在这些癌细胞中,破坏UXS1可导致异常的高尔基体形态和糖基化缺陷,从而导致细胞死亡。基于此,UXS1可作为一个新的癌症选择性治疗靶点,但是治疗效果在不同肿瘤类型和患者个体之间可能存在差异,需要进一步评估临床应用的安全性和有效性。此外,该研究还揭示了糖核苷酸代谢途径与调节信号转导过程之间的一个意想不到的联系:由UXS1损伤和UDPGA积累导致的高尔基体功能障碍还会损害细胞表面糖蛋白的成熟。该研究证明了这种糖核苷酸代谢途径“漏洞”对癌症治疗的重要意义,也提示其在下调胞外信号转导方面的细胞生物学广谱应用前景。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hanahan D, Weinberg RA: Hallmarks of cancer: the next generation. Cell 2011, 144(5):646-674.
2. Kim D, Fiske BP, Birsoy K, Freinkman E, Kami K, Possemato RL, Chudnovsky Y, Pacold ME, Chen WW, Cantor JR et al: SHMT2 drives glioma cell survival in ischaemia but imposes a dependence on glycine clearance. Nature 2015, 520(7547):363-367.
3. Lee N, Spears ME, Carlisle AE, Kim D: Endogenous toxic metabolites and implications in cancer therapy. Oncogene 2020, 39(35):5709-5720.
4. Doshi MB, Lee N, Tseyang T, Ponomarova O, Goel HL, Spears M, Li R, Zhu LJ, Ashwood C, Simin K et al: Disruption of sugar nucleotide clearance is a therapeutic vulnerability of cancer cells. Nature 2023, 623(7987):625-632.
5. Meyers RM, Bryan JG, McFarland JM, Weir BA, Sizemore AE, Xu H, Dharia NV, Montgomery PG, Cowley GS, Pantel S et al: Computational correction of copy number effect improves specificity of CRISPR-Cas9 essentiality screens in cancer cells. Nat Genet 2017, 49(12):1779-1784.
6. Radominska-Pandya A, Bratton SM, Redinbo MR, Miley MJ: The crystal structure of human UDP-glucuronosyltransferase 2B7 C-terminal end is the first mammalian UGT target to be revealed: the significance for human UGTs from both the 1A and 2B families. Drug metabolism reviews 2010, 42(1):133-144.
7. Axelrod J, Kalckar HM, Maxwell ES, Strominger JL: Enzymatic formation of uridine diphosphoglucuronic acid. The Journal of biological chemistry 1957, 224(1):79-90.
8. Beattie NR, Keul ND, Sidlo AM, Wood ZA: Allostery and Hysteresis Are Coupled in Human UDP-Glucose Dehydrogenase. Biochemistry-Us 2017, 56(1):202-211.
9. Stanley P: Golgi glycosylation. Cold Spring Harb Perspect Biol 2011, 3(4).
10. Normanno N, De Luca A, Bianco C, Strizzi L, Mancino M, Maiello MR, Carotenuto A, De Feo G, Caponigro F, Salomon DS: Epidermal growth factor receptor (EGFR) signaling in cancer. Gene 2006, 366(1):2-16.



