技术分享:NMU调节小肠嗜酸性粒细胞促进粘膜免疫
嗜酸性粒细胞是从骨髓(BM)中髓系祖细胞发育而来的粒细胞,可以渗透到各种器官内[1]。它们通常被认为是2型免疫反应相关的效应细胞。然而,在稳态条件下,嗜酸性粒细胞在小肠中特别丰富[2],调节着多种生理过程[3]。小肠嗜酸性粒细胞表现出独特的表面蛋白、转录状态和脱颗粒现象,这表明它们在小肠中经历了组织适应过程。然而,调节小肠嗜酸性粒细胞反应的组织来源线索仍知之甚少。
神经调节肽U(NMU)能有效激活2型固有淋巴细胞(ILC2),促进粘膜组织中的2型免疫反应。先前的一项研究表明,NMU及其受体NMUR1的NMU-NMUR1信号在过敏性炎症反应中可诱导嗜酸性粒细胞浸润到肺部[4]。然而,最近有两项研究报道嗜酸性粒细胞并不表达NMUR1[5, 6]。因此,NMU可否直接调节嗜酸性粒细胞反应是存在争议的。
2023年9月,Science期刊报道了一项NMU通过嗜酸性粒细胞调节小肠稳态和粘膜免疫的研究,通过对小鼠不同组织来源的嗜酸性粒细胞进行转录组分析,发现一个小肠嗜酸性粒细胞亚群表达神经调节蛋白U受体1(NMUR1)。NMUR1在小肠嗜酸性粒细胞中的表达由局部微环境调控,并在炎症下进一步增强表达。NMU通过刺激小肠中NMUR1阳性嗜酸性粒细胞来调节上皮细胞分化和屏障免疫,突出了神经-免疫-上皮系统的互作在维持组织稳态中的重要性[7]。
首先,研究者表征嗜酸性粒细胞在小肠中的特异性分子特征。使用RNA测序(RNA-seq)分析来自不同小鼠组织的嗜酸性粒细胞。t分布随机邻域嵌入(t-SNE)分析显示,嗜酸性粒细胞在脾脏和血液中表现出相似的转录状态,而在其他不同组织中的表现则各不相同(图一A)。BM和小肠中的嗜酸性粒细胞的转录基因占大多数(图一B)。BM特异性转录基因主要包括反映祖细胞阶段的有丝分裂基因。相反,皮肤、结肠、肺和小肠中的嗜酸性粒细胞表达不同的细胞因子和多种促炎信号受体(图一B)。进一步对组织特异性基因进行排序(图一C),发现Nmur1是小肠嗜酸性粒细胞中最显著表达的基因之一(图一C和D)。随后,研究者使用单细胞RNA-seq(scRNA-seq)来进一步表征小肠嗜酸性粒细胞的转录异质性。统一流形逼近与投影(UMAP)分析确定了三个细胞簇(图一E)。簇1(C1)细胞表现出Nmur1的最高表达(图一F),以及小肠特异性基因转录的富集(图一B和C),包括参与胆固醇生物合成、脱颗粒和分泌囊泡形成的基因。相反,在C1细胞中,参与细胞因子介导的信号通路和细胞粘附的基因被下调。因此,相对于其他组织,嗜酸性粒细胞在小肠中的独特转录程序(图一B和C)主要归因于表达Nmur1的C1细胞。
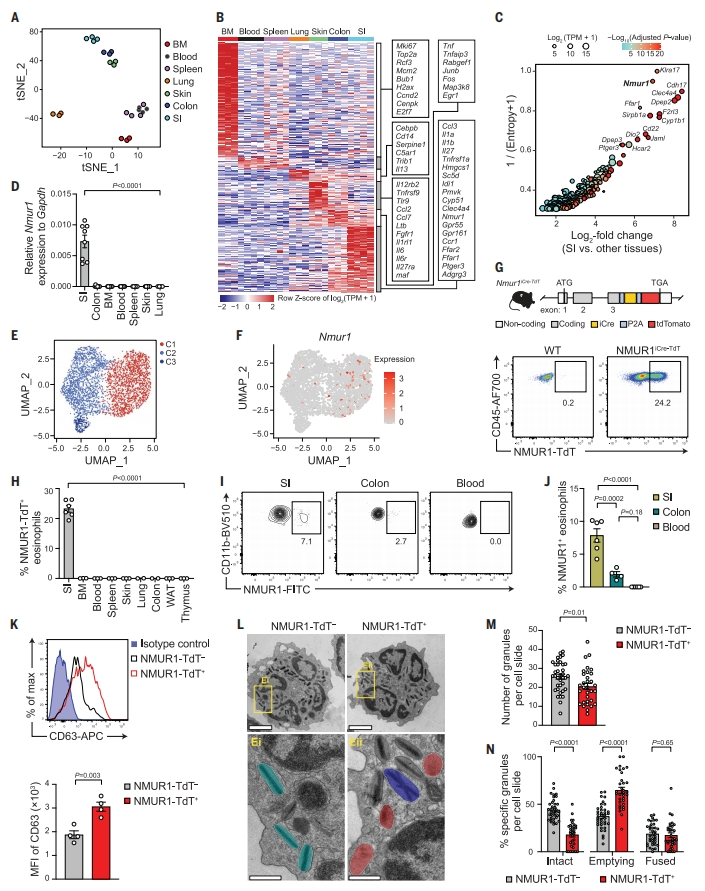
图一 转录组分析发现NMUR1+ 嗜酸性粒细胞亚群处于主动脱颗粒状态[7]
于是,研究者追踪内源性NMUR1的表达,通过在内源性Nmur1基因的最后一个编码外显子后插入P2A-iCre-P2A-tdTomato产生Nmur1iCre-TdT敲入小鼠,tdTomato荧光可指示Nmur1基因的表达(图一G)。在Nmur1iCre-TdT小鼠中,检测到NMUR1在ILC2以及小肠嗜酸性粒细胞亚群中表达,但在其他器官中不表达(图一G和H)。与小鼠结果一致,在多个人类组织活检中,小肠中的嗜酸性粒细胞与血液和结肠中的相比也显示出显著更高的NMUR1蛋白水平(图一I和J)。进而研究者利用Nmur1iCre-TdT小鼠来表征NMUR1+ 小肠嗜酸性粒细胞。NMUR1+ 嗜酸性粒细胞上调基因参与脱颗粒,如Cd63和胆固醇生物合成,这是产生膜以促进有效的细胞内颗粒形成和分泌囊泡所必需的[8]。蛋白质水平上证实CD63在NMUR1+ 嗜酸性粒细胞中的表达增加(图一K)。为了确定嗜酸性粒细胞群体之间的脱颗粒活性是否不同,研究者使用透射电子显微镜(TEM),发现与NMUR1- 嗜酸性粒细胞相比,NMUR1+ 嗜酸性粒细胞中的细胞内颗粒显著减少(图一L和M),排空颗粒的比例(脱颗粒现象)显著增加,完整颗粒的比例显著下降(图一L和N)。以上数据表明,小肠嗜酸性粒细胞中NMUR1的表达与脱颗粒活性增强有关。
接下来,研究者探究NMUR1+ 嗜酸性粒细胞的个体发生,将Nmur1iCre-TdT小鼠与携带ROSA26-LoxP-STOP-LoxP-GFP的小鼠杂交(图二A)。tdTomato和GFP在小肠中的几乎所有嗜酸性粒细胞中共表达(图二A),表明NMUR1+ 嗜酸性粒细胞不能转化为NMUR1- 细胞。Nmur1iCre-TdT小鼠给予仅由嗜酸性粒细胞祖细胞摄取的5-乙炔基-2′-脱氧尿苷(EdU)[9],以评估NMUR1+ 小肠嗜酸性粒细胞的补充率。在EdU注射后的第7、10和14天,小肠中EdU+ NMUR1+ 嗜酸性粒细胞的比率明显低于NMUR1- 对照(图二B和C),表明NMUR1+ 嗜酸性粒细胞在小肠中的补充延迟。为探究NMUR1是否在归巢到小肠后才被诱导表达,研究者将CD45.2+ Nmur1iCre-TdT小鼠BM细胞移植到预先辐照的CD45.1+ 受体中,新产生的CD45.2+ 嗜酸性粒细胞在移植后第7天到达小肠,而NMUR1+ 嗜酸性粒细胞直到第14天才出现(图二D),表明在稳态小肠中NMUR1的表达是通过长期驻留和持续暴露于局部微环境来编程的。
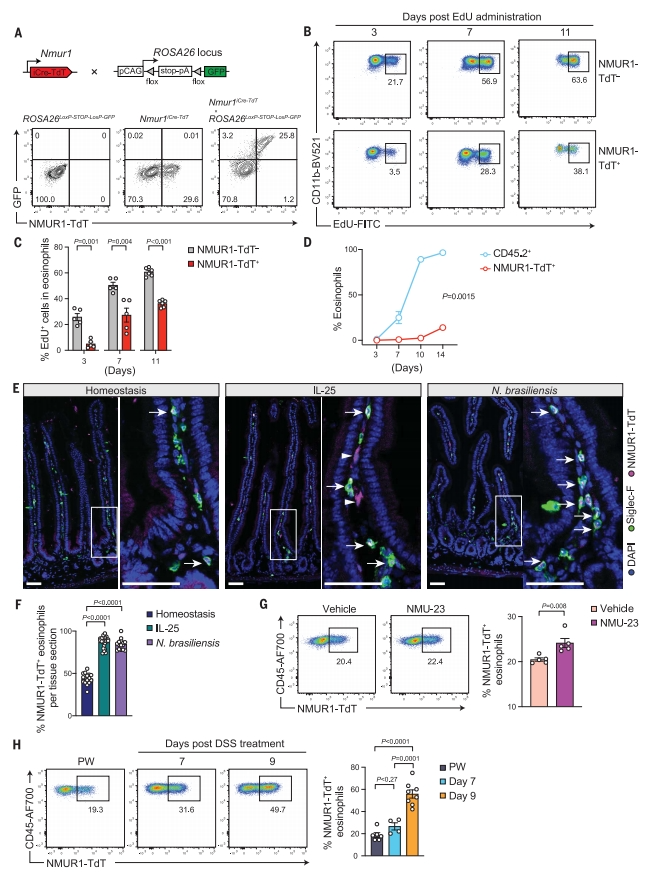
图二 组织特异性微环境和炎症信号协同调节小肠嗜酸性粒细胞的NMUR1表达[7]
随后,研究者研究炎症条件下小肠嗜酸性粒细胞中NMUR1的表达动力学,用重组白细胞介素-25(IL-25)或巴西日圆线虫(N.brasiliensis)感染Nmur1iCre-TdT小鼠。两种刺激都显著增加了NMUR1+ 小肠嗜酸性粒细胞的比率(图二E和F)。IL-25还诱导NMUR1在一些绒毛细胞中表达,这些细胞形态上类似于非造血谱系的细胞(图二E)。此外,通过用外源性23-残基NMU肽(NMU-23)或右旋糖酐硫酸钠(DSS)处理,小肠中NMUR1+ 嗜酸性粒细胞的比率增加(图二G和H)。以上数据表明,NMUR1在小肠嗜酸性粒细胞中的表达是由组织特异性微环境调控的,并且在炎症下进一步诱导。
为了揭示NMUR1体内调节嗜酸性粒反应的功能,研究者将Rag2–/– Il2rg–/–(dKO)小鼠与Nmur1–/–小鼠交配,得到Nmur1–/– dKO小鼠,以排除NMUR1在ILC2和小肠中的少量T细胞的表达,并证实在dKO背景下,嗜酸性粒细胞是唯一表达NMUR1的造血细胞类型。在Nmur1–/– dKO小鼠,尽管小肠中免疫细胞的总数与Nmur1+/+ dKO同窝对照组相当,但Nmur1缺失显著降低了小肠嗜酸性粒细胞的比率和数量(图三A)。为排除NMUR1+ 非造血细胞的潜在贡献,将Nmur1-/- dKO小鼠BM移植到预先辐照的Nmur1+/+ dKO小鼠中,产生嗜酸性粒细胞嵌合体(eosinophil△Nmur1)。发现与对照相比,eosinophil△Nmur1小鼠的小肠嗜酸性粒细胞的比率和数量减少(图三B和C),表明NMUR1对小肠嗜酸性粒细胞的调节作用与其在非造血细胞中的表达无关。
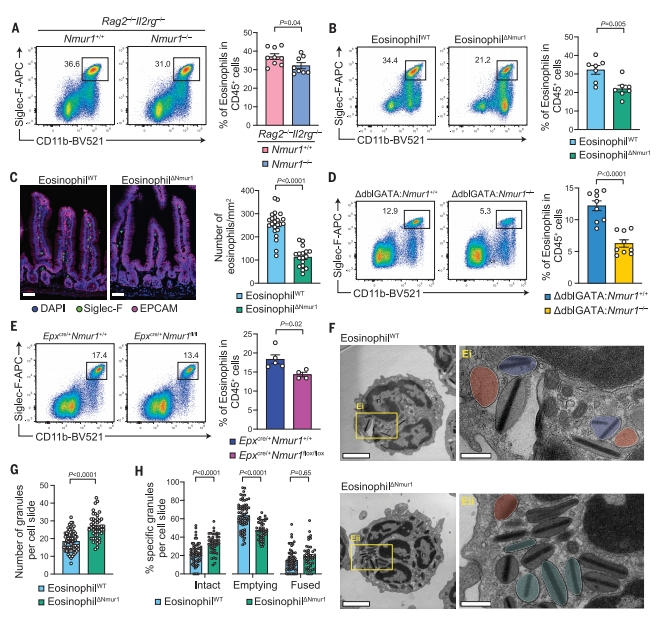
图三 NMUR1缺失导致小肠嗜酸性粒细胞数量和脱颗粒的减少[7]
ILC2和T细胞可以调节嗜酸性粒细胞的数量[1]。为确定NMUR1对小肠嗜酸性粒细胞的作用是否依赖ILC2和T细胞,研究者将20%的Nmur1-/- 或Nmur1+/+ BM与80%的嗜酸性粒细胞缺陷小鼠(△dblGATA)BM[10] 混合来产生BM嵌合体,证实移植△dblGATA-Nmur1-/- 小鼠的小肠嗜酸性粒细胞中NMUR1缺乏,但是小肠中包括ILC2和T细胞在内的几种主要免疫细胞类型的比率与对照组相当。然而,与对照组相比,△dblGATA-Nmur1-/- 小鼠的小肠,而不是BM的嗜酸性粒细胞比率显著降低(图三D)。随后,研究者构建嗜酸性粒细胞特异性Nmur1敲除小鼠(EpxCre/+ Nmur1flox/flox),其小肠嗜酸性粒细胞的比率相比对照组显著降低(图三E)。以上数据表明,NMUR1以细胞固有的方式维持小肠中嗜酸性粒细胞的数量。
由于NMUR1的表达与脱颗粒增强有关(图一L-N),研究者探究NMU-NMUR1信号是否支持小肠嗜酸性粒细胞在稳态下的持续脱颗粒。NMU刺激后,NMUR1缺失小鼠的嗜酸性粒细胞内颗粒数量显著高于对照小鼠(图三F和G)。此外,NMUR1缺失增加了小肠嗜酸性粒细胞中完整颗粒的比率,并降低了排空颗粒的比率(图三F和H)。以上数据表明,NMUR1介导的信号传导维持小肠中嗜酸性粒细胞的数量并促进其脱颗粒。
由于巴西日圆线虫感染可显著诱导NMUR1表达(图二E和F),并且嗜酸性粒细胞对驱除寄生虫很重要。进而研究者使用巴西日圆线虫感染NMUR1缺陷小鼠,以研究NMUR1依赖性嗜酸性粒细胞在粘膜免疫中的功能。与对照小鼠相比,Nmur1-/- dKO小鼠的寄生虫负荷增加,反映出它们的抗寄生虫免疫力下降。在eosinophil△Nmur1、△dblGATA-Nmur1-/-和EpxCre/+ Nmur1flox/flox小鼠中也观察到类似的增加(图四A和B),表明NMUR1在嗜酸性粒细胞中具有介导抗寄生虫粘膜免疫的细胞固有功能。与寄生虫排出缺陷一致,NMUR1缺失小鼠的杯状细胞增生显著减少(图四C)。研究者测试NMU-NMUR1信号是否介导这种嗜酸性粒细胞-上皮细胞回路,在稳态下分析NMUR1缺失小鼠小肠中的杯状细胞,发现嗜酸性粒细胞中的NMUR1缺失导致杯状细胞数量显著减少(图四D和E)。此外,移植Nmur1+/+ BM来源的嗜酸性粒细胞(BMDE),而不是Nmur1-/- BMDE,显著恢复了Nmur1–/– dKO小鼠的杯状细胞数量(图四F和G)。以上数据表明,NMUR1在嗜酸性粒细胞中具有促进杯状细胞分化的关键细胞内在功能。
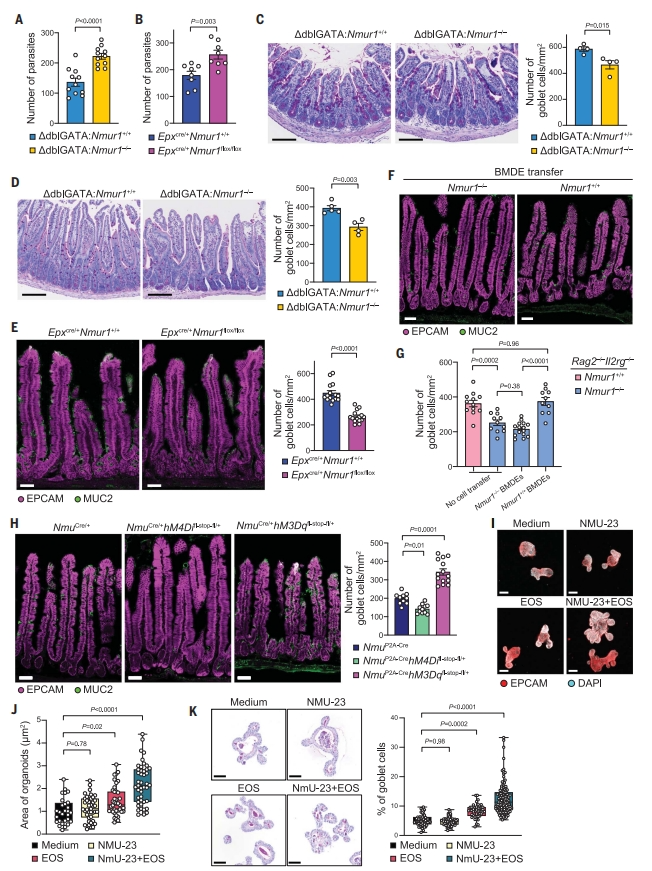
图四 嗜酸性粒细胞介导的杯状细胞分化和寄生虫驱除依赖于NMU-NMUR1途径[7]
NMU由肠中的胆碱能神经元产生[11]。研究者在小肠的电子显微镜(EM)成像中观察到嗜酸性粒细胞靠近神经元,因此,进一步探究直接抑制或激活NMU表达细胞是否影响嗜酸性粒细胞调节杯状细胞分化的功能。采用化学遗传学策略小鼠(DREADD),该小鼠受体的表达由配体药物氯氮平N-氧化物(CNO)特异性激活[12]。CNO给药分别降低或增加了表达抑制性DREADD hM4Di(NmuIRES-Cre hM4Difl-stop-fl/+)或激活性DREADD hM3Dq(NmuIRES-Cre hM3Dqfl-stop-fl/+)小鼠的NMU丰度。在表达hM4Di的小鼠小肠中杯状细胞的数量减少,相反,表达hM3Dq的小鼠在给予CNO后表现出杯状细胞数量增加、粘液分泌和异常绒毛结构(图四H)。
最后,研究者建立嗜酸性粒细胞类器官共培养系统,直接分析NMU依赖性嗜酸性粒-上皮细胞相互作用。将新分离的小肠嗜酸性粒细胞添加到肠类器官培养物中发现显著增加类器官生长。额外补充NMU进一步增加了类器官生长、出芽结构形成和复杂的隐窝绒毛结构(图四I和J)。此外,在与嗜酸性粒细胞和NMU共培养的肠道类器官中观察到最高密度的杯状细胞(图四K)。以上数据表明,小肠嗜酸性粒细胞促进杯状细胞分化,且该分化过程是由NMU-NMUR1信号调控。
综上所述,研究者利用转录组分析鉴定出小肠嗜酸性粒细胞的一个亚群表达NMUR1,NMUR1的表达受组织微环境调节,并因炎症而增加表达。NMUR1可维持小肠中的嗜酸性粒细胞数量并促进脱颗粒。肠道神经信号NMU通过刺激NMUR1阳性的小肠嗜酸性粒细胞来调节上皮细胞分化和粘膜免疫。该研究证实了NMU-NMUR1通路在调控嗜酸性粒细胞活性中的重要作用,为神经-免疫-上皮系统之间的互作提供给了新的见解,也为理解嗜酸性粒细胞的新功能及其相关临床疾病研究开辟了新的思路。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Rothenberg ME, Hogan SP: The eosinophil. Annual review of immunology 2006, 24:147-174.
2. DeBrosse CW, Case JW, Putnam PE, Collins MH, Rothenberg ME: Quantity and distribution of eosinophils in the gastrointestinal tract of children. Pediatric and developmental pathology : the official journal of the Society for Pediatric Pathology and the Paediatric Pathology Society 2006, 9(3):210-218.
3. Shah K, Ignacio A, McCoy KD, Harris NL: The emerging roles of eosinophils in mucosal homeostasis. Mucosal immunology 2020, 13(4):574-583.
4. Moriyama M, Fukuyama S, Inoue H, Matsumoto T, Sato T, Tanaka K, Kinjyo I, Kano T, Yoshimura A, Kojima M: The neuropeptide neuromedin U activates eosinophils and is involved in allergen-induced eosinophilia. American journal of physiology Lung cellular and molecular physiology 2006, 290(5):L971-977.
5. Tsou AM, Yano H, Parkhurst CN, Mahlakõiv T, Chu C, Zhang W, He Z, Jarick KJ, Zhong C, Putzel GG et al: Neuropeptide regulation of non-redundant ILC2 responses at barrier surfaces. Nature 2022, 611(7937):787-793.
6. Jarick KJ, Topczewska PM, Jakob MO, Yano H, Arifuzzaman M, Gao X, Boulekou S, Stokic-Trtica V, Leclère PS, Preußer A et al: Non-redundant functions of group 2 innate lymphoid cells. Nature 2022, 611(7937):794-800.
7. Li Y, Liu S, Zhou K, Wang Y, Chen Y, Hu W, Li S, Li H, Wang Y, Wang Q et al: Neuromedin U programs eosinophils to promote mucosal immunity of the small intestine. Science 2023, 381(6663):1189-1196.
8. Spencer LA, Bonjour K, Melo RCN, Weller PFJFiI: Eosinophil Secretion of Granule-Derived Cytokines. 2014, 5:496.
9. Carlens J, Wahl B, Ballmaier M, Bulfone-Paus S, Förster R, Pabst O: Common gamma-chain-dependent signals confer selective survival of eosinophils in the murine small intestine. J Immunol 2009, 183(9):5600-5607.
10. Yu C, Cantor AB, Yang H, Browne C, Wells RA, Fujiwara Y, Orkin SH: Targeted deletion of a high-affinity GATA-binding site in the GATA-1 promoter leads to selective loss of the eosinophil lineage in vivo. The Journal of experimental medicine 2002, 195(11):1387-1395.
11. Drokhlyansky E, Smillie CS, Van Wittenberghe N, Ericsson M, Griffin GK, Eraslan G, Dionne D, Cuoco MS, Goder-Reiser MN, Sharova T et al: The Human and Mouse Enteric Nervous System at single-Cell Resolution. Cell 2020, 182(6):1606-1622.e1623.
12. Roth BL: DREADDs for Neuroscientists. Neuron 2016, 89(4):683-694.



