技术分享:描绘小细胞肺癌蛋白基因组学图谱
肺癌是全球癌症死亡的主要原因[1]。小细胞肺癌(SCLC)仅占所有肺癌人群的15%,却是一种极其致命的恶性肿瘤亚型,5年生存率仅为5%,是癌症相关死亡的第六大原因[2]。SCLC是一种侵袭性神经内分泌(NE)肿瘤,以快速增殖和转移为特征,具有显著的治疗耐药性,预后极差[3]。在过去的几十年里,SCLC的治疗进展缓慢,患者生存率没有显著提高,尚未批准用于SCLC的靶向治疗,因而仍不在精准治疗的范畴内。
SCLC 的全基因组分析揭示其基因突变图谱的复杂性。TP53和RB1的失活在SCLC中频繁发生[4],但突变谱没能建立分子亚型或确定有效的治疗靶点,可能是因为DNA水平上鉴定到的一些基因突变并不会导致基因或蛋白表达的变化。另外,基于转录因子表达谱共识定义的SCLC亚型[5],对实际亚型治疗的直接影响有限。SCLC领域的一个主要障碍是可用于详细分子表征的肿瘤样本稀缺,特别是蛋白质水平的分子表征。因此,迫切需要收集高质量的样本,以更好地了解这种癌症的分子基础,加快临床和基础研究。
2024年1月,Cell期刊报道了一项小细胞肺癌(SCLC)的蛋白基因组图谱描绘,使用配对肿瘤和正常邻近组织对112个小细胞肺癌标本进行了基因组、转录组、蛋白质组和磷酸化蛋白质组的多组学综合分析,揭示基因组改变的功能影响,强调FAT1突变、RB1和染色体5q缺失的致癌作用。确定了两种预后生物标志物HMGB3和CASP10,其中过表达HMGB3通过转录调控细胞连接相关基因来促进SCLC细胞迁移。免疫微环境特征揭示了ZFHX3突变与高免疫浸润之间的相关性,强调了通过抑制cGAS-STING途径提高DNA损伤反应活性的潜在免疫抑制作用。多组学聚类鉴定了四个能够特异性靶向治疗的SCLC亚型。该研究扩展了人们对小细胞肺癌生物学的理解,为患者的精准治疗提供了信息,将有助于更有效的小细胞肺癌临床治疗,并为基础和临床研究人员提供宝贵的资源[6]。
首先,研究者表征SCLC的蛋白基因组。前瞻性地收集了112例手术切除的治疗初期原发性SCLC肿瘤和配对正常邻近组织(NAT)作为研究队列(TU-SCLC)。对所有样品进行冷冻粉碎和等分,以进行组学分析,进行全外显子组测序(WES)、RNA测序(RNA-seq)、等压串联质谱标签(TMT)化学标记的定量蛋白质组学和磷酸化蛋白质组学分析(图一A)。总共鉴定出28471个非同义体细胞突变和27080个体细胞拷贝数改变(SCNA)。基于TMT的蛋白质组分析鉴定了11209种蛋白质,磷酸化蛋白质组分析从9373种磷酸化蛋白质中鉴定了62881个可靠定位的磷酸化位点(图一A)。TU-SCLC队列中最常见的突变基因是TP53(72%)和RB1(56%),只有9(8%)例肿瘤的TP53和RB1在基因组水平上没有变化(图一B),表明TP53和RB1失活对SCLC肿瘤发生具有重要作用。但是,TU-SCLC队列中TP53的突变率相对低于主要来自西方人群的队列中观察到的突变率[4, 7],但与日本队列中的突变率相当[8](图一C)。此外,在TU-SCLC队列中观察到ZFHX3高突变率(19%)(图一C)。TU-SCLC的中位肿瘤突变负荷(TMB)为每百万个碱基对5.45个非同义突变,TMB高的患者总生存期(OS)更高(图一D),提示TMB在SCLC中的潜在预后价值。
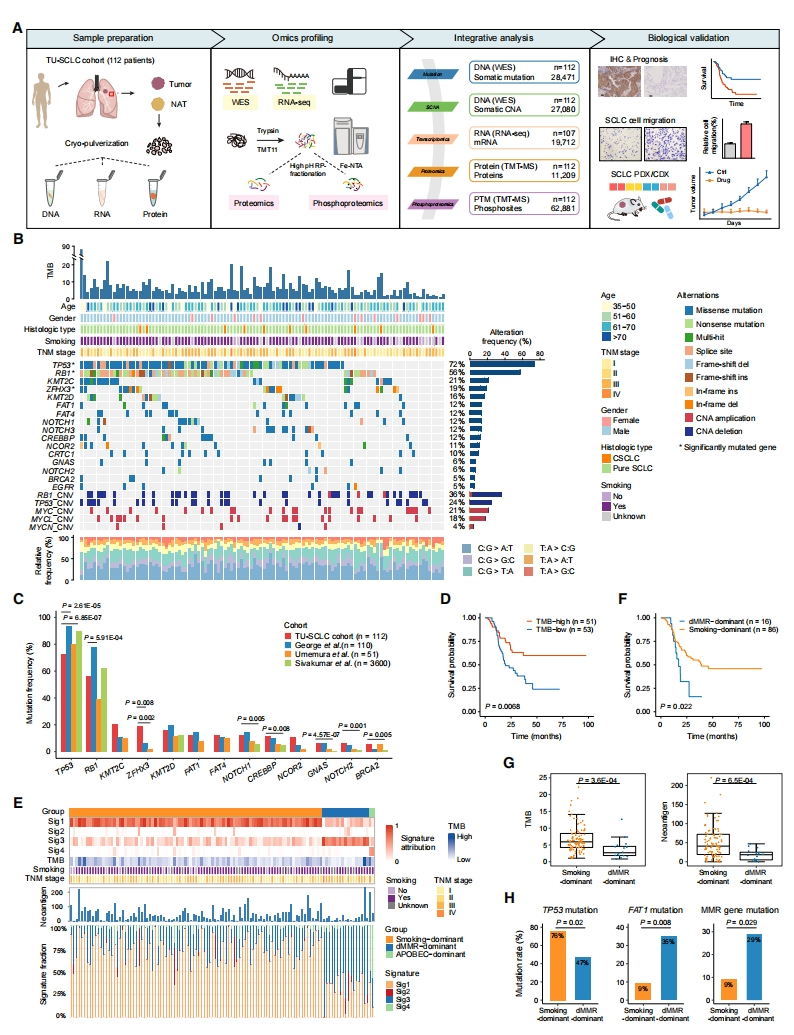
图一 TU-SCLC队列的基因组概况[6]
研究者根据突变三核苷酸序列基序频率确定了四种突变特征(Sig1-4)。其中,烟草诱变剂暴露与Sig1和Sig2最匹配,DNA错配修复缺陷(dMMR)与Sig3相关,Sig4具有APOBEC胞苷脱氨酶的特征。根据突变特征贡献,93名(83%)患者被归类为吸烟,17名(15%)患者为dMMR,只有2名(2%)患者为APOBEC(图一E)。重要的是,dMMR占比高的患者表现出更差的OS(图一F),而吸烟占比高的肿瘤具有显著更高的TMB和新抗原负荷(图一G)。与吸烟相比,在dMMR占比高的肿瘤中,TP53突变较少,FAT1和错配修复(MMR)途径基因如MSH2、MSH6、PMS3突变较多(图一H)。以上研究结果强化了公认的烟草致癌物与小细胞肺癌肿瘤发生的关系,并为DNA修复缺陷在小细胞肺癌发展中的作用提供了新的线索。
接下来,研究者综合分析基因组畸变的影响。检查了体细胞拷贝数改变(SCNA)对mRNA、蛋白以及磷酸化蛋白丰度的顺式和反式效应影响(图二A)。mRNA、蛋白质和磷酸化蛋白分别观察到5363、2177和386个显著的顺式相关性(图二B)。在所有三个组分重叠的261种重要顺式效应中,223种蛋白质在肿瘤和NAT之间表现出不同的丰度,它们富集在mRNA处理、DNA修复和有丝分裂细胞周期调节等方面(图二C)。聚焦前10个蛋白质水平反式效应的癌症相关基因,NKX2-1长期以来一直被认为是癌症的标志物,而GNAS、AURKA、SRC和TOP1被广泛报道为SCLC中的原癌基因或药物靶点(图二D)。在691个显著的反式效应蛋白中,524个与RB1缺失呈正相关,并富集在颗粒细胞活化、对干扰素γ的反应、肌动蛋白组织和细胞粘附等途径;而其他167个负相关蛋白主要参与DNA构象变化、mRNA加工和RNA剪接途径(图二E和F),表明蛋白质水平的反式效应强烈反映拷贝数改变的致瘤作用。随后,研究者检查体细胞突变对其同源基因产物的影响,并鉴定了三个具有显著顺式效应的基因TP53、FAT1和GNAS。FAT1通常被认为是肿瘤抑制剂[9],在FAT1突变肿瘤中显示出增加的mRNA和蛋白质表达。然而,与NAT相比,FAT1野生型(WT)肿瘤中的FAT1蛋白表达显著下调,尽管mRNA丰度升高(图二G)。基于蛋白质组的基因集富集分析(GSEA)发现FAT1突变与上皮-间充质转化(EMT)和局灶性粘附途径的上调相关联(图二H)。参与EMT、间充质分化、整合素、细胞外基质(ECM)和局灶性粘附途径的蛋白质在FAT1突变肿瘤中上调表达(图二I)。此外,磷酸化蛋白组学数据显示,FAT1突变肿瘤中24个VIM磷酸位点增加(图二J),这些升高的磷酸化位点主要参与细胞骨架重组和细胞运动过程,表明FAT1功能丧失可能促进SCLC中的EMT表型。
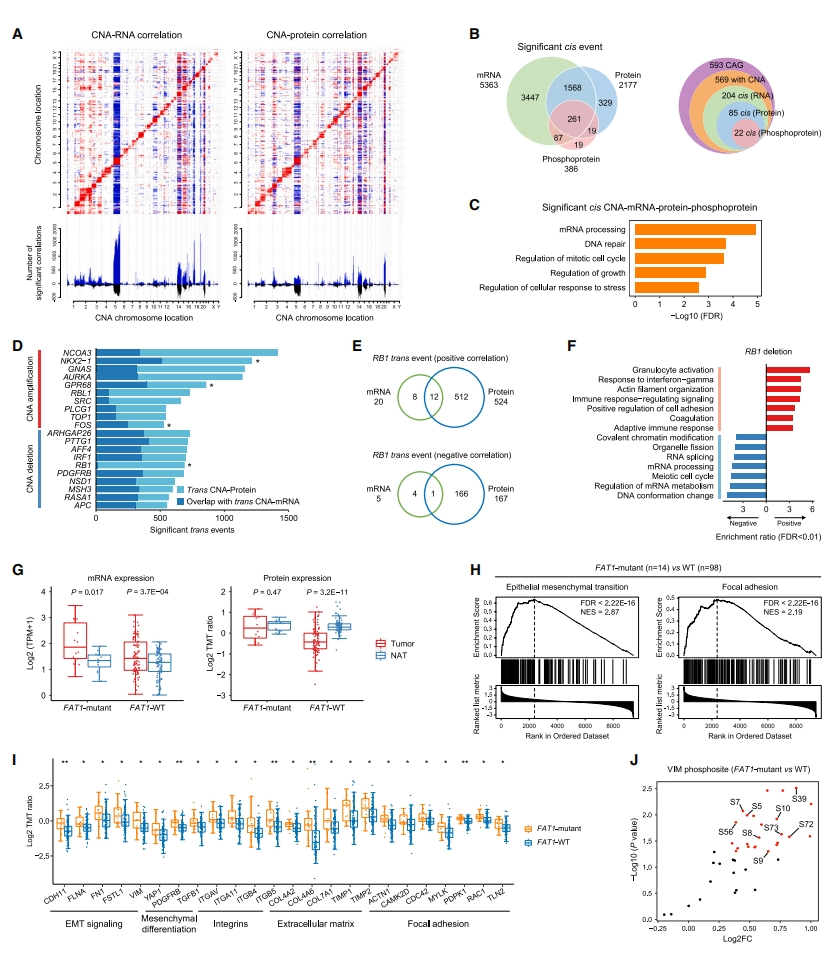
图二 遗传畸变对蛋白基因组学特征的影响[6]
接下来,研究者探究SCLC肿瘤与NAT之间的蛋白基因组学,重点关注肿瘤和NAT之间差异蛋白质和磷酸化位点及其丰度(图三A和F)。差异表达蛋白的KEGG通路分析显示,在肿瘤中,DNA复制、剪接体、细胞周期和DNA修复等途径上调,补体和凝血系统、ECM受体相互作用、局灶粘附、胆固醇代谢和花生四烯酸代谢途径下调(图三B)。在去除基质和免疫组分后,497个SCLC上调蛋白中的138个仍显著上调2倍以上。于是,重点研究在90%以上的肿瘤-NAT对中表达超过2倍的蛋白质,这25个蛋白质被定义为SCLC相关蛋白质,包括微管动力学相关蛋白STMN1/2、DNA损伤修复蛋白TMA7和PCNA以及转录调节因子HMGB3、PHF6、DDX5和SUPT16H,它们与患者生存率呈负相关(图三C)。在纯小细胞肺癌和联合小细胞肺癌(CSCLC)的肿瘤-NAT比较中,大多数蛋白质的变化相似(图三D)。然而,主要参与神经内分泌相关过程的22个蛋白质在纯SCLC肿瘤中特异性增加(图三E)。此外,与NAT相比,肿瘤中观测到1667个磷酸化位点的上调幅度超过2倍,其中1357个(81%)的磷酸化位点丰度变化大于相应的蛋白质丰度变化(图三G)。根据底物和相应的激酶激活位点的磷酸化水平来推断激酶活性,磷酸化位点特异性信号富集分析(PTM-SEA)鉴定出19种在SCLC中活性增加的激酶(图三H),其中5种激酶的激活位点表达增加,包括CHEK1、ATR、ATM、CDK2和GSK3A(图三I)。CHEK1对基因毒性应激反应的G2/M检查点至关重要。CHEK1蛋白及其S317磷酸化位点水平在肿瘤中增加,伴随着参与细胞周期停滞和DNA损伤反应的底物表达升高,如CDC25C S216、TP53BP1 S1678和TP53 S15(图三J)。
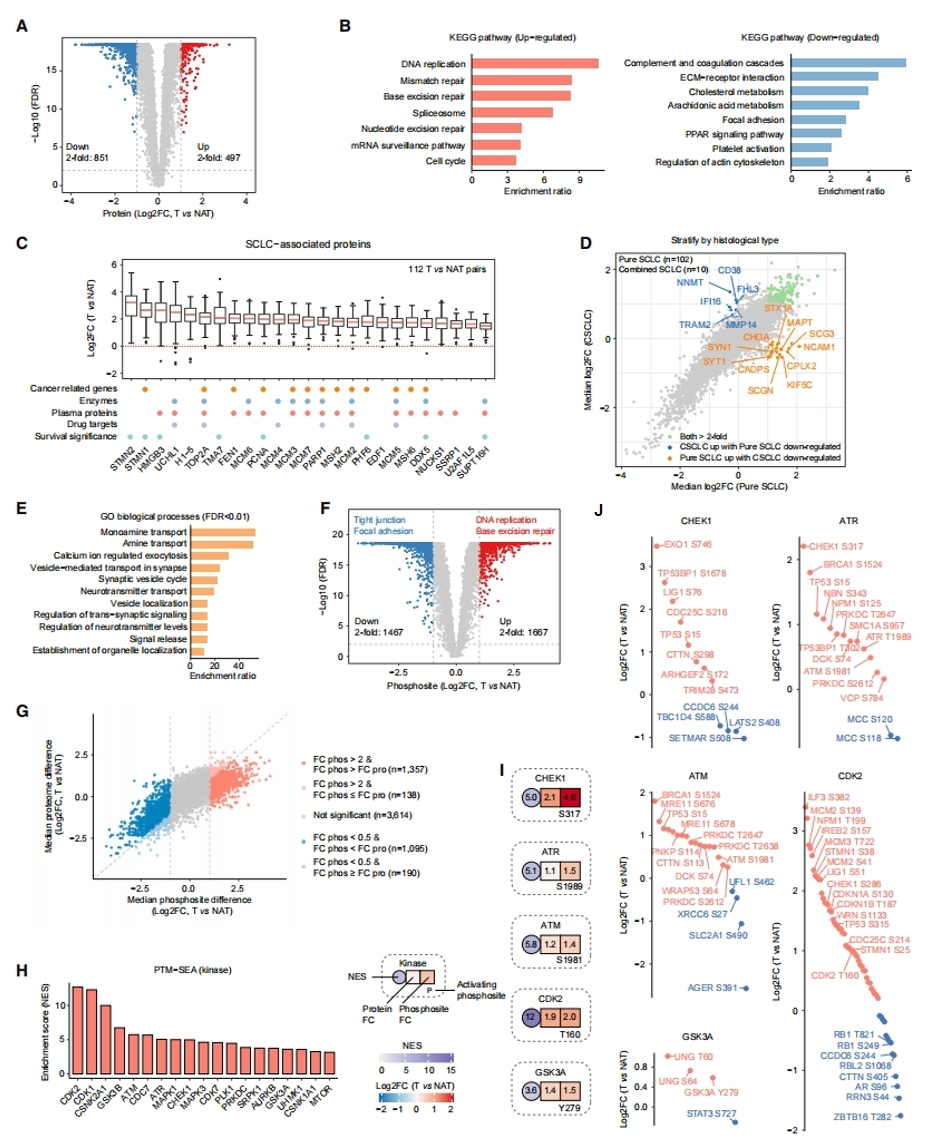
图三 与肿瘤发生和预后相关的蛋白基因组学改变[6]
进一步地,研究者进行与存活相关蛋白质的功能分析。首先进行监督分析,以确定预后生物标志物,并揭示了16个与患者生存相关的差异表达蛋白(图四A)。其中,HMGB3在肿瘤中表达升高,与较差的生存率相关;而CASP10表达降低,与较好的预后相关。TU-SCLC队列和另一个独立SCLC队列(n=111)样本的免疫组织化学(IHC)分析进一步验证了HMGB3结果(图四B-D),证实其在SCLC中的潜在预后价值。HMGB3属于高迁移率族超家族,与核小体结合并参与DNA复制、重组、修复和转录。在许多癌症中观察到HMGB3的高表达,并与耐药性和患者低生存率有关[10]。然而,尚未报道其在小细胞肺癌中的表达或功能。由于HMGB3在小细胞肺癌中上调,研究者推测其可能是致癌驱动因子。H345细胞体外实验结果显示,过表达HMGB3增加了细胞迁移,而敲低HMGB3导致细胞迁移减少(图四E和F)。据报道,HMGB3是一种调节基因转录的DNA结合蛋白,在H345细胞中过表达HMGB3并进行染色质免疫沉淀测序(ChIP-seq)分析,HMGB3靶基因主要富集在调控细胞迁移表型途径,如粘附连接、紧密连接和局灶粘附。于是,研究者重点研究先前报道促进癌症细胞迁移的5个基因,包括CLDN10、PKP2、ITGB4、VTN和LAMC2。与ChIP-seq结果一致,HMGB3过表达导致这些基因mRNA表达增加(图四G)。分别敲低这5个基因都显著降低了野生型和HMGB3过表达细胞的细胞迁移(图四H)。以上研究结果表明,HMGB3是一种强大的预后生物标志物,通过转录调控细胞连接相关基因,在SCLC中起致癌因子的作用(图四I)。
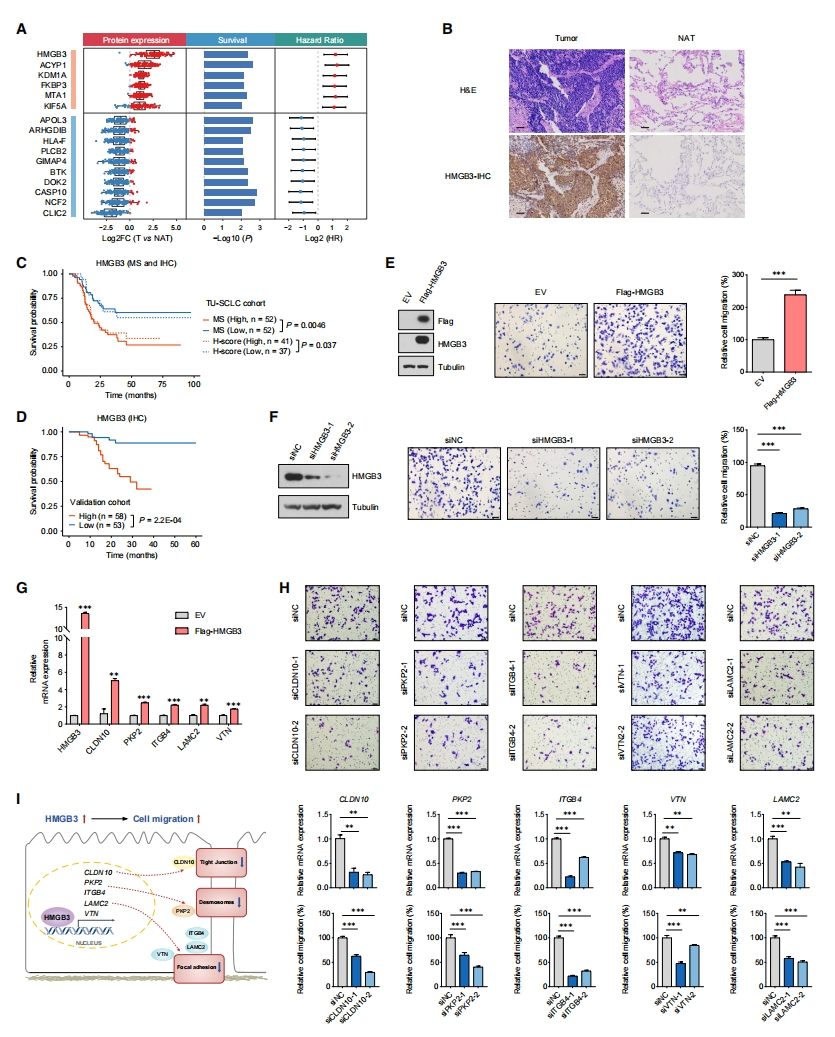
图四 蛋白质组学预后生物标志物的鉴定和验证[6]
随后,研究者剖析TU-SCLC队列的免疫微环境。基于肿瘤和NAT的xCell衍生细胞类型富集评分的无监督聚类确定了三个免疫聚类,包括热肿瘤、冷肿瘤和NAT富集(图五A)。大多数SCLC属于免疫冷肿瘤亚型,预后较差(图五B)。有趣的是,免疫冷肿瘤表现出更高的NE评分(图五C),并且免疫评分和NE评分之间存在显著的负相关,这进一步表明免疫性冷肿瘤与NE表型之间存在联系。此外,免疫热肿瘤亚型具有更强的细胞毒性免疫细胞和免疫抑制细胞,包括干扰素-γ反应、抗原处理和呈递,和自然杀伤细胞介导的细胞毒性的上调(图五A)。与免疫冷肿瘤相比,免疫热肿瘤中的T细胞标记物、MHC分子、刺激性和抑制性免疫调节剂蛋白特征、细胞溶解活性以及免疫检查点分子表达也上调(图五A)。因此,研究者推测免疫疗法可能有益于免疫热肿瘤亚型的SCLC人群。
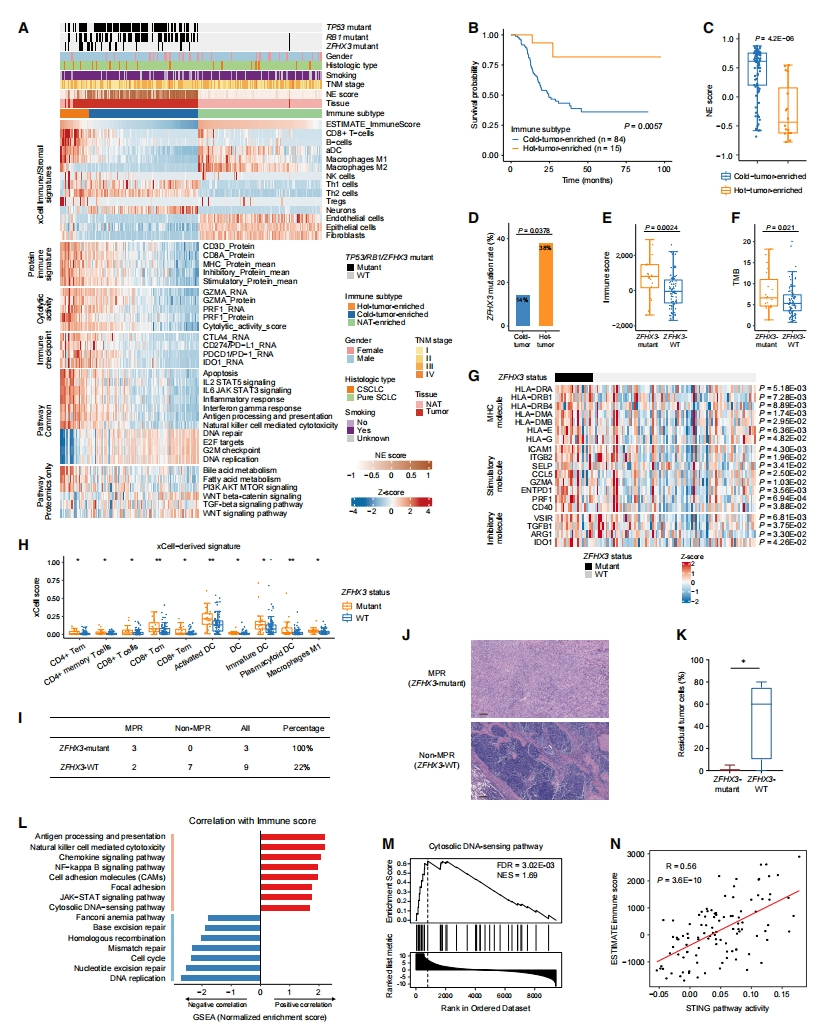
图五 TU-SCLC队列的免疫景观[6]
此外,研究者在免疫热肿瘤中观察到ZFHX3突变的显著富集(图五D)。与ZFHX3-WT肿瘤相比,携带ZFHX3突变的肿瘤表现出更高的免疫评分和TMB(图五E和F),表明ZFHX3突变与提高的免疫原性有关。MHC分子、刺激性分子和抑制性分子,以及xCell衍生的CD4+、CD8+ T细胞、DC和M1巨噬细胞特征在ZFHX3突变肿瘤中上调(图五G和H),而ZFHX3突变的NAT在这些免疫细胞中没有显示出统计学差异。因此,研究者将ZFHX3突变与免疫激活行为联系起来,并推测ZFHX3突变是免疫治疗的潜在预后生物标志物,并对此进行验证。从接受PD-1/PD-L1阻断联合化疗的SCLC患者中收集12份治疗前样本。主要病理反应(MPR)用于评估新辅助免疫治疗疗效的病理反应,即治疗后残余肿瘤不超过10%。其中5例为MPR,7例为非MPR。值得注意的是,所有3名ZFHX3突变患者(100%)都属于MPR,而只有2名WT患者(22%)属于MPR(图五I和J)。同样,在这12名临床试验患者中,ZFHX3突变的残余肿瘤细胞数量显著低于ZFHX3-WT组(图五K)。这些结果支持了假设,表明ZFHX3突变患者可能从免疫疗法中受益更多。
为进一步探索免疫性冷肿瘤的潜在决定因素,研究者使用免疫评分和蛋白质组学数据进行了相关性分析。正如预期,免疫相关途径显示出正相关,而DNA复制、细胞周期和DNA损伤修复途径与免疫评分呈负相关(图五L)。胞质DNA传感通路与免疫评分呈强正相关(图五L和M),表明cGAS-STING通路,一种由细胞质双链DNA激活的关键先天免疫通路,可能与免疫浸润有关。事实上,STING通路活性和下游促炎趋化因子CCL5和CXCL10的表达与免疫特征显著相关(图五N)。cGAS、STING1、CCL5和CXCL10蛋白表达与DNA损伤修复活性呈显著负相关,STING1蛋白表达与DNA修复蛋白和DNA损伤检查点的表达呈负相关。以上数据表明,DNA损伤修复活性的升高可能通过减弱SCLC中cGAS-STING通路的激活而有助于免疫抑制。
最后,研究者对TU-SCLC队列的多组学分类及其生物学特征进行表征。通过整合107例小细胞肺癌肿瘤的mRNA、蛋白质和磷酸化数据,应用基于非负矩阵因子分解(NMF)的无监督聚类,将其分为四个聚类(图六A)。nmf1亚型主要富集于细胞周期、DNA损伤、染色质结构和表观遗传调控途径,表明其是一个具有高增殖率的亚群,提示可能受益于基于顺铂联合依托泊苷的一线化疗方案。nmf2亚型的特征蛋白或磷酸化位点较少,但TMB最高(图六B)。nmf3亚型肿瘤与ECM受体相互作用、ECM结构和局灶粘附途径有关;在磷酸化蛋白质组层面表现出受体酪氨酸激酶(RTK)通路的显著激活,提示可能受益于靶向RTK的治疗方案。nmf4亚型通过MYC靶基因的高表达和RNA代谢途径的富集来区分,并以更高的染色体不稳定性(CIN)、干性评分、mRNA-蛋白质相关性为特征(图六A和B),提示可能受益于AURK抑制剂。
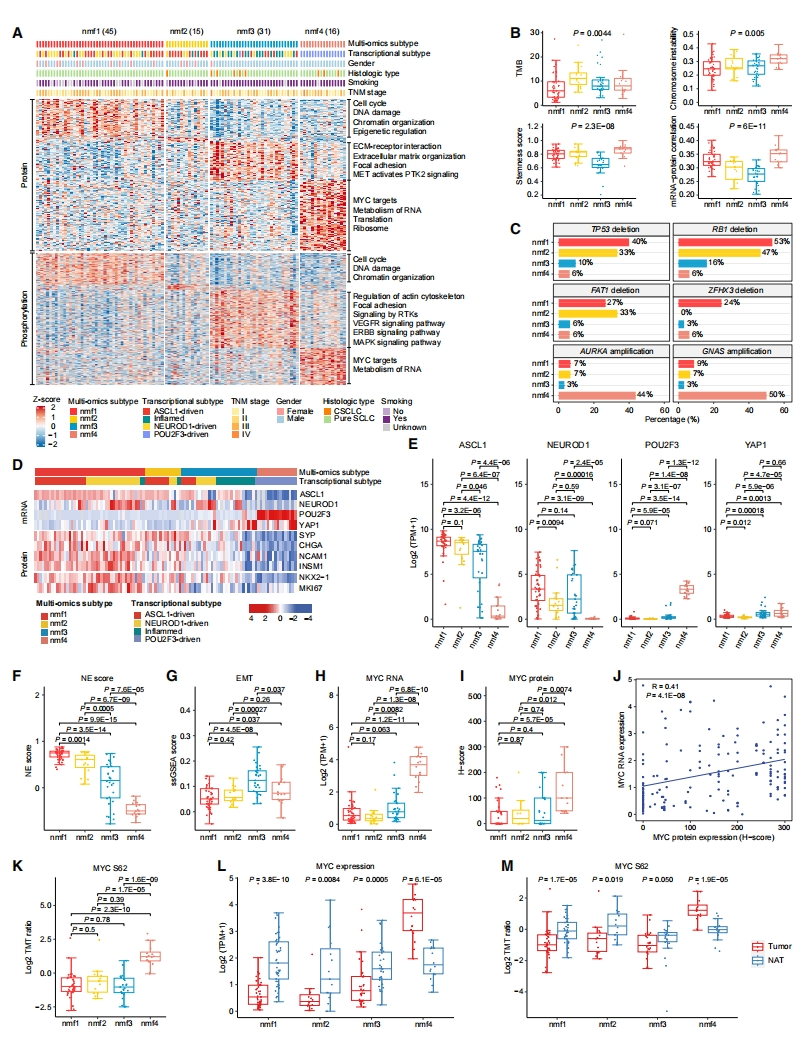
图六 TU-SCLC队列的多组学分类及其生物学特征[6]
TP53、RB1和FAT1的缺失在nmf1和nmf2亚型中显著富集,ZFHX3的缺失主要局限于nmf1亚型,相反,癌基因AURKA和GNAS扩增优先与nmf4亚型相关(图六C)。基于mRNA表达检查转录因子ASCL1、NEUROD1、POU2F3和YAP1在四种亚型中的表达模式,发现了明显的分离(图六D和E)。nmf1亚型显示出ASCL1、NEUROD1或两者的高表达,这与先前的研究一致,即许多SCLC肿瘤共表达ASCL1和NEUROD1[11]。POU2F3的高表达主要局限于nmf4亚型,并且与ASCL1和NEUROD1相互排斥。与其他三种转录因子相比,YAP1的表达非常低,尽管YAP1在nmf3和nmf4亚型中的表达相对较高。此外,在nmf1亚型中观察到最高的NE评分(图六F),伴随着NE标记物SYP、CHGA、NCAM1和INSM1的蛋白高表达(图六D)。nmf3亚型显示EMT评分最高(图六G),这与SCLC转移和化疗耐药性有关。MYC的扩增在这些亚型之间没有显示出统计学上的显著差异,而MYC mRNA表达在nmf4亚型中显示出显著上调(图六H)。SCLC肿瘤和NAT中MYC蛋白的IHC染色证实了这些差异(图六I和J)。磷酸化蛋白质组学数据显示,MYC S62磷酸化位点在nmf4亚型中也上调(图六K)。这些结果表明,MYC在nmf4亚型中具有积极的致癌作用。与NAT样品相比,MYC表达仅在nmf4亚型肿瘤中的RNA、蛋白质和S62磷酸化水平上调,而在其他亚型中下调(图六L和M)。研究结果表明,MYC表达而不是MYC基因扩增可以更好地指示MYC状态,并且可能是定义具有低NE特性和高POU2F3表达的SCLC亚群的更有价值标志物。总之,这些数据提供了SCLC肿瘤分子异质性的全面表征,并提示亚型特异性治疗策略的必要性。
综上所述,研究者利用基于串联质谱标签化学标记的定量蛋白质组学技术,系统分析了大规模临床小细胞肺癌样品的蛋白质组学和磷酸化翻译后修饰组学特征,同时整合基因组学技术,构建了小细胞肺癌的蛋白基因组图谱。通过整合多组学数据,解析了小细胞肺癌基因突变及拷贝数变异的下游效应;鉴定了一系列与小细胞肺癌发生发展密切相关的蛋白质、磷酸化位点及活性显著变化的激酶;发现了潜在的小细胞肺癌预后生物标志物;同时全面解析了小细胞肺癌的免疫微环境特征,建立了基于多组学的小细胞肺癌分子分型,并提出了亚型特异性的个性化治疗策略。该研究以深度覆盖的定量蛋白质组学分析为基础,系统解析了小细胞肺癌的分子分型和潜在发病机制,为小细胞肺癌的预后检测和个性化治疗提供了新的理论依据,同时产生的高质量大数据将为广大小细胞肺癌基础与临床研究者提供支持。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F: Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: a cancer journal for clinicians 2021, 71(3):209-249.
2. Rudin CM, Brambilla E, Faivre-Finn C, Sage J: Small-cell lung cancer. Nature reviews Disease primers 2021, 7(1):3.
3. Megyesfalvi Z, Gay CM, Popper H, Pirker R, Ostoros G, Heeke S, Lang C, Hoetzenecker K, Schwendenwein A, Boettiger K et al: Clinical insights into small cell lung cancer: Tumor heterogeneity, diagnosis, therapy, and future directions. CA: a cancer journal for clinicians 2023, 73(6):620-652.
4. Sivakumar S, Moore JA, Montesion M, Sharaf R, Lin DI, Colón CI, Fleishmann Z, Ebot EM, Newberg JY, Mills JM et al: Integrative Analysis of a Large Real-World Cohort of Small Cell Lung Cancer Identifies Distinct Genetic Subtypes and Insights into Histologic Transformation. Cancer Discov 2023, 13(7):1572-1591.
5. Rudin CM, Poirier JT, Byers LA, Dive C, Dowlati A, George J, Heymach JV, Johnson JE, Lehman JM, MacPherson D et al: Molecular subtypes of small cell lung cancer: a synthesis of human and mouse model data. Nat Rev Cancer 2019, 19(5):289-297.
6. Liu Q, Zhang J, Guo C, Wang M, Wang C, Yan Y, Sun L, Wang D, Zhang L, Yu H et al: Proteogenomic characterization of small cell lung cancer identifies biological insights and subtype-specific therapeutic strategies. Cell 2024, 187(1):184-203.e128.
7. George J, Lim JS, Jang SJ, Cun Y, Ozretić L, Kong G, Leenders F, Lu X, Fernández-Cuesta L, Bosco G et al: Comprehensive genomic profiles of small cell lung cancer. Nature 2015, 524(7563):47-53.
8. Umemura S, Mimaki S, Makinoshima H, Tada S, Ishii G, Ohmatsu H, Niho S, Yoh K, Matsumoto S, Takahashi A et al: Therapeutic priority of the PI3K/AKT/mTOR pathway in small cell lung cancers as revealed by a comprehensive genomic analysis. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer 2014, 9(9):1324-1331.
9. Pastushenko I, Mauri F, Song Y, de Cock F, Meeusen B, Swedlund B, Impens F, Van Haver D, Opitz M, Thery M et al: Fat1 deletion promotes hybrid EMT state, tumour stemness and metastasis. Nature 2021, 589(7842):448-455.
10. Wen B, Wei YT, Zhao K: The role of high mobility group protein B3 (HMGB3) in tumor proliferation and drug resistance. Molecular and cellular biochemistry 2021, 476(4):1729-1739.
11. Baine MK, Hsieh MS, Lai WV, Egger JV, Jungbluth AA, Daneshbod Y, Beras A, Spencer R, Lopardo J, Bodd F et al: SCLC Subtypes Defined by ASCL1, NEUROD1, POU2F3, and YAP1: A Comprehensive Immunohistochemical and Histopathologic Characterization. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer 2020, 15(12):1823-1835.



