技术分享:应激颗粒稳定受损溶酶体膜的“塞子”作用
内膜损伤是一种应激形式,对真核细胞有害[1]。为应对这种威胁,细胞具有修复损伤和恢复细胞稳态的机制。例如当细胞遇到压力时,蛋白翻译停止,细胞内未包被的mRNA浓度升高,与相关的RNA结合蛋白以及一些翻译起始因子快速聚集形成动力学的球状颗粒结构应激颗粒。应激颗粒是非翻译信使核糖核蛋白(mRNP)的凝聚体,其来源涉及RNA结合蛋白G3BP1/2(统称为G3BP)的相互作用网络和停滞在翻译起始阶段的mRNA。应激颗粒被认为是无膜细胞器,也能与脂质膜相互联系,在细胞组织中发挥作用[2]。然而,对于生物分子凝聚体和膜相互作用的机制和功能意义的理解仍然有限。
溶酶体损伤是许多疾病的共同特征。有研究表明,G3BP蛋白在稳态条件下可以与溶酶体膜结合,溶酶体损伤也会诱导应激颗粒的形成[3]。然而,目前尚不清楚这种反应是否主要由受损的膜本身引起,或者应激颗粒的形成是否在空间上处于损伤部位。有限的溶酶体损伤可以通过ESCRT依赖性和非依赖性途径进行修复[4, 5],但前期如何稳定受损膜直至招募来修复机器的机制尚不清楚,应激颗粒在溶酶体膜损伤中的生物学功能也仍然未知。
2023年11月,Nature上报道了一项研究,揭示了应激颗粒的一种新的生物学功能,即这种生物分子凝聚体在溶酶体膜损伤部位迅速形成,并作为一个“塞子”,稳定破损的膜并促进随后的内膜修复。这一功能对于人类巨噬细胞抵御结核分枝杆菌(Mtb)感染后的内膜损伤修复至关重要[6]。
首先,研究者利用超高分辨率活细胞成像技术研究人诱导多能干细胞来源的巨噬细胞(iPSDM)中应激颗粒-内膜损伤相互作用的动力学。半乳糖凝集素3(GAL-3)是一种与溶酶体聚糖结合的胞质凝集素,溶酶体聚糖仅在膜损伤后暴露[7]。研究者用L-亮氨基-L-亮氨酸甲酯(LLOMe)诱导溶酶体损伤后,观察到G3BP1阳性颗粒显著增加,位于GAL-3阳性溶酶体附近(图一a)。约90%的GAL-3溶酶体与G3BP1颗粒有关,并在添加LLOMe后迅速形成,在处理20分钟后达到最大值(图一b-d)。空间点模式分析证实,溶酶体损伤部位的应激颗粒形成率高于预期的随机概率(图一e)。3D图像分析显示,在超过70%的GAL-3溶酶体与G3BP1颗粒中,G3BP1颗粒类似“塞子”与受损的溶酶体密切接触形成凝聚体并持续增大(图一f和g)。时程分析证实,G3BP1颗粒及其积累先于GAL-3内膜损伤(图一h和i)。活细胞成像和3D分析显示,在LAMP1-eGFP标记溶酶体的iPSDM中,G3BP1颗粒靠近膜破裂位点,并进一步积累到LAMP1囊泡中(图一j和k)。以上数据表明,溶酶体膜损伤后应激颗粒迅速形成并堵塞损伤位点。
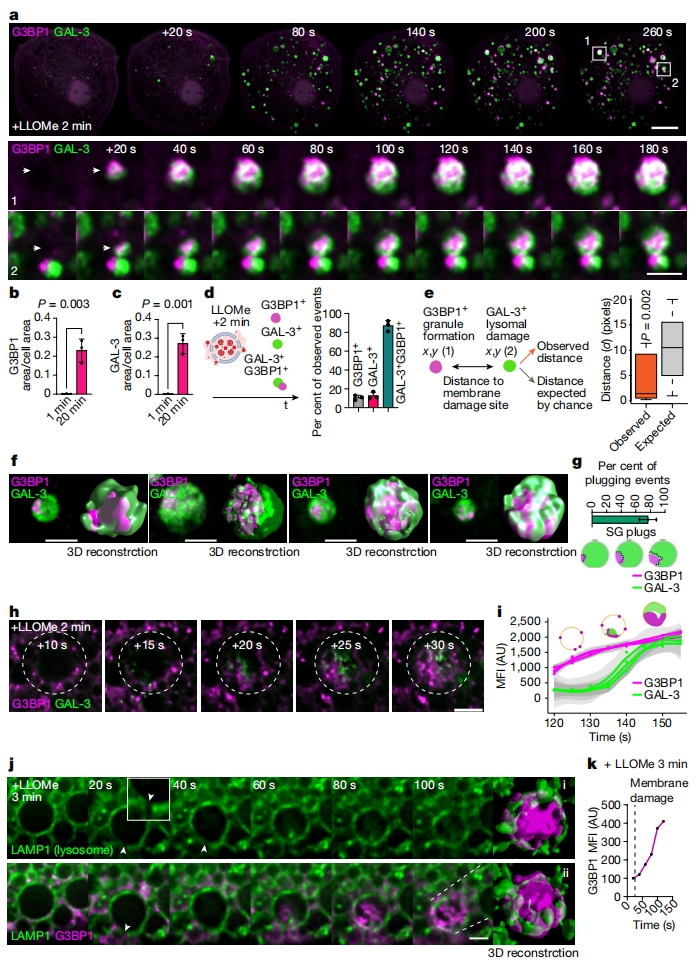
图一 应激颗粒形成并聚集在受损的溶酶体上[6]
接着,研究者探究凝聚体能否直接发生在损伤部位。使用巨大单层囊泡(GUV)和G3BP1-RNA凝聚体作为模型,在体外重建G3BP1-RNA颗粒,并用GUV封装G3BP1成均质溶液,使用微流体装置进行外部环境的快速和完全交换。将外部溶液的pH从7.5交换到5来模拟细胞内胞质和溶酶体之间pH差异。低渗冲击引起膜损伤,在GUV上产生纳米到微米大小的孔,使得外部和内部溶液可以局部混合(图二a-d)。通过将外部溶液变成低渗透压和低pH且含有Poly(A)-RNA的溶液,发现触发膜穿孔和G3BP1的相分离,观察到在膜损伤位点形成的G3BP1-RNA凝聚体使得孔边缘润湿和保持稳定,防止了膜坍塌和进一步的内容物泄漏(图二a–g)。相反,如果在凝聚体未形成时发生膜穿孔,囊泡就会坍塌(图二e-g)。凝聚体对膜的润湿(图二b和c)确保了局部液滴的扩散和孔的稳定,有效地稳固破损的膜。此外,与没发生相分离相比,在凝聚体形成时,低渗冲击下存活的GUV百分比更高(图二g)。使用粗粒度分子动力学模型分析了堵塞的物理机制,观察到由于内部和外部溶液的混合,在膜损伤部位自发形成凝聚体(图二h-j)。这些凝聚体的快速成核导致了穿过孔隙的通量显著下降,并阻止了内外两种溶液的进一步混合(图二i)。以上数据表明,在发生膜穿孔时,膜内外溶液的相互作用会触发局部生物分子凝聚体的形成,从而稳定受损的膜并促进囊泡的存活。
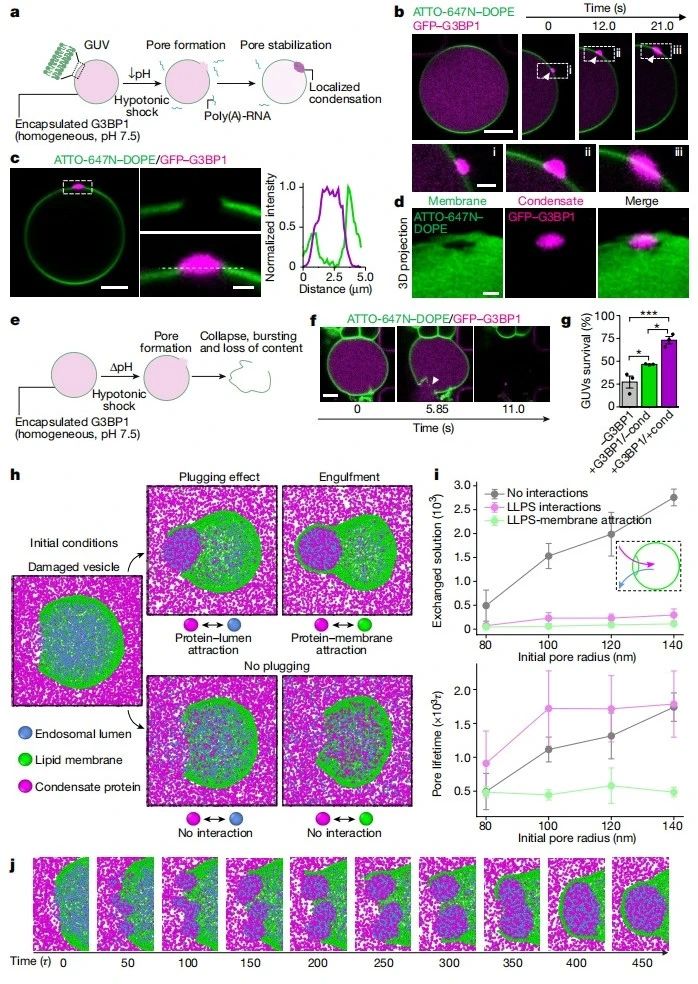
图二 膜损伤区域形成凝聚体可以稳定膜结构[6]
下一步,研究者探索应激颗粒介导的膜稳定是否参与内膜修复。使用CRISPR-Cas9敲除iPSDM中的G3BP1和G3BP2,得到接近群体敲除水平的G3BPnf iPSDM。与野生型iPSDM相比,G3BPnf iPSDM的溶酶体体积和蛋白水解活性没有差异。G3BP是调节应激颗粒形成的关键,观察到G3BPnf iPSDM在诱导溶酶体损伤后没有形成应激颗粒(图三a和b)。利用溶酶体染料LysoTracker可以监测溶酶体完整性动力学[8],发现未处理的G3BPnf iPSDM和对照组之间的LysoTracker荧光强度没有差异,表明在基础条件下,G3BP的缺失不会影响溶酶体。在LLOMe处理2分钟后,两者表现出类似的LysoTracker泄漏,表明LLOMe诱导的溶酶体损伤程度没有差异。然而,在去除LLOMe后,G3BPnf iPSDM的溶酶体极少被修复,表明缺乏应激颗粒稳定溶酶体膜,内膜修复效率很低(图三c-g)。研究者利用光电关联显微镜(CLEM)在超微结构水平上观察细胞应激颗粒,发现溶酶体损伤恢复后,在评估的时间点观察到大部分G3BP1阳性信号定位于LysoTracker阳性小泡(图三h)。此外,研究者也在U2OS细胞中验证了这一现象。以上数据表明,应激颗粒可以稳定受损的溶酶体膜,有助于内膜的有效修复。
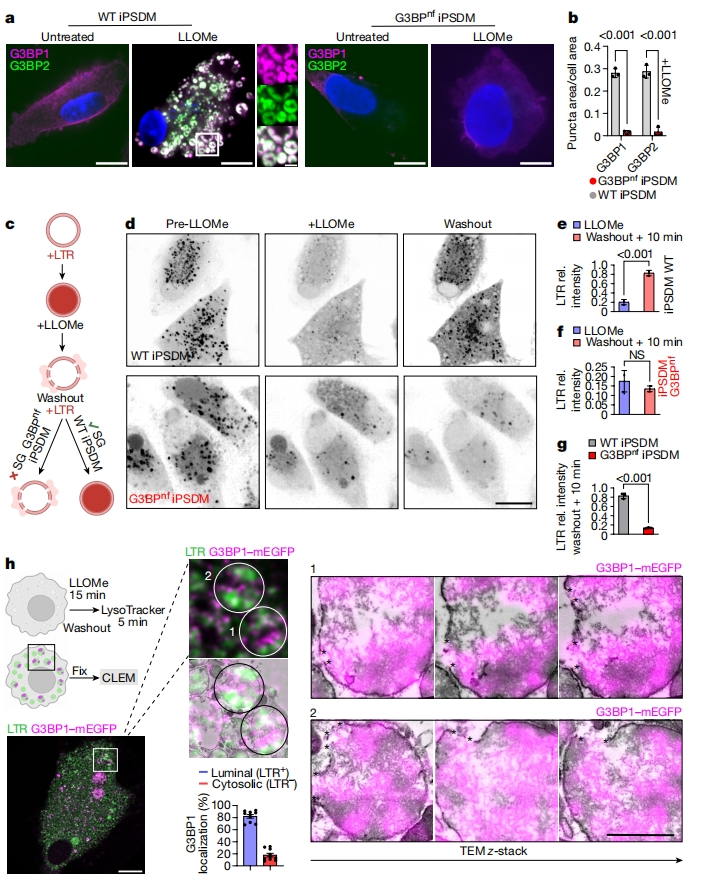
图三应激颗粒促进内膜修复[6]
据报道,结核分枝杆菌Mtb通过其ESX-1 VII型分泌系统和其他因子可诱导巨噬细胞的内吞溶酶体膜损伤[9]。在Mtb感染iPSDM的RNA测序研究中发现,相较于ESX-1缺陷的Mtb ΔRD1突变体,感染野生型Mtb后,多种应激颗粒标记物的转录水平显著增加(图四a)。与膜损伤依赖性表型一致,感染Mtb增加了磷酸化eIF2α(p-eIF2α)的水平(图四b和c);在人巨噬细胞中,感染Mtb诱导膜损伤并在其附近触发了应激颗粒的形成,而感染Mtb ΔRD1则不能(图四d-g)。此外,研究者发现ZNFX1与G3BP1高度共定位,并定位于与野生型Mtb非常接近的膜损伤位点(图四h)。在小鼠模型中,发现感染野生型Mtb小鼠肺中存在应激颗粒和GAL-3阳性结构,但感染Mtb ΔRD1的小鼠中没有(图四i-k)。为了确定Mtb感染后应激颗粒形成的功能结果,研究者分析Mtb在iPSDM中的复制情况。结果发现,在感染野生型Mtb 48小时后,Mtb的复制增加且在G3BPnf iPSDM中的复制高于对照组;在感染Mtb ΔRD1 72小时后,突变型Mtb的复制增加且在G3BPnf iPSDM中的复制高于对照组(图四l和m)。以上数据表明,应激颗粒的形成可抵抗Mtb的感染,而当应激颗粒形成受阻的情况下,损伤的溶酶体膜稳定和修复功能受损,严重影响巨噬细胞抵抗Mtb的感染。
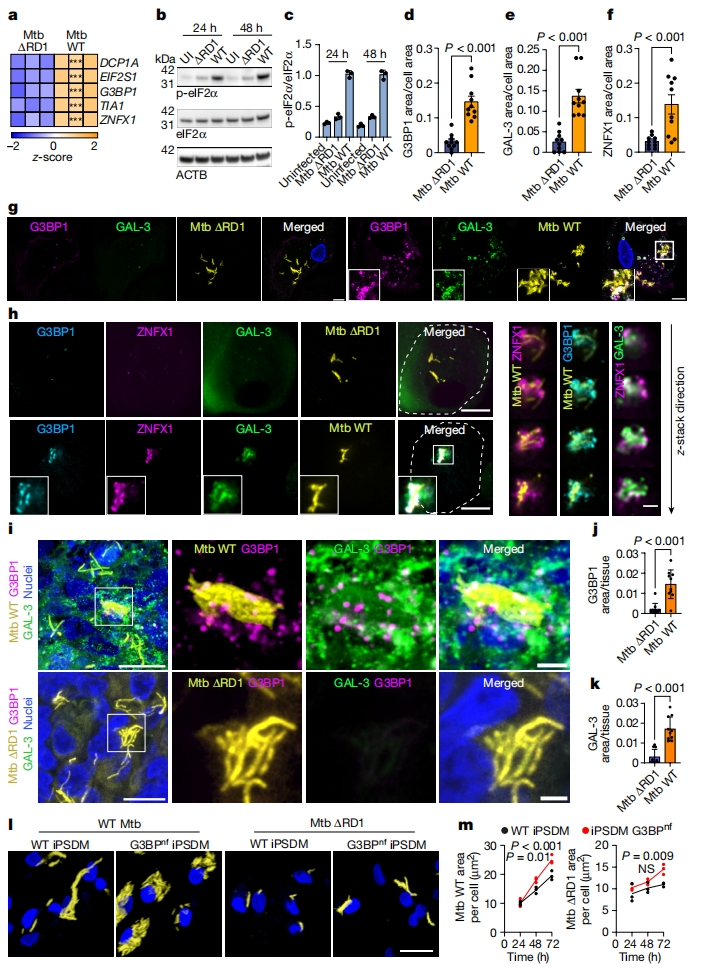
图四 人巨噬细胞抵抗Mtb感染需要应激颗粒[6]
综上所述,该研究通过结合体内外实验以及计算建模,发现了生物分子凝聚体应激颗粒的新功能,即应激颗粒选择性地在受损膜附近迅速凝聚并形成一个“塞子”,促进内膜的稳定和囊泡存活,使得内膜得以快速修复。应激颗粒凝聚体和膜之间的润湿相互作用稳定了孔隙和液滴,增强了“塞子”效应。这一功能对于巨噬细胞抵御细胞内病原体对内膜系统的损伤至关重要。该研究揭示了受损膜稳定的生物物理机制,并揭示了应激颗粒在溶酶体损伤中的生物学功能,可能有助于确定治疗神经退行性疾病的分子靶点,并为遗传性应激颗粒蛋白ZNFX1缺乏的患者易感分枝杆菌提供了机制解释。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Papadopoulos C, Kravic B, Meyer H: Repair or Lysophagy: Dealing with Damaged Lysosomes. Journal of molecular biology 2020, 432(1):231-239.
2. Zhao YG, Zhang H: Phase Separation in Membrane Biology: The Interplay between Membrane-Bound Organelles and Membraneless Condensates. Developmental cell 2020, 55(1):30-44.
3. Prentzell MT, Rehbein U, Cadena Sandoval M, De Meulemeester AS, Baumeister R, Brohée L, Berdel B, Bockwoldt M, Carroll B, Chowdhury SR et al: G3BPs tether the TSC complex to lysosomes and suppress mTORC1 signaling. Cell 2021, 184(3):655-674.e627.
4. Yim WW, Yamamoto H, Mizushima N: Annexins A1 and A2 are recruited to larger lysosomal injuries independently of ESCRTs to promote repair. FEBS letters 2022, 596(8):991-1003.
5. Skowyra ML, Schlesinger PH, Naismith TV, Hanson PI: Triggered recruitment of ESCRT machinery promotes endolysosomal repair. Science 2018, 360(6384).
6. Bussi C, Mangiarotti A, Vanhille-Campos C, Aylan B, Pellegrino E, Athanasiadi N, Fearns A, Rodgers A, Franzmann TM, Šarić A et al: Stress granules plug and stabilize damaged endolysosomal membranes. Nature 2023, 623(7989):1062-1069.
7. Maejima I, Takahashi A, Omori H, Kimura T, Takabatake Y, Saitoh T, Yamamoto A, Hamasaki M, Noda T, Isaka Y et al: Autophagy sequesters damaged lysosomes to control lysosomal biogenesis and kidney injury. The EMBO journal 2013, 32(17):2336-2347.
8. Radulovic M, Schink KO, Wenzel EM, Nähse V, Bongiovanni A, Lafont F, Stenmark H: ESCRT-mediated lysosome repair precedes lysophagy and promotes cell survival. Embo j 2018, 37(21).
9. Bernard EM, Fearns A, Bussi C, Santucci P, Peddie CJ, Lai RJ, Collinson LM, Gutierrez MG: M. tuberculosis infection of human iPSC-derived macrophages reveals complex membrane dynamics during xenophagy evasion. Journal of cell science 2020, 134(5).



