技术分享:女性妊娠期恶心和呕吐与GDF15有关
多达七成的女性怀孕时会出现恶心和呕吐。当妊娠期恶心和呕吐(NVP)非常严重导致无法正常进食或饮水时,会被诊断为妊娠剧吐(hyperemesis gravidarum,HG),通常还伴随着体重减轻和电解质紊乱,这可能对母亲和胎儿的长期健康造成重大影响[1]。HG是孕妇妊娠早期住院的主要原因,也是妊娠住院的第二大常见原因[2]。目前,对NVP或HG的分子机制研究还没有显著进展。最近一些证据表明,一种作用于脑干的激素GDF15与NVP有关。在非妊娠状态下,GDF15在细胞应激时被广泛表达。其受体是GFRAL和RET异源二聚体,仅在后脑表达,受体激活后会导致恶心和呕吐反应[3]。2000年,首次报道孕妇血液中存在高水平的GDF15[4]。最近,GDF15被发现是由人类滋养层类器官分泌最丰富的多肽之一,并且胎盘中的GDF15 mRNA比其他组织都更丰富[5]。发生NVP或HG孕妇的循环GDF15浓度也会更高些。一种罕见的杂合突变体GDF15(C211G)在HG女性中高度富集[6]。然而,迄今为止,GDF15与NVP、HG的遗传关联机制尚不明确。
2023年12月,Nature期刊在线报道一项研究,发现胎儿产生GDF15的水平以及母体对GDF15的高敏感性,都会大大增加妊娠剧吐(HG)的风险。研究证实,妊娠母体血液中较高的GDF15水平与发生妊娠期恶心和呕吐(NVP)和HG有关,且绝大多数GDF15来源于胎儿胎盘。母体对GDF15的敏感性是由妊娠前暴露于GDF15决定的,非妊娠状态下低水平的循环GDF15会增加发生HG的风险。相反,因其他因素造成非妊娠状态下本底循环GDF15高的女性发生NVP或HG的风险较低。在怀孕前增强女性对GDF15激素的耐受性可能是预防孕吐的关键[7]。
首先,研究者测量孕妇循环血液中的GDF15水平。因一种GDF15的常见突变体H202D被证实会干扰野生型GDF15浓度的测量[8],于是研究者使用一种不易被H202D突变体干扰的免疫测定法来进行测量。采集妊娠15周左右的孕妇血液样本,结果显示,出现NVP的女性GDF15水平显著高于无NVP反应的女性(图一a)。在另一项研究中发现,HG女性的GDF15水平显著高于轻微NVP的女性(图一b和c)。以上数据表明,妊娠期母体GDF15水平与发生NVP和HG之间存在正相关性。
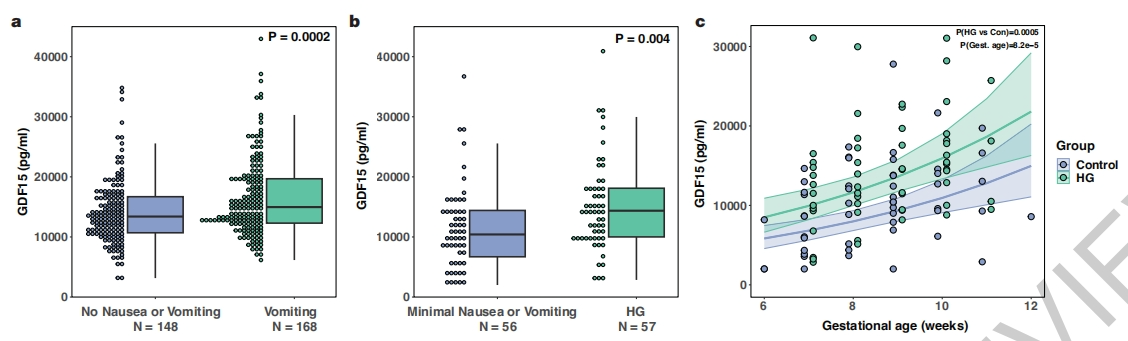
图一 妊娠期恶心、呕吐和妊娠剧吐的母体循环GDF15水平较高[7]
接下来,研究者探究妊娠期循环GDF15的来源。开发了基于质谱的测定方法,来区分在202位(成熟循环蛋白第6位)携带组氨酸(H)或天冬氨酸(D)的GDF15(图二a)。在内肽酶GluC的切割作用下,根据第202位氨基酸的不同,可将GDF15切割成H肽或D肽(图二a)。使用来自妊娠结局预测(POP)研究队列的胎盘RNA-seq数据和母体DNA[5],对胎儿和母亲进行基因分型,发现7种胎儿和母亲H202D基因型不一致的组合,即胎儿和母亲其中一人携带H202D杂合基因型。结果显示,在母亲为HD杂合基因型的血浆中,来源于母体的D肽平均贡献少于1%的循环GDF15(图二b-d),提示循环GDF15主要来自胎儿。研究者选择胎儿为HD杂合基因型,母亲为HH纯合基因型的组合进行检测,令人惊讶的是,该队列由胎儿产生的D肽就构成了总循环GDF15的一半以上(图二e)。以上数据表明,循环中的GDF15绝大多数都来源于胎儿,并且D肽可能被优先表达和分泌,以及可能在循环中具有更长的半衰期。
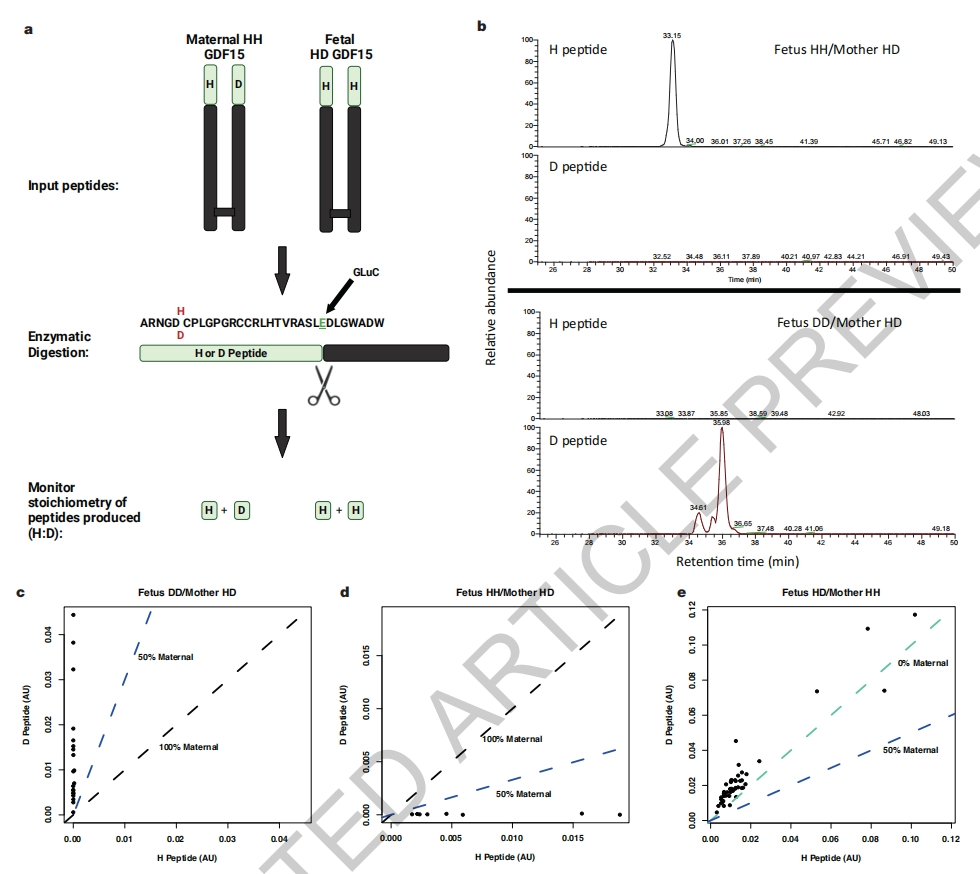
图二 妊娠女性的循环GDF15主要来源于胎儿[7]
据报道,携带GDF15的C211G杂合突变女性发生HG的风险至少增加了10倍[6]。第211位的半胱氨酸是参与GDF15链内二硫键形成的关键保守半胱氨酸残基之一,C211的缺失被预测具有高度破坏性。研究者将GDF15 C211G表达质粒瞬转到HEK 293T细胞,发现虽然GDF15 C211G高度表达,但与野生型不同,并没有成熟肽被分泌出来,表现为未被加工的前肽完全保留在细胞内(图三a)。GDF15是以同源二聚体的形式被分泌的,研究者随后测试C211G突变体是否会干扰野生型GDF15的分泌。采用不同标签蛋白标记GDF15的突变体和野生型,发现当野生型与C211G共表达时,野生型的分泌明显减少(图三b)。为确定C211G突变体对循环GDF15的影响,研究者在另一队列进行探究,发现未怀孕的C211G杂合基因型女性(11/2872)的循环GDF15水平相比对照组显著降低了50%以上(图三c)。为阐明C211G杂合基因型母体和胎儿GDF15之间的相互作用,研究者进一步鉴定了6名C211G杂合基因型女性的17名后代[6],发现胎儿为C211纯合野生型时,10/10孕妇都发生HG;相反,胎儿为C211G杂合基因型时,只有4/7孕妇发生HG。以上数据表明,GDF15 C211G突变体会影响GDF15的分泌,孕妇携带这种罕见C211G突变型会带来HG风险,然而当胎儿也携带C211G突变型时,HG风险可能会被降低。
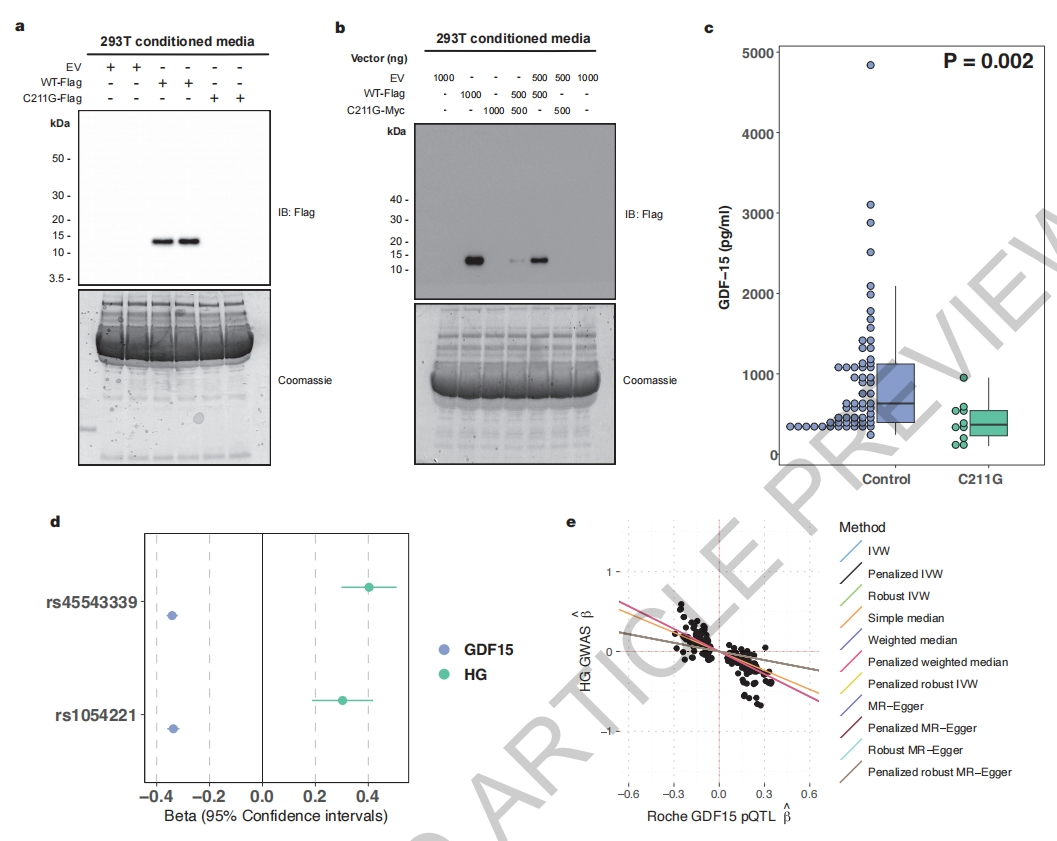
图三 罕见和常见HG风险基因突变都降低了非妊娠状态下的循环GDF15水平[7]
据报道,全基因组范围内,GDF15基因及其临近的常见遗传变异与HG具有最强的相关性。于是,研究者着重研究两种GDF15基因座上的单核苷酸(SNV)突变体,并在18,184人的研究队列中检测它们与GDF15水平的相关性。与罕见C211G突变体一致,在非妊娠状态下,这两种SNV突变体等位基因均与较低的GDF15相关(图三d)。随后研究者系统地检测非妊娠状态下循环GDF15与HG风险之间的因果关系,发现在非妊娠状态下循环GDF15水平的增加降低了HG风险(图三e)。以上数据表明,常见的HG风险基因突变会降低非妊娠状态下的循环GDF15水平,而非妊娠状态下低水平的GDF15会增加发生HG的风险。
最后,研究者猜想增加非妊娠状态下的循环GDF15水平能否降低HG风险,并设计小鼠实验进行验证。给野生型小鼠注射长效的人FC_GDF15或PBS,三天后,再给小鼠急性注射人重组GDF15,测量食物摄入量和体重的变化(图四a)。结果显示,预先接受PBS注射的小鼠,在注射人重组GDF15后出现显著的食物摄入量减少和体重减轻(图四b和c),但预先接受长效人FC_GDF15处理的小鼠在GDF15急性暴露后没有表现出类似的表型(图四b和c)。为了明确本底GDF15水平能否影响GDF15急性暴露后的厌食作用,研究者对野生型和先天性缺乏GDF15的Gdf15-/-小鼠,分别给与一定剂量的人重组GDF15处理。发现Gdf15-/-小鼠的24小时食物摄入量受到显著抑制,野生型小鼠则没有(图四d和e)。以上数据表明,GDF15急性暴露产生的厌食作用可以通过预先的GDF15处理得到缓解。
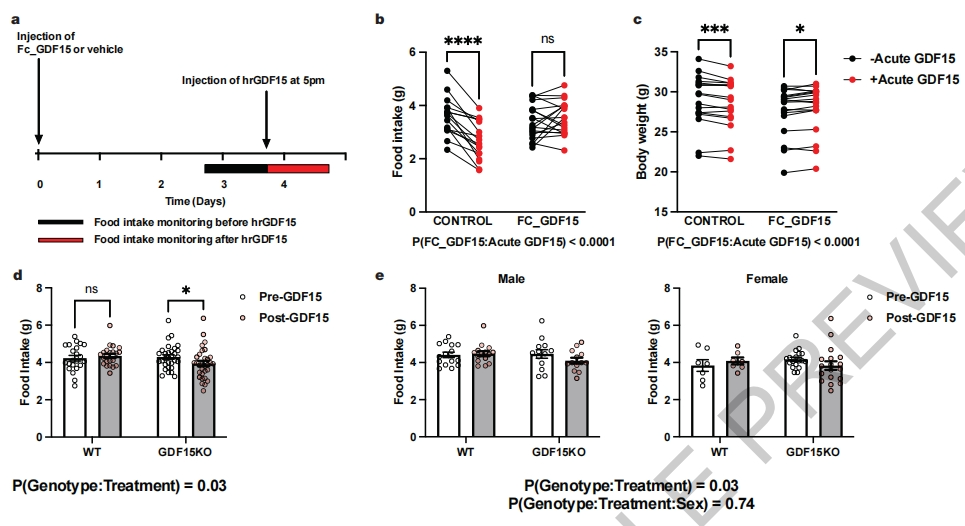
图四 长效GDF15的预处理可降低GDF15急性暴露小鼠的厌食反应[7]
综上所述,该研究表明发生妊娠期恶心和呕吐(NVP)甚至是妊娠剧吐(HG)的孕妇循环GDF15水平显著升高,且GDF15绝大多数来源于胎儿。当女性携带GDF15罕见或常见的突变基因型时,会影响GDF15的分泌,降低非妊娠状态下的循环GDF15水平,进而在怀孕后显著增加HG风险。因其他因素造成非妊娠状态下本底循环GDF15高的女性则发生NVP或HG的风险较低。该研究证实了胎儿来源的GDF15造成女性妊娠期恶心和呕吐的因果作用,怀孕前增强女性对GDF15激素的耐受性可能是预防孕吐的关键,为有效预防和改善孕吐提供了一种新的思路。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Fejzo MS, Trovik J, Grooten IJ, Sridharan K, Roseboom TJ, Vikanes Å, Painter RC, Mullin PM: Nausea and vomiting of pregnancy and hyperemesis gravidarum. Nature reviews Disease primers 2019, 5(1):62.
2. Gazmararian JA, Petersen R, Jamieson DJ, Schild L, Adams MM, Deshpande AD, Franks AL: Hospitalizations during pregnancy among managed care enrollees. Obstetrics and gynecology 2002, 100(1):94-100.
3. Benichou O, Coskun T, Gonciarz MD, Garhyan P, Adams AC, Du Y, Dunbar JD, Martin JA, Mather KJ, Pickard RT et al: Discovery, development, and clinical proof of mechanism of LY3463251, a long-acting GDF15 receptor agonist. Cell metabolism 2023, 35(2):274-286.e210.
4. Moore AG, Brown DA, Fairlie WD, Bauskin AR, Brown PK, Munier ML, Russell PK, Salamonsen LA, Wallace EM, Breit SN: The transforming growth factor-ss superfamily cytokine macrophage inhibitory cytokine-1 is present in high concentrations in the serum of pregnant women. The Journal of clinical endocrinology and metabolism 2000, 85(12):4781-4788.
5. Gong S, Gaccioli F: The RNA landscape of the human placenta in health and disease. 2021, 12(1):2639.
6. Fejzo MS, MacGibbon KW, First O, Quan C, Mullin PM: Whole-exome sequencing uncovers new variants in GDF15 associated with hyperemesis gravidarum. BJOG : an international journal of obstetrics and gynaecology 2022, 129(11):1845-1852.
7. Fejzo M, Rocha N, Cimino I: GDF15 linked to maternal risk of nausea and vomiting during pregnancy. Nature 2023.
8. Karusheva Y, Ratcliff M, Mörseburg A, Barker P, Melvin A, Sattar N, Burling K, Backmark A, Roth R, Jermutus L et al: The Common H202D Variant in GDF-15 Does Not Affect Its Bioactivity but Can Significantly Interfere with Measurement of Its Circulating Levels. The journal of applied laboratory medicine 2022, 7(6):1388-1400.



