技术分享:揭示肝细胞癌癌旁组织临床相关的分子特征
原发性肝癌是全球癌症相关死亡的第三大原因[1]。肝细胞癌(HCC)占肝癌病例的75%-85%,具有高度异质性。随着二代测序和先进蛋白质组学技术的发展,人们对HCC进行分子表征,以探索精准诊断及治疗的潜在策略和药物靶点[2]。
正常邻近组织(NAT),也称为癌旁组织,在肿瘤相关研究中通常被认为是对照组。癌旁组织是健康组织和肿瘤之间的一种独特的中间状态,可能积累致癌事件[3]。HCC患者通常伴有慢性肝炎或肝硬化,肝硬化患者相比健康的肝脏具有更高的突变性[4]。如瘦素受体(LEPR)突变会在丙型肝炎病毒(HCV)感染的肝硬化中积累,进而破坏LEPR信号传导,产生更高的肝癌易感性[5]。经福尔马林固定的石蜡包埋组织中也发现了HCC癌旁组织与预后相关的基因表达特征,具有分子异质性[6]。这些研究都揭示了癌旁组织的重要生物学信息,却较少进行深入研究,尤其是在蛋白质组学水平的全面分析研究。蛋白质是生命活动的主要执行者,是95%以上药物的作用靶点。对癌旁组织的分析可能有助于制定预防复发的干预措施,但目前尚缺乏在蛋白质组学层面对HCC癌旁组织的系统研究。
2023年6月,National Science Review期刊上发表了采用蛋白质组学技术系统揭示肝细胞癌(HCC)癌旁组织临床特征相关的分子特征,根据蛋白质异质性将HCC癌旁组织分为两种亚型,其中亚型2与预后不良和高风险复发有关。通过深入探讨了这两种亚型的癌旁组织与健康肝脏组织之间的蛋白质组学差异,揭示了从健康肝脏向癌旁组织进展相关的早期分子变化,扩展了人们对肿瘤癌旁组织的认识[7]。
首先,研究者探究癌旁组织的蛋白质组学层面能否反映HCC肿瘤亚型的内在特征。采用先前发表的HCC蛋白质基因组数据集进行分析[8]。使用串联质谱标签(TMT)[9]标记技术对三个HCC亚组的所有159个配对的癌旁组织进行定量分析,共获得6498个蛋白质的深度蛋白质组学数据。其中包含代谢驱动型亚组55个(S-Mb)、微环境失调型亚组57个(S-Me)和增殖驱动型亚组47个(S-Pf,图一a)。通过单向方差分析发现381种蛋白质在配对癌旁组织中差异表达(图一a)。多重比较发现,S-Me和S-Pf亚组的癌旁组织表现出最大的差异,有340个差异表达蛋白质(DEP);S-Pf和S-Mb亚组的癌旁组织显示出中等差异,有238个DEP;而S-Mb和S-Me亚组的癌旁组织最少,有59个DEP。与其他两个亚组相比,S-Pf亚组的癌旁组织表现出不同的蛋白质表达模式(图一b)。在381个DEP中,与三个肿瘤亚组的5999个肿瘤DEP交集的有360个(图一c)。接下来,研究者探究这360个蛋白在三个亚组的癌旁组织中是否显示出与三个肿瘤亚组相似的变化趋势。发现S-Pf亚组的癌旁组织和肿瘤聚集在一起,具有相似的分子特征(图一d和e)。S-Pf亚组在氧化磷酸化、代谢通路、蛋白酶体、过氧化物酶体、碳代谢和脂肪酸代谢相关通路的蛋白质表达较低,而参与细胞周期的蛋白质(STAG1、CREBBP)、DNA复制和碱基切除修复(FEN1)和肝细胞癌(ARID2、ARID1A和GSTP1)的蛋白质表现出更高的表达(图一e)。以上数据表明,S-Pf亚组的分子特征部分反映在对应的癌旁组织中,提示癌旁组织可以预测特定肿瘤亚型的生物学特性。
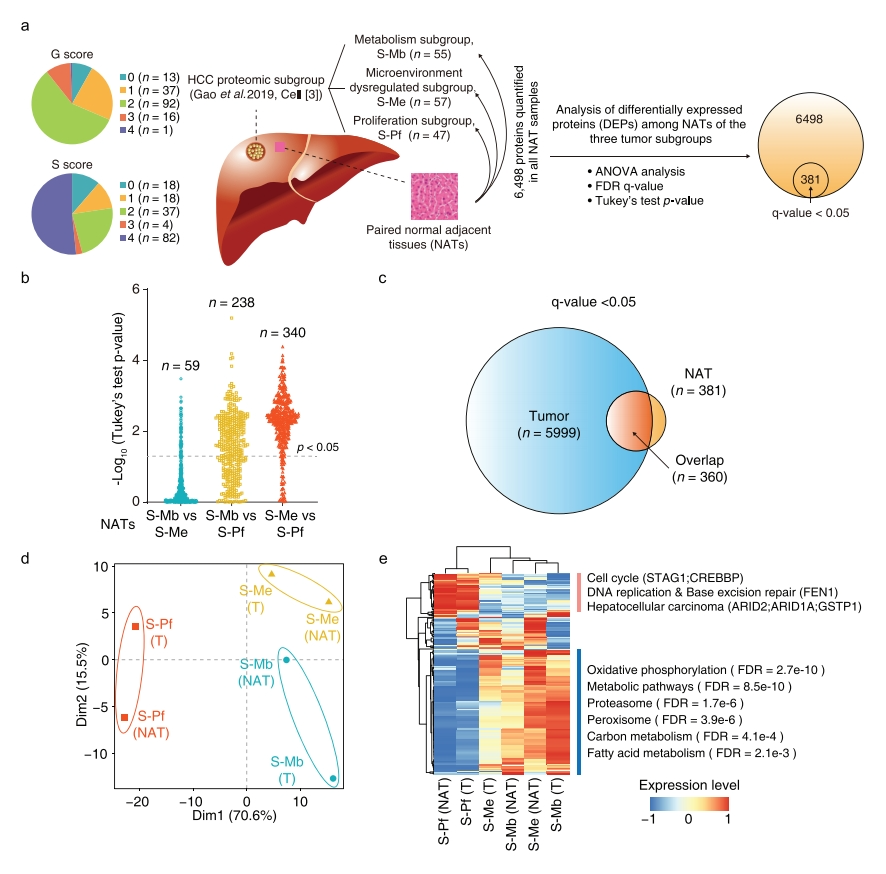
图一 HCC癌旁组织与配对肿瘤具有相似的分子特征[7]
考虑到肿瘤亚组的生存率存在显著差异[8],研究者尝试从蛋白质组层面揭示癌旁组织的潜在预后相关性。为揭示癌旁组织的异质性,筛选出759个差异表达蛋白质,并采用无监督聚类方法将癌旁组织分为两种不同的亚型。有趣的是,这两种癌旁组织亚型的总生存率存在显著差异,亚型2的预后较差,无复发生存率也显示出差别趋势(图二a)。基于所有定量蛋白质的PCA显示这两种癌旁组织亚型之间存在明显的分离(图二b)。通过与配对肿瘤进行比较,亚型2的癌旁组织样本有12个定位到S-Pf亚组,显示出更高的代表性(图二c)。通过临床信息的相关性分析发现亚型2的癌旁组织患者年龄较大,氨基亮氨酸转移酶(ALT)和γ-谷氨酰转移酶(γ-GT)水平较高(图二d),表明亚型2的肝功能损伤更严重。与亚型1相比,亚型2鉴定出144种上调和86种下调的蛋白质(图二e)。KEGG通路富集分析表明,上调的 DEP富集在蛋白消化和吸收、ECM-受体相互作用、抗原加工呈递和PI3K-Akt信号通路中;下调的86个DEP在正常肝功能相关的各种代谢途径中富集,包括氨基酸的生物合成、脂肪酸降解、糖酵解/糖异生、药物代谢和类固醇激素生物合成(图二f)。接着,研究者在另一个包含97个HCC癌旁组织样本的蛋白质组数据队列中测试这230个DEP能否作为癌旁组织亚型的蛋白质特征[2]。与上述结果一致,该验证队列的癌旁组织也可分为预后和复发相关的两种亚型,在早期复发有显著差异(图二g)。两个癌旁组织数据集中有7个高表达蛋白SORD、GGACT、GLUD1、ALDH8A1、ADH6、UGT1A9和PKLR,和5个低表达蛋白LXN、PDLIM7、THY1、CNN1和SYNPO2与生存率的提高相关,此外,ACMSD高表达和COLEC11低表达与低复发率相关(图二h)。其中GGACT、LXN、THY1、SYNPO2、ACMSD和COLEC11从肿瘤数据中没有显示出生存或复发相关性,表明它们是癌旁组织中特有的生物标志物。以上数据表明,在蛋白质组层面上,可以将HCC癌旁组织分成与预后和复发相关的两种亚型,其中亚型2癌旁组织患者具有更严重的肝损伤和肝炎。
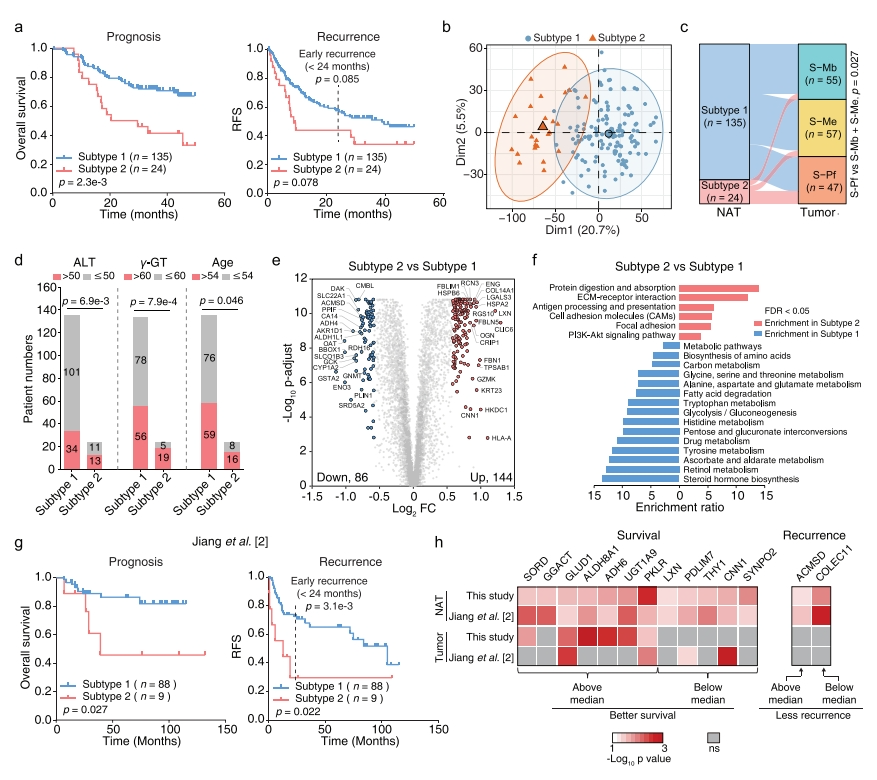
图二 HCC癌旁组织具有异质性,可分为与预后和复发相关的两种亚型[7]
接下来,研究者分析了这两种癌旁组织 亚型的免疫浸润特征差异。发现两种癌旁组织亚型的xCell免疫分析、基质和微环境评分均高于配对肿瘤,表明癌旁组织的免疫和基质细胞类型比例高于肿瘤,其中2型癌旁组织高于1型癌旁组织,具有更高水平的免疫浸润(图三a-c)。另一种分析肿瘤微环境的工具也得出了与xCell类似的结论(图三d-f)。随后,研究者分析xCell细胞类型和免疫信号相关蛋白的差异,发现亚型2 癌旁组织具有显著更高比例的CD4+ 记忆T细胞、正常树突状细胞(cDC)、活化树突细胞(aDC)、树突状细胞(DC)、CD4+ 初始T细胞、CD8+ T细胞、成纤维细胞、上皮细胞和CD4+ Tem细胞,以及较低比例的巨核细胞-红系祖细胞和1型辅助T细胞(图三g,上图)。多重免疫荧光也进一步验证这一点(图三h)。此外,还发现两种癌旁组织亚型之间的230个DEP富含免疫特征相关蛋白,包括成 维细胞中的DPT、PRKG1、SGCD、SCRN1、EMILIN1、LMOD1、HSPB6、C7、TNXB和COL14A1;CD8+ T细胞中的CD8A和GZMK;cDC细胞中的IT-GAX、ANXA1和S100A10(图三g,下图),表明它们之间的蛋白质组差异部分源于免疫浸润细胞类型的差异。以上数据表明,亚型2癌旁组织具有更活跃的免疫微环境,这可能导致较差的预后和较高的复发率。
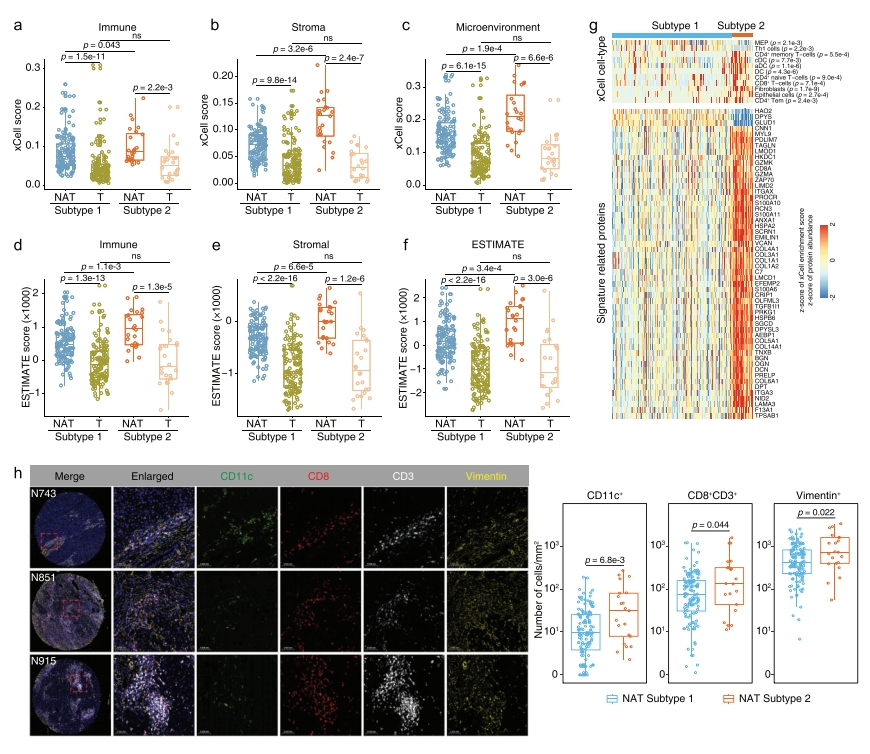
图三 两种癌旁组织亚型的免疫差异[7]
随后,研究者比较两种癌旁组织亚型和健康肝脏之间的蛋白质组学图谱。评估了14个新收集的健康肝脏组织以及先前研究中随机选择的23个癌旁组织及其配对肿瘤组织,进行DIA-MS分析(图四a)。两种癌旁组织亚型的配对肿瘤聚集在一起,没有表现出明显的分离。亚型1癌旁组织与健康肝脏组织更相似,具有较高的成对相关系数,而亚型2癌旁组织更接近肿瘤(图四b和c)。与配对肿瘤相比,癌旁组织的稳态mRNA-蛋白质相关系数更小,两种癌旁组织亚型之间没有发现差异(图四d)。但在分析差异基因mRNA-蛋白质相关性时,发现亚型2癌旁组织高于亚型1(图四e)。以上数据表明,亚型1癌旁组织比亚型2癌旁组织更类似于健康肝脏组织。
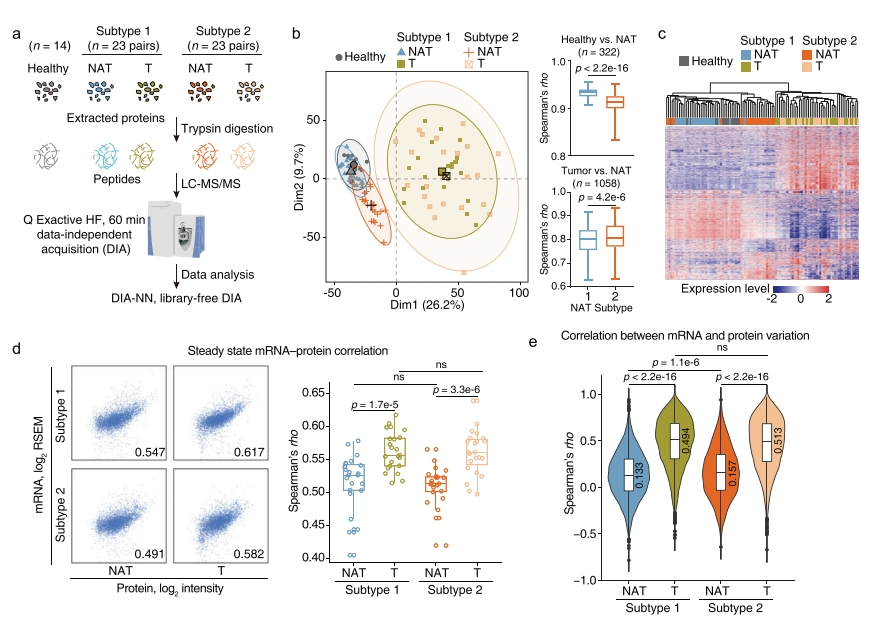
图四 亚型1癌旁组织与健康肝脏组织相似[7]
亚型1癌旁组织和健康肝脏组织之间的差异可能代表了非常早期的分子事件,研究者在两者之间鉴定出183个DEP,包括112个上调蛋白和71个下调蛋白(图五a-c)。亚型1癌旁组织上调蛋白显著富集的生物过程包括肌动蛋白丝组装、T细胞激活、离子运输正向调节等(图五d和e)。此外,13个上调蛋白被注释为分泌蛋白,提示它们可能是纤维化或HCC诊断的早期生物标志物的候选物(图五f)。在亚型2癌旁组织与健康肝脏组织之间共鉴定出1468个DEP(图五a),占总检测蛋白的28.4%,表明亚型2癌旁组织与健康肝脏组织的蛋白质组学差异显著。674个上调的蛋白主要富集在与免疫激活、粘附和白细胞介素产生相关的生物过程中,而794个下调的蛋白富集在代谢相关过程(图五g-h)。以上数据表明,亚型1癌旁组织与健康肝脏组织相似,它们之间的DEP可用于指示早期肝脏疾病的生物标志物。
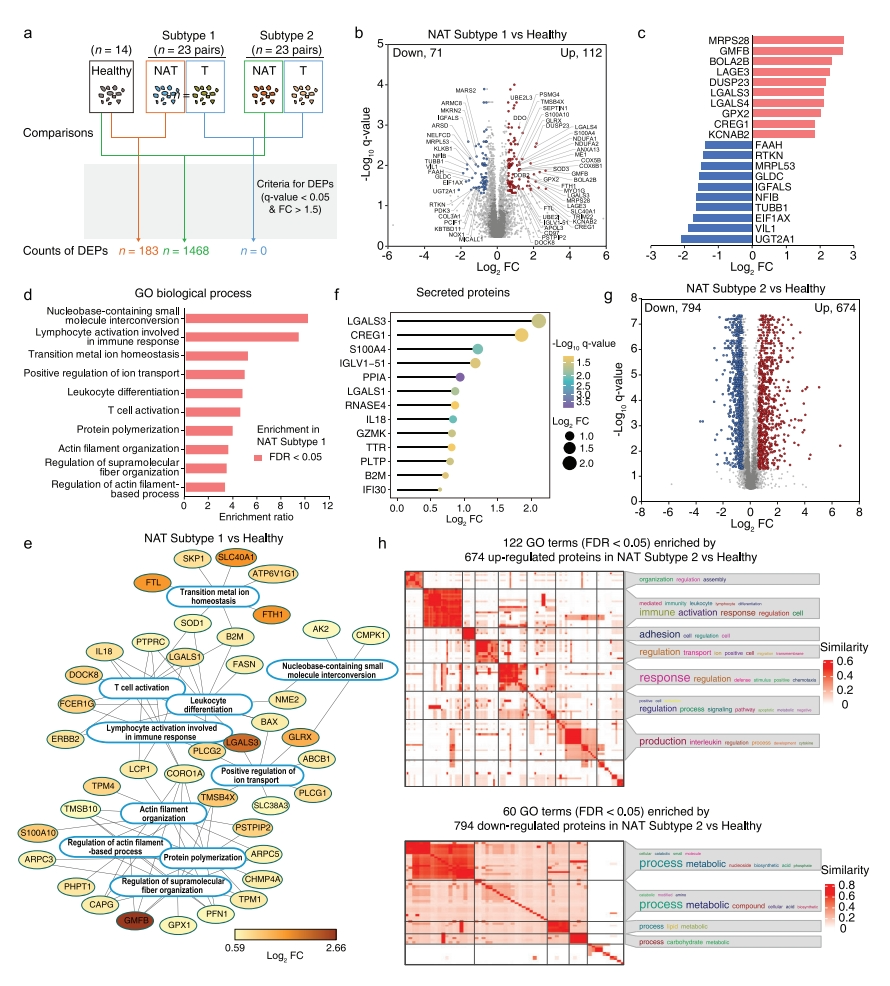
图五 两种癌旁组织亚型与健康肝脏对比的蛋白质组学差异[7]
图四b和c的样本聚类结果表明,从健康肝脏组织、亚型1癌旁组织和亚型2癌旁组织向肿瘤转移的蛋白质动态变化,可能揭示与肝癌发生相关的事件,研究者对此进行验证。首先检测了参与关键肝功能的蛋白质变化,发现糖异生的生物学过程,脂肪酸代谢,药物代谢,缬氨酸、亮氨酸和异亮氨酸(V/L/I)代谢,丙氨酸、谷氨酸、天冬氨酸和谷氨酸(A/D/E)代谢呈下降趋势;健康肝脏组织与亚型1癌旁组织之间无显著差异;亚型2癌旁组织似乎是从健康肝脏到肿瘤的中间状态(图六a)。与健康肝脏组织和亚型1癌旁组织相比,亚型2癌旁组织中胆固醇生物合成相关蛋白的水平要低得多,与肿瘤相似,表明胆固醇生物合成可能是肝癌发生的一个敏感过程(图六a)。亚型2癌旁组织正在逐渐失去关键的肝功能。为了系统地分析,研究者将所有动态蛋白质分为4个聚类,其中聚类1蛋白质呈上升趋势,聚类4蛋白呈减少趋势(图六b)。聚类1蛋白富集在细胞外结构组织、DNA复制和细胞运动正向调节;聚类4蛋白在代谢过程中富集,包括脂肪酸代谢、细胞氨基酸代谢、脂质分解代谢过程、有机阴离子转运和核苷二磷酸代谢;聚类2蛋白从健康肝脏组织到亚型1 癌旁组织、亚型2 癌旁组织逐渐下调,但在肿瘤中恢复到与健康肝脏组织相似的蛋白质丰度水平;聚类3蛋白的趋势与聚类2蛋白的相反,富集在细胞外结构组织、白细胞迁移、细胞粘附调节、T细胞活化、细胞趋化性、免疫反应调节信号通路和调节细胞骨架组织等过程(图六b和c)。值得注意的是,尽管代谢途径在HCC肿瘤中广泛下调,但一些特定的代谢相关蛋白仍呈现上调趋势。甾醇O-酰基转移酶1(SOAT1)参与胆固醇代谢,并作为聚类1的成员显示出增加的趋势,被认为是早期HCC的潜在治疗靶点。结合来自人类蛋白质图谱和之前的数据集[8]的预后信息,9种蛋白质,包括PAFAH1B3、GPD1L、LPCAT1、DCK、POLD1、ACOT7、SRM、DNMT1和G6PD,可能参与肝癌的发生。有趣的是,据报道,PAFAH1B3、LPCAT1、DCK、ACOT7和G6PD与HCC进展有关[10, 11]。这些蛋白质可能被认为是治疗HCC的潜在药物靶点。以上数据表明,聚类1蛋白在健康组织-癌旁组织-肿瘤谱中呈增加趋势,可能参与了HCC的肿瘤发生。
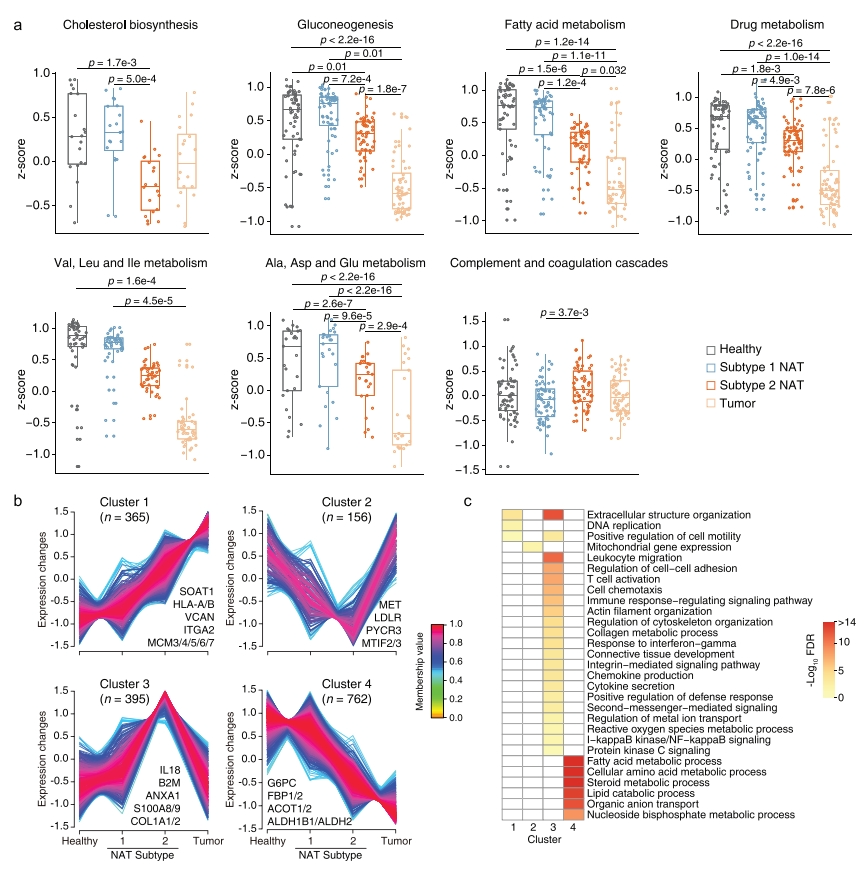
图六 健康肝脏、亚型1癌旁组织、亚型2癌旁组织到肿瘤的蛋白质动态变化[7]
综上所述,该研究采用蛋白质组学技术系统揭示了HCC癌旁组织临床特征相关的分子特征,并深入探讨了HCC癌旁组织与健康肝脏组织的蛋白质组学差异。将HCC癌旁组织分为两种与不同预后和复发相关的亚型,亚型1表现为预后良好和低风险复发,以高水平的代谢途径为特征;亚型2表现为预后不良和高风险复发,以高水平细胞外基质和粘附相关途径为特征。此外,该研究还揭示了与从健康肝脏发展为癌旁组织相关的早期分子变化,为肝癌的发生发展机制和潜在精准化靶向治疗方案奠定了理论基础。同时,研究产出的高质量大数据集将为肝癌的基础与临床研究提供重要支持。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Sung H, Ferlay J, Siegel RL: Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. 2021, 71(3):209-249.
2. Jiang Y, Sun A, Zhao Y, Ying W, Sun H, Yang X, Xing B, Sun W, Ren L, Hu B et al: Proteomics identifies new therapeutic targets of early-stage hepatocellular carcinoma. 癌旁组织ure 2019, 567(7747):257-261.
3. Jakubek YA, Chang K: Large-scale analysis of acquired chromosomal alterations in non-tumor samples from patients with cancer. 2020, 38(1):90-96.
4. Brunner SF, Roberts ND, Wylie LA, Moore L, Aitken SJ, Davies SE, Sanders MA, Ellis P, Alder C, Hooks Y et al: Somatic mutations and clonal dynamics in healthy and cirrhotic human liver. 癌旁组织ure 2019, 574(7779):538-542.
5. Ikeda A, Shimizu T, Matsumoto Y, Fujii Y, Eso Y, Inuzuka T, Mizuguchi A, Shimizu K, Hatano E, Uemoto S et al: Leptin receptor somatic mutations are frequent in HCV-infected cirrhotic liver and associated with hepatocellular carcinoma. Gastroenterology 2014, 146(1):222-232.e235.
6. Yu MC, Lee CW, Lee YS, Lian JH, Tsai CL, Liu YP, Wu CH, Tsai CN: Prediction of early-stage hepatocellular carcinoma using OncoScan chromosomal copy number aberration data. World journal of gastroenterology 2017, 23(44):7818-7829.
7. Zhu H, Lin Y, Lu D, Wang S, Liu Y, Dong L, Meng Q, Gao J, Wang Y, Song N et al: Proteomics of adjacent-to-tumor samples uncovers clinically relevant biological events in hepatocellular carcinoma. 2023, 10(8):nwad167.
8. Gao Q, Zhu H, Dong L, Shi W, Chen R, Song Z, Huang C, Li J, Dong X, Zhou Y et al: Integrated Proteogenomic Characterization of HBV-Related Hepatocellular Carcinoma. Cell 2019, 179(2):561-577.e522.
9. Santos R, Ursu O, Gaulton A, Bento AP, Donadi RS, Bologa CG, Karlsson A, Al-Lazikani B, Hersey A, Oprea TI et al: A comprehensive map of molecular drug targets. 癌旁组织ure reviews Drug discovery 2017, 16(1):19-34.
10. Song D, Wang Y, Zhu K, Tian L, Gao Q, Zhou J, Fan J, Wang X: DCK is a promising prognostic biomarker and correlated with immune infiltrates in hepatocellular carcinoma. World journal of surgical oncology 2020, 18(1):176.
11. Xie X, Chen C, Feng S, Zuo S, Zhao X, Li H: Acyl-CoA Thioesterase 7 is Transcriptionally Activated by Krüppel-Like Factor 13 and Promotes the Progression of Hepatocellular Carcinoma. Journal of hepatocellular carcinoma 2021, 8:1623-1641.



