技术分享:猪去氧胆酸治疗非酒精性脂肪肝的新机制
非酒精性脂肪性肝病(NAFLD)是临床上最常见的慢性肝病,包括单纯性脂肪肝、非酒精性脂肪性肝炎和纤维化/肝硬化。研究表明在NAFLD进展过程中胆汁酸(BA)谱式发生动态变化[1]。BA一直被认为是乳化和吸收脂肪和胆固醇的消化性清洁剂。此外,BA还是重要信号分子,通过作用于受体如G蛋白偶联胆汁酸受体1(GPBAR1或TGR5)和法尼醇X受体(FXR)来调节脂质代谢、葡萄糖稳态和免疫反应[2]。猪胆酸(HCA)种类,包括HCA、猪去氧胆酸(HDCA)及其甘氨酸和牛磺酸共轭衍生物(GHCA、THCA、GHDCA和THDCA),是猪体内的主要BA种类,也存在于人类和啮齿动物中[3]。HDCA可有效减轻胆结石形成、高脂血症和动脉粥样硬化[4],但其在NAFLD发展中的作用尚不清楚。
过氧化物酶体增殖物激活受体α(PPARα)是转录调节因子,在代谢紊乱中起着关键作用。PPARα主要在肝细胞中表达,通过激活细胞核中靶基因的转录,调节脂肪酸转运、脂肪酸氧化(FAO)和酮生成[5]。因此,促进PPARα的核定位是一种很有前途的治疗NAFLD的策略。PPARα在细胞内的含量和功能依赖于其细胞质和细胞核定位之间的转变平衡,这是受ras家族GTPase RAN和核输出受体CRM1所协调[6]。然而,还没有研究证明RAN/CRM1/PPARα的穿梭过程与BA功能在NAFLD中的相互关系。
2023年9月,Nature Communications期刊报道了一项猪去氧胆酸治疗非酒精性脂肪肝的新机制研究,发现NAFLD患者和小鼠血清HDCA水平降低,血清HDCA与NAFLD的严重程度呈负相关,膳食补充HDCA可通过增强PPARα依赖的脂肪酸氧化,改善雄性野生型小鼠饮食诱导的NAFLD。机制上,HDCA通过与肝细胞内RAN蛋白的直接相互作用,阻碍RAN/CRM1/PPARα核胞质穿梭异三聚体的形成,导致PPARα的核定位积累,促进脂肪酸氧化并减轻炎症,为BA调节脂肪酸代谢提供了新的见解[7]。
首先,研究者探究NAFLD患者血清BA组成和HCA种类的变化。招募了24名健康人群和34名NAFLD患者作为研究队列(图一a)。与健康对照组相比,NAFLD组的HCA 种类、HDCA、GHCA和THCA水平显著降低(图一b-h),HDCA和GHCA与NAFLD的临床参数呈负相关(图一i)。血清HDCA和GHCA水平与丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)水平和受控衰减参数(CAP)评分呈负相关(图一j)。此外,动物实验方面,高脂高糖喂养(HFHS)24周后,NAFLD小鼠的血清、肝脏和肠道不同部位的总HCA种类水平降低(图一k),HDCA 和THDCA也持续降低(图一l和m)。HDCA与肝脏重量、肝甘油三酯(TG)、血清ALT和AST呈负相关(图一n)。HDCA是NAFLD患者和小鼠血清中唯一持续降低的BA。以上数据表明,人类和小鼠的血清HDCA水平与肝脂肪变性呈负相关,提示饮食补充HDCA可能对NAFLD有保护作用。
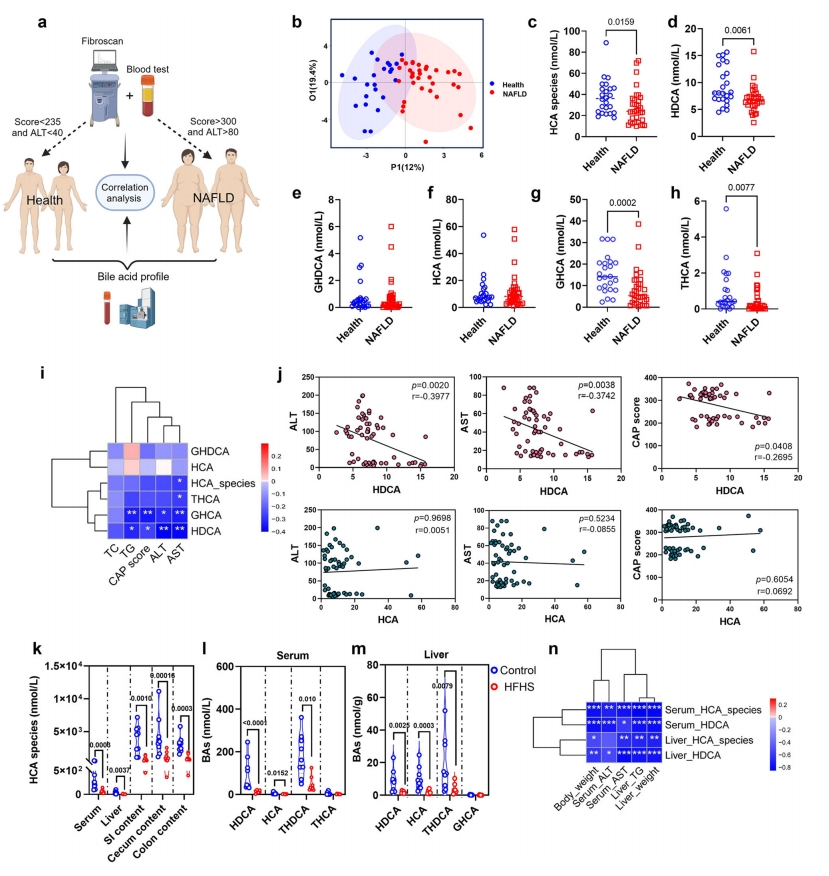
图一 NAFLD患者和小鼠的血清HDCA水平降低[7]
接着,研究者测试饮食补充HDCA能否减轻NAFLD进展。将C57BL/6小鼠分为三组:普通喂养的对照组、高脂高糖喂养的HFHS组、先HFHS喂养4周,然后在HFHS饮食中补充0.625%HDCA的HDCA组(图二a)。结果发现,补充HDCA不会影响总能量摄入,但会显著降低小鼠体重和肝脏重量(图二b和c),减轻肝脏脂肪变性和炎症评分(图二d和e),降低肝脏TG、血清ALT和AST水平(图二f),逆转HFHS诱导的肝脏炎症因子如TNF-α、IL-6和IL-1β的高表达(图二g),并改善葡萄糖稳态(图二h-i)。以上数据表明,补充HDCA可改善NAFLD小鼠的肝脏脂肪变性和炎症。
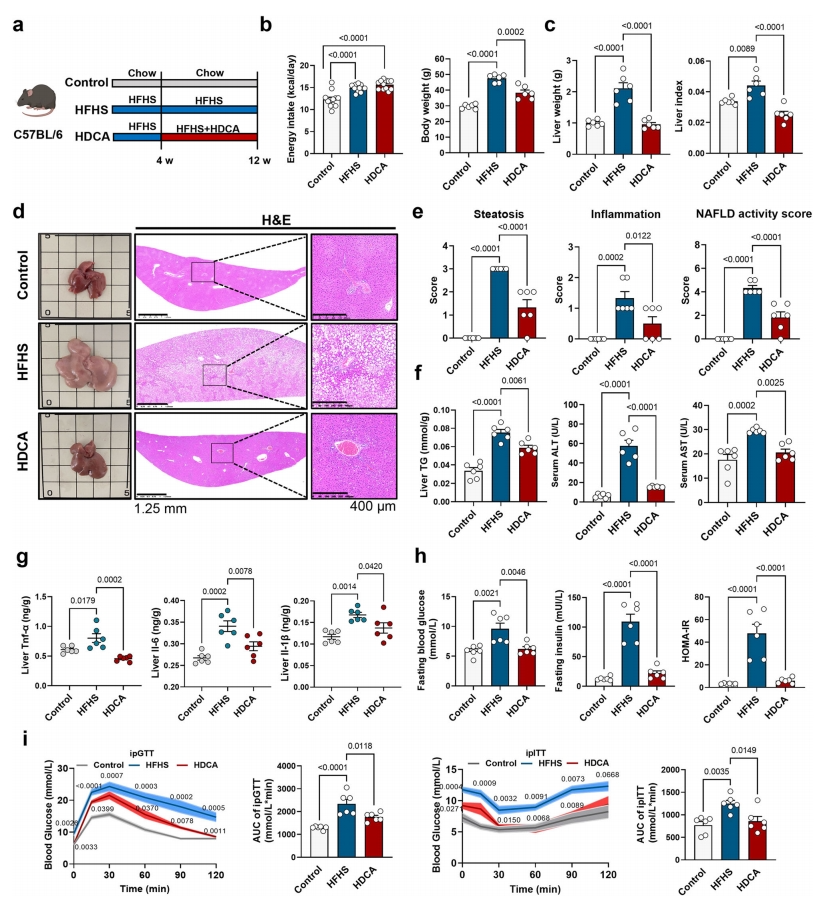
图二 补充HDCA可改善小鼠的NAFLD[7]
下一步,研究者探索HDCA保护作用的分子机制。利用基于串联质谱标记的定量蛋白质组学方法分析小鼠肝组织的蛋白质组学图谱,发现对照组与HFHS组和HFHS组与HDCA组分别有1190和623种蛋白质发生显著变化,重叠交集有430个蛋白质,其中420个被HDCA逆转(图三a)。对这420个差异蛋白的KEGG通路分析表明,高度富集在代谢通路、氧化磷酸化、NAFLD和PPAR信号通路(图三b)。脂肪酸代谢相关蛋白的热图显示,大多数FAO相关蛋白被HFHS下调,而被HDCA上调(图三c),表明HDCA对FAO过程有重要影响。利用RNA-seq分析肝脏转录组,发现对照组与HFHS组和HFHS组与HDCA组分别有2039个和1121个差异表达基因,重叠交集有769个基因,其中有 762个基因被HDCA逆转(图三d)。HFHS上调和HDCA下调的基因显著富集的KEGG通路包括许多炎症和感染相关通路(图三e和f)。而HFHS下调但HDCA上调的基因,则富集在视黄醇代谢、类固醇激素生物合成、脂肪酸降解和PPAR信号通路(图三g)。GSEA结果还揭示HDCA组中脂肪酸氧化和PPARα靶基因的富集(图三h)。线粒体脂肪酸β-氧化是脂肪酸代谢的关键步骤,结果显示HDCA显著抑制脂肪酸摄取蛋白CD36的表达,且在蛋白质和mRNA水平上激活细胞内脂肪酸结合蛋白1(FABP1)和肉碱棕榈酰转移酶2(CPT2)的表达,导致脂肪酸向线粒体的运输增加(图三i)。在7种关键的β氧化酶中,HDCA还增加了ACADL、ACADVL、HADHA、HADHB和ACAA2等5种酶的表达。以上数据表明,HDCA的抗NAFLD作用主要与肝细胞中FAO的激活有关。
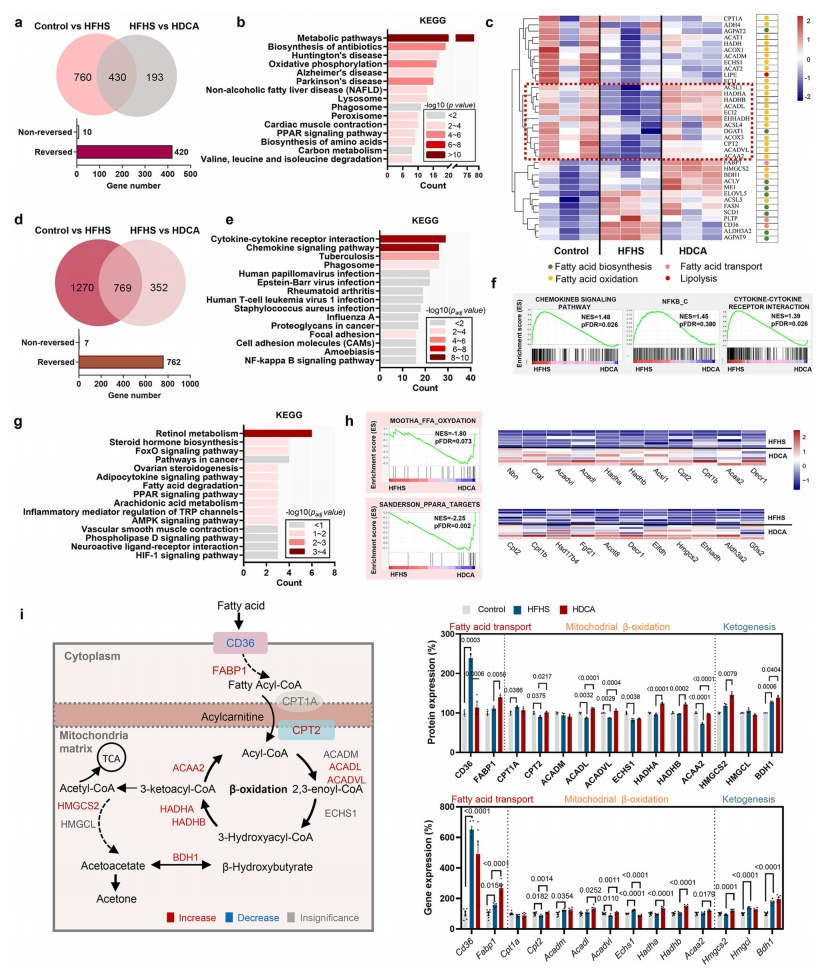
图三 HDCA激活肝细胞中的脂肪酸氧化[7]
PPARα是FAO的关键调节因子,通过激活细胞核内参与FAO的基因转录。HDCA没有改变PPARα蛋白的总含量,但增加了其核质比,而HFHS喂养降低了核质比(图四a和b)。与蛋白质组学数据一致,HDCA组中的PPARα靶基因,如FABP1、CPT2和HMGCS2的蛋白水平显著增加,而CD36表达降低(图四c)。HDCA除了在FAO发挥作用外,还可以减轻炎症(图四d和e)。研究者用两种剂量的HDCA处理AML12细胞,发现HDCA在不影响PPARα总表达的情况下,剂量依赖性地增加PPARα蛋白的细胞核含量,以及增加CPT1、CPT2和FABP1蛋白的表达(图四f)。HDCA还降低了AML12细胞和RAW264.7巨噬细胞中趋化因子和细胞因子的表达,表明HDCA具有抗炎作用(图四g和h)。以上数据表明,HDCA促进PPARα核定位,从而激活PPARα介导的FAO并抑制炎症。
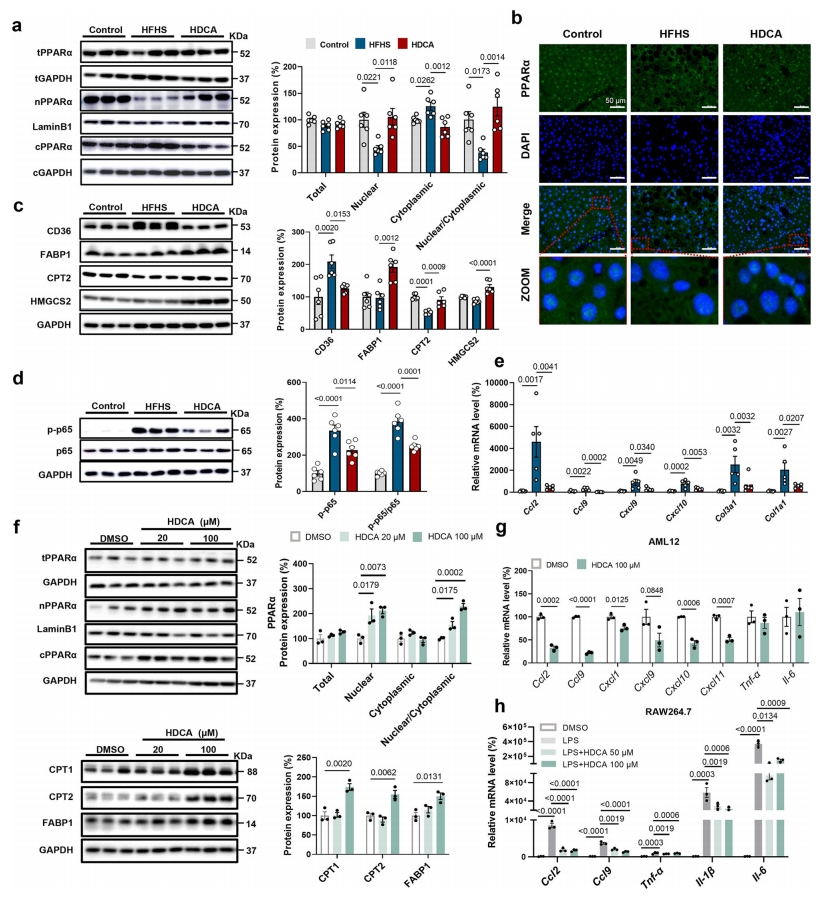
图四 HDCA刺激PPARα的核积累并促进PPARα的靶基因表达[7]
为确定HDCA的抗NAFLD作用是否是PPARα依赖的,研究者构建PPARα全身敲除(PPARα-/-)小鼠。结果显示,HDCA处理未能改善PPARα-/-小鼠的NAFLD相关疾病表型,如小鼠体重、肝脏TG、肝脏脂肪变性评分、炎症和NAS(图五a-f)。值得注意的是,HDCA对PPARα-/-小鼠中FABP1、CPT2和HMGCS2的表达没有影响(图五g)。此外,补充HDCA对PPARα-/-小鼠肝脏TNF-α、IL-6和IL-1β水平没有影响(图五h)。这些结果表明,PPARα全身敲除消除了HDCA的抗NAFLD作用。进一步构建肝细胞特异性PPARα敲除小鼠(PPARαhep-/-),发现肝脏TG脂肪变性评分、炎症评分和NAS在补充HDCA后也没有表现出任何变化(图五i-n)。一致地,PPARαhep-/-小鼠消除了HDCA在对照小鼠肝脏中诱导的FABP1、CPT2、HMGCS2蛋白表达增强和炎症细胞因子水平降低(图五o和p)。以上数据表明,HDCA的抗NAFLD作用依赖于肝脏PPARα的调节。
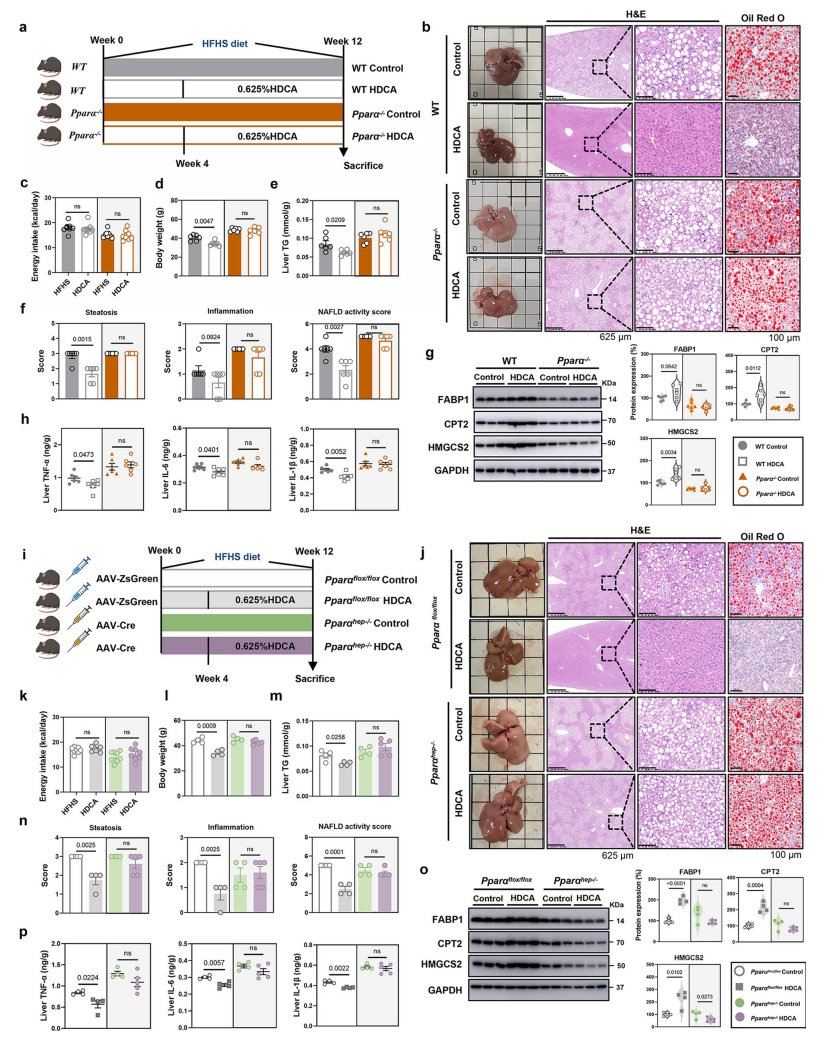
图五 PPARα缺失消除了HDCA介导的抗NAFLD作用[7]
肝脏FXR主要参与BA介导的脂质代谢,HDCA可在FXR激动剂鹅去氧胆酸存在的情况下抑制FXR活性[8]。荧光素酶报告基因测定显示,HDCA轻度激活HEK293T细胞中FXR的转录活性,并诱导AML12细胞中Shp基因的mRNA表达(图六a和b)。进一步观察到,不管是否存在FXR拮抗剂Gug,HDCA都能促进PPARα核定位,并上调PPARα靶基因的表达(图六b和c),表明HDCA促进PPARα核定位的作用不依赖于FXR。PPARα的核质穿梭受到核输入蛋白和核输出蛋白的严格控制,importin-β抑制剂IPZ可通过抑制核输入受体导致PPARα在细胞质积累,而HDCA在IPZ存在的情况下仍能促进PPARα的细胞核积累。同时,用出核转运抑制剂LMB抑制核输出受体可诱导PPARα的细胞核积累,而LMB和HDCA联合使用并没有进一步增加细胞核中PPARα的含量(图六d),表明HDCA可能调节PPARα的核输出而不是核输入过程。核输出受体CRM1和小ras家族GTPase RAN,通过结合输出蛋白形成输出异源三聚体,在核蛋白输出中发挥着重要作用[6]。在AML12细胞中,HDCA不影响CRM1总蛋白表达,但显著增加CRM1的细胞核内水平,降低细胞质水平(图六e)。体内结果同样显示,与HFHS组相比,HDCA处理组的小鼠肝脏中细胞核和细胞质CRM1的蛋白质水平分别被增加和降低(图六f)。RAN的表达和定位不受HDCA的影响(图六e和f)。以上数据表明,HDCA通过抑制CRM1介导的核输出过程来促进PPARα的核定位。
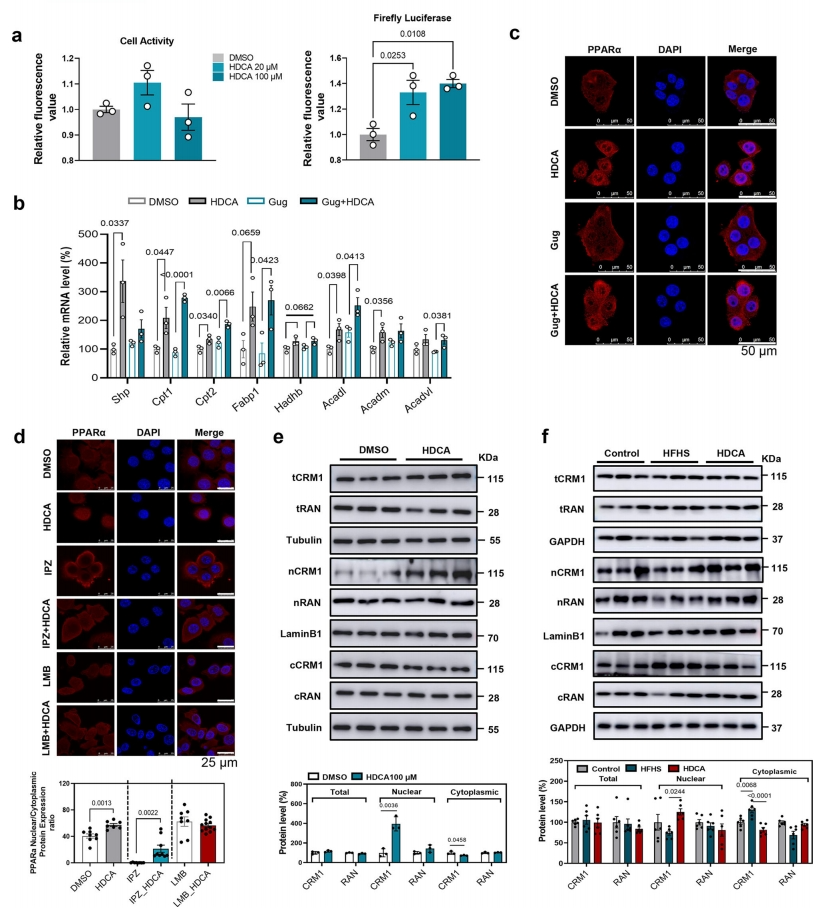
图六 HDCA以不依赖FXR的方式抑制PPARα的核输出[7]
最后,为了阐明HDCA介导的PPARα和CRM1核积累的分子机制,研究者使用生物素标记的HDCA和HuProt人类蛋白质微阵列,筛选可能参与核转运的潜在HDCA结合蛋白(图七a)。发现HDCA优先与RAN结合,而不是CRM1或PPARα(图七b)。AML12细胞的热位移测定(CETSA)进一步证实HDCA处理后RAN的热稳定性增加,表明HDCA与RAN直接相互作用(图七c)。基于这一发现,研究者假设HDCA通过与RAN蛋白直接结合来减少RAN/CRM1/PPARα异源三聚体的形成,导致PPARα核质穿梭被阻断(图七d)。免疫共沉淀(Co-IP)结果发现,RAN在CRM1免疫沉淀物中很容易被检测到,而HDCA减少了RAN和CRM1之间的相互作用。类似地,观察到CRM1和PPARα之间的明显相互作用,HDCA降低了CRM1与PPARα的结合(图七e)。过表达实验和邻近连接测定(PLA)都验证了RAN/ CRM1/PPARα相互作用(图七f和g)。分子对接研究显示,RAN和HDCA之间的结合主要锚定在Gly-5、Pro-49和Val-51(图七h),这三个氨基酸的突变几乎消除了HDCA减少的RAN/CRM1相互作用(图七i)。以上数据表明,HDCA与RAN直接结合,减少核质穿梭异源三聚体RAN/CRM1/PPARα的形成,从而增加PPARα的核积累。
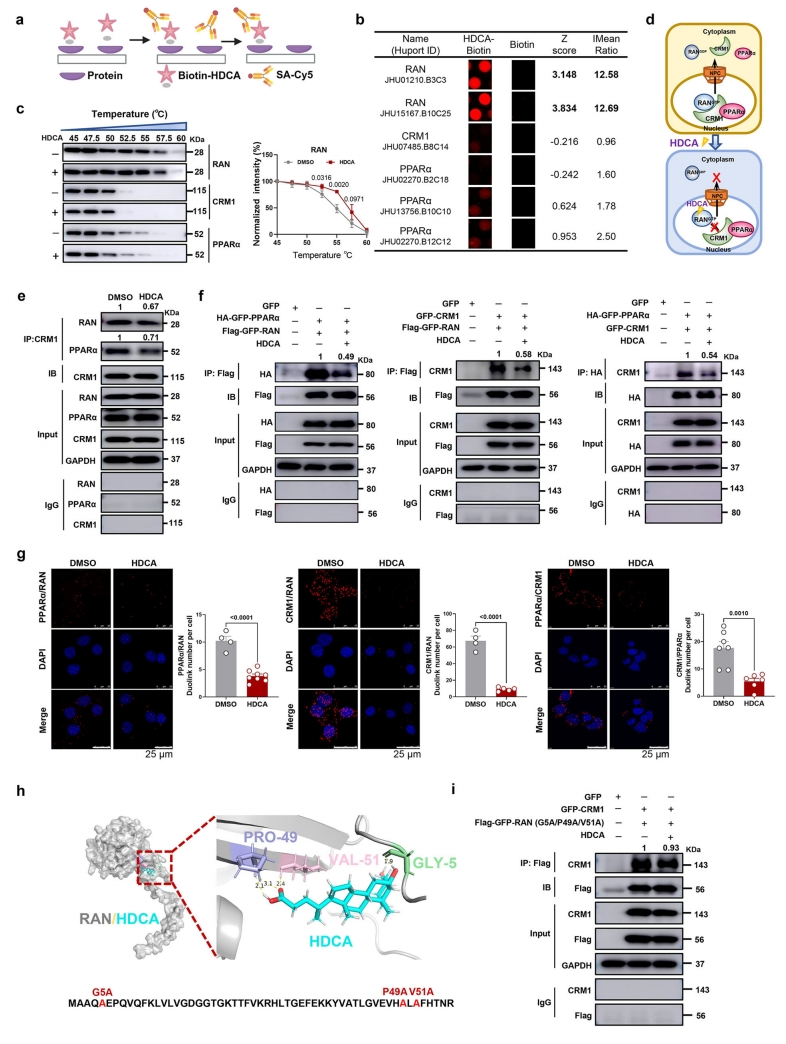
图七 HDCA与RAN的直接结合抑制RAN/CRM1/ PPARα输出异源三聚体的形成[7]
综上所述,该研究利用靶向代谢组学方法检测临床非酒精性脂肪肝(NAFLD)患者血清胆汁酸谱,发现NAFLD患者血清中猪去氧胆酸(HDCA)水平显著低于健康对照人群,且HDCA水平与NAFLD临床指征存在显著的负相关,如在小鼠饮食中添加HDCA则可显著改善NAFLD及各种代谢异常。机制研究发现HDCA通过结合肝细胞内RAN蛋白,干扰RAN和出核转运蛋白CRM1的结合,进而抑制RAN/CRM1/PPARα异三聚体的形成,抑制PPARα出核,增加肝细胞核内PPARα蛋白含量,促进脂肪酸氧化,并减轻炎症。该研究阐释了HDCA进入肝细胞后靶向抑制RAN/CRM1/PPARα异源三聚体的形成,治疗NAFLD的全新机制,也为HDCA治疗NAFLD提供了依据。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Nimer N, Choucair I, Wang Z, Nemet I, Li L, Gukasyan J, Weeks TL, Alkhouri N, Zein N, Tang WHW et al: Bile acids profile, histopathological indices and genetic variants for non-alcoholic fatty liver disease progression. Metabolism: clinical and experimental 2021, 116:154457.
2. Chávez-Talavera O, Tailleux A, Lefebvre P, Staels B: Bile Acid Control of Metabolism and Inflammation in Obesity, Type 2 Diabetes, Dyslipidemia, and Nonalcoholic Fatty Liver Disease. Gastroenterology 2017, 152(7):1679-1694.e1673.
3. Spinelli V, Lalloyer F, Baud G, Osto E, Kouach M, Daoudi M, Vallez E, Raverdy V, Goossens JF, Descat A et al: Influence of Roux-en-Y gastric bypass on plasma bile acid profiles: a comparative study between rats, pigs and humans. International journal of obesity (2005) 2016, 40(8):1260-1267.
4. Shih DM, Shaposhnik Z, Meng Y, Rosales M, Wang X, Wu J, Ratiner B, Zadini F, Zadini G, Lusis AJ: Hyodeoxycholic acid improves HDL function and inhibits atherosclerotic lesion formation in LDLR-knockout mice. FASEB journal : official publication of the Federation of American Societies for Experimental Biology 2013, 27(9):3805-3817.
5. Bougarne N, Weyers B, Desmet SJ, Deckers J, Ray DW, Staels B, De Bosscher K: Molecular Actions of PPARα in Lipid Metabolism and Inflammation. Endocrine reviews 2018, 39(5):760-802.
6. Sekimoto T, Yoneda Y: Intrinsic and extrinsic negative regulators of nuclear protein transport processes. Genes to cells : devoted to molecular & cellular mechanisms 2012, 17(7):525-535.
7. Zhong J, He X, Gao X, Liu Q, Zhao Y, Hong Y, Zhu W, Yan J, Li Y, Li Y et al: Hyodeoxycholic acid ameliorates nonalcoholic fatty liver disease by inhibiting RAN-mediated PPARα nucleus-cytoplasm shuttling. Nat Commun 2023, 14(1):5451.
8. Perino A, Demagny H, Velazquez-Villegas L, Schoonjans K: Molecular Physiology of Bile Acid Signaling in Health, Disease, and Aging. Physiol Rev 2021, 101(2):683-731.



