技术分享:发现肿瘤免疫治疗新靶点CD300ld
免疫检查点阻断疗法在肿瘤治疗中取得了革命性进展。然而,相当比例的患者对治疗仅表现出轻微甚至无应答[1]。肿瘤微环境(TME)含有大量抑制免疫的髓系细胞群,在肿瘤发展和治疗耐受中发挥关键作用,是现有免疫治疗的严重阻碍。中性粒细胞是高度丰富且异质性的髓系细胞,是先天防御急性感染和炎症的第一道防线。在癌症和其他病理性慢性炎症中,中性粒细胞从骨髓中的释放异常增加。而这些中性粒细胞往往功能异常,特别是在晚期癌症中,表现出高水平的可塑性,直接或间接地促进了肿瘤发生[2, 3]。这种病理性激活的中性粒细胞表现出强大的免疫抑制活性,被命名为PMN-MDSCs,是小鼠和人类肿瘤发生中TME的关键成分[3, 4]。在肿瘤环境中,大多数中性粒细胞被证明是具有免疫抑制活性的PMN-MDSCs,它们促进多类型的肿瘤进展,导致对免疫治疗的不良反应[5]。肿瘤中同时存在着多种中性粒细胞的发育状态。PMN-MDSCs和经典中性粒细胞具有相同的骨髓来源和表面标志物,尽管它们的功能不同,还不能被很好地区分[3]。因此,亟需寻找与PMN-MDSCs招募和功能相关的关键分子,从而选择性靶向PMN-MDSCs进行肿瘤免疫治疗。
2023年9月,Nature期刊报道了一项肿瘤免疫治疗新靶点研究,发现CD300ld是PMN-MDSCs特异性表面标志物和关键免疫抑制受体,可促进肿瘤进展。CD300ld通过STAT3-S100A8/A9轴发挥作用,靶向性阻断CD300ld可重塑肿瘤免疫微环境,显示出抗肿瘤功效以及与抑制免疫检查点PD1的协同疗效[6]。
首先,为了寻找参与建立肿瘤免疫微环境的PMN-MDSCs表面标志物,研究者比较了肿瘤来源的髓系细胞和淋巴细胞的转录组。选择356个髓系细胞特异性高表达的膜蛋白基因,构建sgRNA文库,并转导至Cas9小鼠的造血干细胞和祖细胞,随后移植到经致死剂量辐照的野生型小鼠中,重建免疫系统。4周后接种B16-F10肿瘤细胞,成瘤后分离肿瘤和骨髓中的CD45+免疫细胞进行sgRNA深度测序(图一a)。与骨髓相比,靶向Itgam和Trem2的sgRNA在肿瘤部位表现为特异性耗竭(图一b和c),其中Itgam编码介导白细胞粘附和迁移的髓系细胞表面标志物[7],Trem2编码病理诱导的免疫信号中枢[8],证明了此筛选方法的有效性。在所有测试的膜蛋白中,CD300ld排名最前,Cd300ld sgRNA在肿瘤中显示出显著性耗竭(图一b和c),提示表达CD300ld的细胞被特异性募集到肿瘤部位。在正常小鼠中,CD300ld主要表达在免疫器官中,包括骨髓和脾脏;在免疫细胞群中,CD300ld表达仅限于髓系细胞,在中性粒细胞中高表达,且在巨噬细胞和单核细胞中低表达(图一d和e)。RT-qPCR和流式细胞术证实CD300ld在荷瘤小鼠的中性粒细胞中上调表达(图一f-h)。CD14被鉴定为区分PMN-MDSCs和中性粒细胞的表面标志物[9]。在B16-F10荷瘤小鼠中,中性粒细胞CD14+ 细胞比例显著增加,并且这些CD14+ 中性粒细胞比CD14- 中性粒细胞表达更高水平的CD300ld(图一i),进一步证明PMN-MDSCs比无肿瘤中性粒细胞表达更高水平的CD300ld。以上数据表明,CD300ld是中性粒细胞和PMN-MDSCs的表面标志物,并且其在肿瘤进展过程中被上调表达,可能具有肿瘤促进作用。
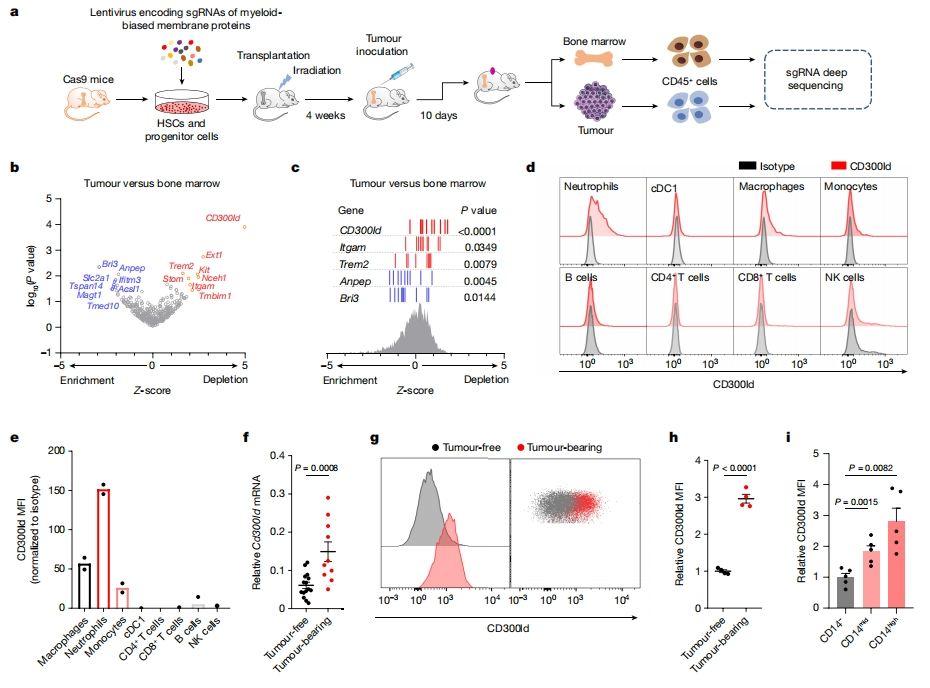
图一 CRISPR体内筛选鉴定出PMN-MDSCs表面标志物CD300ld有利于肿瘤进展[6]
接下来,研究者探究CD300ld在肿瘤进展中的作用,构建Cd300ld敲除(KO)小鼠,将B16-F10黑色素瘤细胞皮下注射到野生型和Cd300ld KO小鼠中。与野生型小鼠相比,Cd300ld KO小鼠的肿瘤生长显著减少,在接种后第16天肿瘤质量减少65%,显著提高了小鼠存活率(图二a和b)。在其他同源肿瘤移植小鼠模型中也得到了相似结果,包括TC-1、LLC、MC38和EL4肿瘤细胞系(图二c-f)。利用流体动力学注射肉豆蔻酰化的AKT1(myr-AKT)和NRAS(V12)的转座子表达质粒,可诱导小鼠肝细胞癌(HCC)造模[10]。发现Cd300ld KO显著抑制了HCC进展,肝脏与身体质量比降低约50%,显著延长小鼠的生存期(图二g)。以上数据表明,Cd300ld KO抑制了多种肿瘤模型的疾病进展。
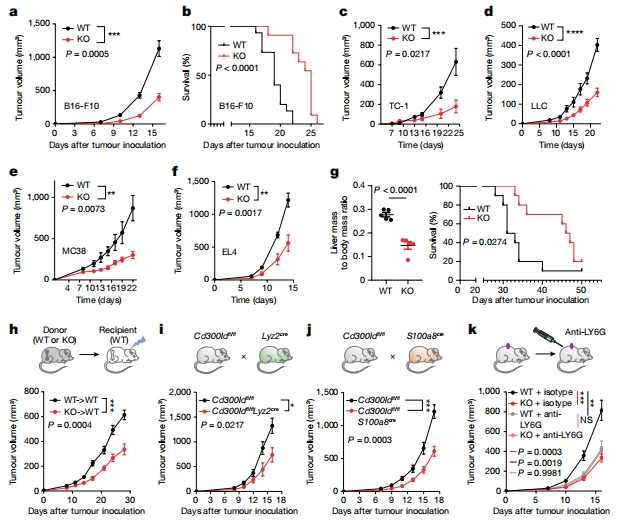
图二 Cd300ld KO以PMN-MDSCs依赖的方式抑制肿瘤进展[6]
为了确定哪些CD300ld表达细胞调节肿瘤进展,研究者使用骨髓移植来重建受体小鼠的免疫系统,然后接种肿瘤细胞。当用Cd300ld KO供体骨髓细胞重建野生型受体小鼠时,肿瘤生长明显慢于野生型供体(图二h)。为了在髓系细胞包括巨噬细胞、单核细胞和中性粒细胞中特异性敲除Cd300ld,研究者构建Cd300ldfl/fl Lyz2cre小鼠,发现在髓系细胞条件性敲除Cd300ld显著抑制了肿瘤进展,与Cd300ld KO小鼠类似(图二i)。进一步缩小涉及细胞群体,将Cd300ldfl/fl小鼠与S100a8cre小鼠杂交,获得PMN-MDSCs特异性敲除Cd300ld小鼠,同样显著性抑制肿瘤生长(图二j),表明PMN-MDSCs是CD300ld促进肿瘤进展的主要细胞类型。用LY6G抗体处理荷瘤小鼠可以耗尽PMN-MDSCs,发现抗体处理在野生型荷瘤小鼠中具有显著的抗肿瘤作用,但在Cd300ld KO小鼠中没有(图二k),进一步证实CD300ld是PMN-MDSCs促进肿瘤进展所必需的,并且Cd300ld KO通过PMN-MDSCs抑制肿瘤进展。
研究者进一步阐明Cd300ld KO是否影响肿瘤免疫微环境。在B16-F10肿瘤模型中,Cd300ld KO显著减少了PMN-MDSCs向肿瘤的募集,同时CD8+ T细胞和CD4+ T细胞的肿瘤浸润显著增加(图三a-c)。使用scRNA-seq分析肿瘤浸润的CD45+ 免疫细胞,鉴定出13种独特的细胞亚群,其中CD300ld主要在PMN-MDSCs中表达(图三d)。与野生型小鼠相比,大多数免疫抑制细胞群,包括髓系PMN-MDSCs、单核细胞髓系衍生抑制细胞(M-MDSCs)和巨噬细胞,以及淋巴调节T(Treg)细胞,在Cd300ld KO小鼠的肿瘤中表现出细胞数量减少,PMN-MDSCs减少最为显著。相反,抗肿瘤作用的细胞群数量增加,包括CD8+ T细胞、CD4+ T细胞和NK细胞,表明Cd300ld KO显著改变了TME的细胞组成,从促肿瘤状态转变为抗肿瘤状态(图三e和f)。此外,Cd300ld KO显著下调中性粒细胞迁移,髓系细胞表现出炎症增加和抗炎基因表达显著降低(图三g)。Cd300ld KO小鼠TME中的CD8+ T细胞活化和迁移得分显著提高(图三h),与T细胞浸润增加一致,表明Cd300ld KO TME中的T细胞更具免疫活性。以上数据表明,Cd300ld KO将TME从免疫抑制状态重塑为免疫活化状态。
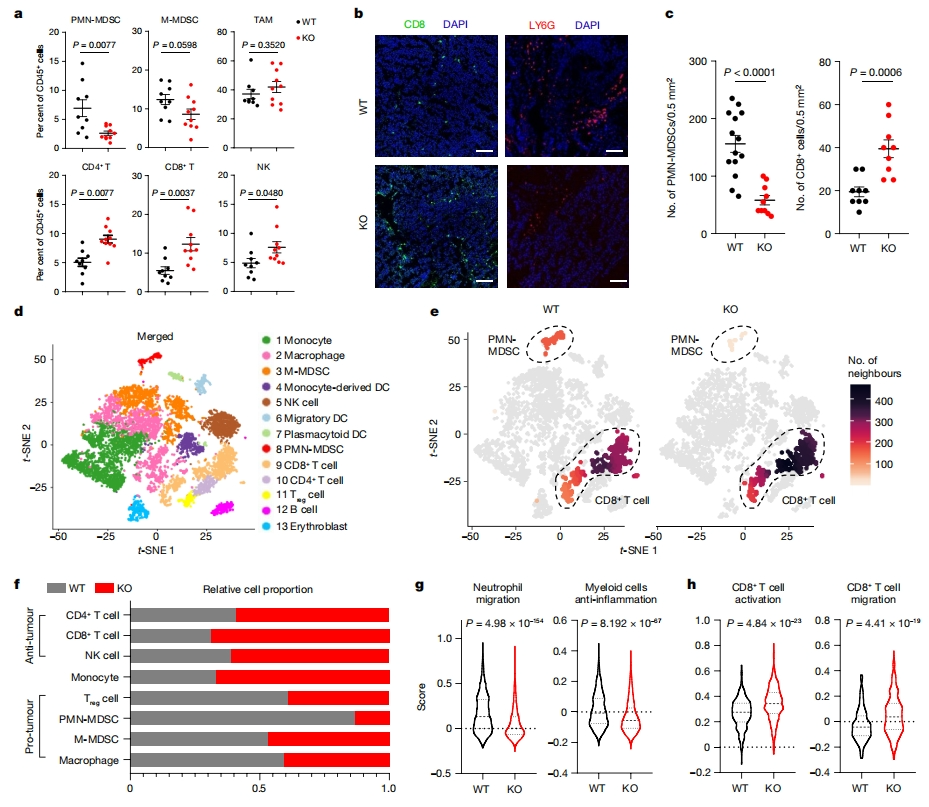
图三 Cd300ld KO重塑肿瘤免疫抑制微环境[6]
接着,研究者进一步确定CD300ld在PMN-MDSCs中的功能。使用RNA测序分析PMN-MDSCs的基因表达谱,发现Cd300ld KO显著降低了与中性粒细胞迁移途径相关基因的表达(图四a)。Transwell测定显示,与野生型PMN-MDSCs相比,Cd300ld KO PMN-MDSCs的迁移显著减少(图四b)。使用体内迁移竞争分析来剖析Cd300ld KO对PMN-MDSCs募集到肿瘤的影响,用Cell Trace Violet(CTV)标记PMN-MDSCs,分别产生CTV低的野生型和CTV高的Cd300ld KO细胞群,并将它们1:1混合注射到野生型荷瘤小鼠中(图四c)。两种PMN-MDSCs向骨髓的迁移是相似的,然而Cd300ld KO PMN-MDSCs在肿瘤部位的富集显著低于野生型PMN-MDSCs(图四d和e),表明CD300ld在PMN-MDSCs向肿瘤的迁移和募集中起着关键作用。此外,还发现Cd300ld KO PMN-MDSCs表现出ARG1表达显著减少,推测可能参与调节PMN-MDSCs的免疫抑制功能。为证实PMN-MDSCs的T细胞抑制活性是否受CD300ld的调节,研究者将PMN-MDSCs与OT-1脾细胞共培养,并用卵白蛋白(OVA)肽刺激。发现野生型PMN-MDSCs显著抑制OVA肽诱导的T细胞增殖,但Cd300ld KO PMN-MDSCs的抑制作用大大降低,表明Cd300ld KO消除了PMN-MDSCs的T细胞抑制活性(图四g和h)。进一步发现Cd300ld KO显著降低了CD14+ 细胞的T细胞抑制活性和迁移,但对CD14- 细胞的抑制活性和迁移几乎没有影响(图四i)。以上数据表明,CD300ld是PMN-MDSCs肿瘤迁移以及PMN-MDSCs介导的T细胞抑制所必需的.
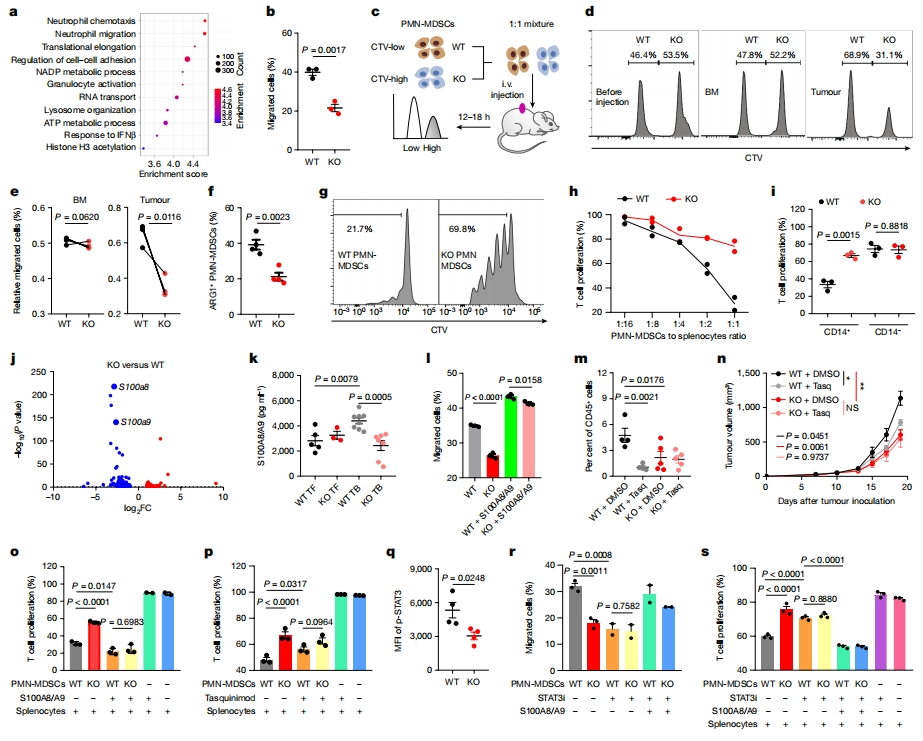
图四 CD300ld通过S100A8/A9调节PMN-MDSCs的迁移和T细胞抑制活性[6]
为挖掘PMN-MDSCs中CD300ld的下游因子,研究者比较野生型和Cd300ld KO PMN-MDSCs的转录组数据,观察到S100A8和S100A9(以下统称为S100A8/A9)在Cd300ld KO后显著下调(图四j)。S100A8/A9主要由中性粒细胞和单核细胞表达和分泌,它们可在MDSCs中高水平积累,形成异二聚体,并在各种实体瘤和白血病中促进肿瘤进展和免疫逃逸[2]。在野生型小鼠中,S100A8/A9异二聚体的血清水平在荷瘤后显著增加;而在Cd300ld KO小鼠中没有显示出显著差异(图四k),表明S100A8/A9在Cd300ld的下游起作用。探究S100A8/A9在CD300ld介导的PMN-MDSCs迁移中的作用,发现与野生型PMN-MDSCs相比,S100A8/A9蛋白的添加显著增加了Cd300ld KO PMN-MDSCs中的迁移,导致两个细胞群之间的迁移率相似(图四l),表明S100A8/A9挽救了Cd300ld KO诱导的PMN-MDSCs迁移缺陷。用S100A9抑制剂他喹莫德处理荷瘤小鼠,显著降低了野生型小鼠中PMN-MDSCs向肿瘤的募集,降低到Cd300ld KO水平,且他喹莫德处理没有进一步降低Cd300ld KO PMN-MDSCs向肿瘤募集的水平(图四m)。经他喹莫德处理的野生型和Cd300ld KO小鼠的肿瘤生长相似(图四n),推测S100A8/A9也参与CD300ld介导的PMN-MDSCs抑制T细胞活性。为证实这一推测,研究者在OVA肽存在的情况下,将S100A8/A9蛋白添加到PMN-MDSCs与OT-1脾细胞的共培养中,发现它们恢复了Cd300ld KO PMN-MDSCs抑制T细胞活化的能力(图四o);反之,他喹莫德将野生型PMN-MDSCs的T细胞抑制活性降低到与Cd300ld KO PMN-MDSCs相似的水平(图四p)。STAT3在调节MDSCs的分化和耐受作用中具有重要作用,并且可以被募集到S100a8和S100a9的启动子区域[11]。与野生型PMN-MDSCs相比,Cd300ld KO PMN-MDSCs表现出显著低水平的磷酸化STAT3(图四q)。STAT3抑制剂可将野生型PMN-MDSCs的迁移和T细胞抑制活性降低到与Cd300ld KO相似水平,且可以通过添加S100A8/A9来恢复(图四r和s)。以上数据表明STAT3在CD300ld的下游起调节S100A8/A9的作用。
随后,研究者检测Cd300ld KO对已建立的肿瘤生长的影响。构建Cd300ldfl /fl Mx1cre小鼠,在B16-F10接种后第7天,肿瘤达到约50 mm3时给与poly(I:C)处理以敲除造血细胞中的Cd300ld(图五a)。与Cd300ldfl /fl 对照小鼠相比,Poly(I:C)处理显著减少了Cd300ldfl /fl Mx1cre小鼠的肿瘤生长(图五b和c),表明在肿瘤建立阶段KO Cd300ld也可以抑制肿瘤进展。CD300ld是一种单跨膜蛋白,研究者测试是否有可能使用其细胞外结构域(ECD)竞争性阻断CD300ld。CD300ld-ECD-hFc的表达对体外B16-F10肿瘤细胞的生存能力没有显著影响,然而,当在肿瘤接种后第7天给予小鼠时,与对照处理相比,CD300ld-ECD-hFc显著抑制了肿瘤生长(图五d和e)。在Cd300ld KO小鼠中,CD300ld-ECD-hFc处理未观察到额外的肿瘤抑制作用(图五f)。PD1抑制T细胞的活化,CD300ld对于PMN-MDSCs抑制T细胞是必不可少的,提示PD1和CD300ld的双重阻断可能表现出更强的抗肿瘤功效。研究者在肿瘤接种后第7天用抗PD1处理野生型和Cd300ld KO荷瘤小鼠,发现抗PD1处理在野生型和Cd300ld KO小鼠中都产生了显著的肿瘤抑制作用,并显著提高了小鼠的存活率(图五j-l),表明抗PD1和CD300ld敲除具有协同作用。研究者还在荷瘤小鼠中评价CD300ld-ECD-hFc和抗PD1的联合效果,同样观察到协同作用,肿瘤抑制水平高于单一治疗(图五m-o)。以上数据表明,阻断CD300ld可以抑制已建立的肿瘤生长,并与抗PD1表现出协同作用,CD300ld可以作为增强检查点抑制剂疗效的治疗靶点。
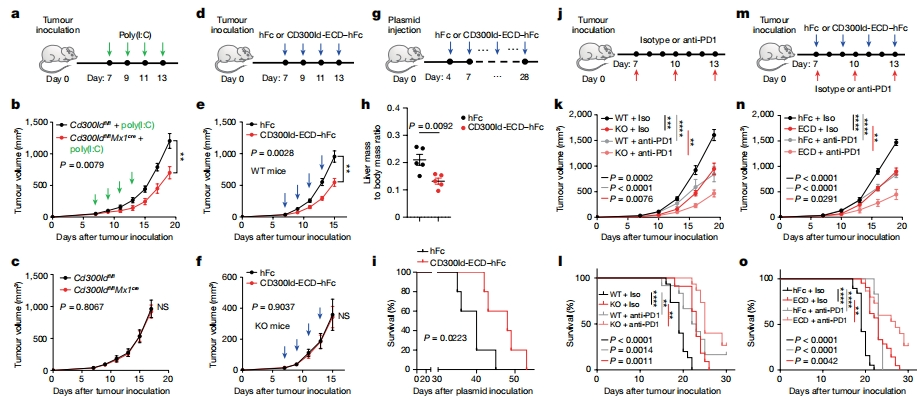
图五 阻断CD300ld可抑制已建立的肿瘤生长并与抗PD1表现出协同作用[6]
最后,研究者探究CD300LD在人类癌症中的作用,观察到CD300LD特异性高表达在人类中性粒细胞(图六a),并在结肠癌或肺癌患者外周血的PMN-MDSCs具有更高的表达水平(图六b)。在黑色素瘤患者样本中,CD300LD与中性粒细胞标记物MPO和CD15共定位,且在癌组织中观察到比癌旁组织更高的表达(图六c和d)。癌症基因组图谱数据分析显示,CD300LD在多种肿瘤位点的表达相比癌旁和正常组织显著更高(图六e),CD300LD高表达显示出与皮肤黑色素瘤患者低生存率的显著相关性(图六f)。通过在Cd300ld的起始密码子处插入人CD300LD PolyA盒,构建了CD300LD人源化(huLD)小鼠。B16-F10和TC-1的肿瘤进展(图六g)、肿瘤浸润的PMN-MDSCs和CD8+ T细胞水平以及S100A8/A9异二聚体的血清水平(图六h和i)在HuLD和野生型小鼠中相似,表明人CD300LD在肿瘤促进中具有保守功能。在肿瘤接种后第7天用人CD300LD-ECD治疗huLD荷瘤小鼠,同样观察到肿瘤生长的显著减少和存活率增加(图六j)。以上数据表明,CD300LD的促肿瘤活性在小鼠和人之间是一致的,具有同功性,提示CD300LD是人类肿瘤免疫疗法的潜在靶点。
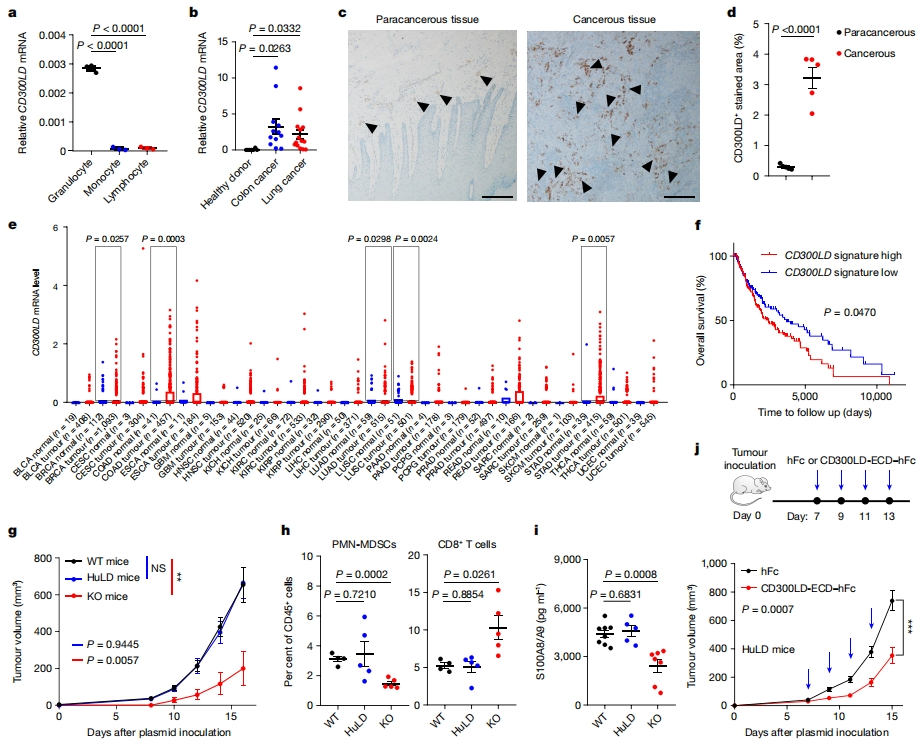
图六 CD300LD在人类癌症中具有保守功能[6]
综上所述,研究者在肿瘤小鼠模型中进行了体内CRISPR-Cas9筛选,发现CD300ld这个肿瘤偏爱受体的最佳候选者。CD300ld在正常中性粒细胞中特异性表达,并在携带肿瘤的PMN-MDSCs中上调表达。CD300ld是将PMN-MDSCs募集到肿瘤以及抑制T细胞活化功能所必需的,敲除后以PMN-MDSCs依赖的方式抑制多种肿瘤类型的进展。CD300ld通过STAT3-S100A8/A9轴发挥作用,敲除后可逆转肿瘤免疫抑制微环境。CD300LD同样在人类癌症中上调表达,并显示出与患者生存不利的相关性。阻断CD300ld活性可抑制肿瘤进展,并与抗PD1具有协同作用。该研究确定了CD300ld是PMN-MDSCs的关键免疫抑制受体,是肿瘤免疫耐受所必需的。此外,CD300ld靶点显示出广谱抗肿瘤效果,为肿瘤免疫疗法提供了新的潜在靶点,具有重要的临床转化意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献:
1. Nanda VGY, Peng W, Hwu P, Davies MA, Ciliberto G, Fattore L, Malpicci D, Aurisicchio L, Ascierto PA, Croce CM et al: Melanoma and immunotherapy bridge 2015 : Naples, Italy. 1-5 December 2015. Journal of translational medicine 2016, 14(1):65.
2. Veglia F, Sanseviero E, Gabrilovich DI: Myeloid-derived suppressor cells in the era of increasing myeloid cell diversity. Nature reviews Immunology 2021, 21(8):485-498.
3. Hegde S, Leader AM, Merad M: MDSC: Markers, development, states, and unaddressed complexity. Immunity 2021, 54(5):875-884.
4. Bronte V, Brandau S, Chen SH, Colombo MP, Frey AB, Greten TF, Mandruzzato S, Murray PJ, Ochoa A, Ostrand-Rosenberg S et al: Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nature communications 2016, 7:12150.
5. Zhou J, Nefedova Y, Lei A, Gabrilovich D: Neutrophils and PMN-MDSC: Their biological role and interaction with stromal cells. Seminars in immunology 2018, 35:19-28.
6. Wang C, Zheng X, Zhang J, Jiang X, Wang J, Li Y, Li X, Shen G, Peng J, Zheng P et al: CD300ld on neutrophils is required for tumour-driven immune suppression. Nature 2023, 621(7980):830-839.
7. Ahn GO, Tseng D, Liao CH, Dorie MJ, Czechowicz A, Brown JM: Inhibition of Mac-1 (CD11b/CD18) enhances tumor response to radiation by reducing myeloid cell recruitment. Proc Natl Acad Sci U S A 2010, 107(18):8363-8368.
8. Molgora M, Esaulova E, Vermi W, Hou J, Chen Y, Luo J, Brioschi S, Bugatti M, Omodei AS, Ricci B et al: TREM2 Modulation Remodels the Tumor Myeloid Landscape Enhancing Anti-PD-1 Immunotherapy. Cell 2020, 182(4):886-900.e817.
9. Veglia F, Hashimoto A, Dweep H, Sanseviero E, De Leo A, Tcyganov E, Kossenkov A, Mulligan C, Nam B, Masters G et al: Analysis of classical neutrophils and polymorphonuclear myeloid-derived suppressor cells in cancer patients and tumor-bearing mice. The Journal of experimental medicine 2021, 218(4):e20201803.
10. Ho C, Wang C, Mattu S, Destefanis G, Ladu S, Delogu S, Armbruster J, Fan L, Lee SA, Jiang L et al: AKT (v-akt murine thymoma viral oncogene homolog 1) and N-Ras (neuroblastoma ras viral oncogene homolog) coactivation in the mouse liver promotes rapid carcinogenesis by way of mTOR (mammalian target of rapamycin complex 1), FOXM1 (forkhead box M1)/SKP2, and c-Myc pathways. Hepatology 2012, 55(3):833-845.
11. Cheng P, Corzo CA, Luetteke N, Yu B, Nagaraj S, Bui MM, Ortiz M, Nacken W, Sorg C, Vogl T et al: Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein. The Journal of experimental medicine 2008, 205(10):2235-2249.



