技术分享:调节性T细胞需要IL6Rα信号来调控骨骼肌功能和再生
肥胖正威胁着全球健康,营养过剩和缺乏体育锻炼是造成肥胖的主要原因[1]。肥胖导致的代谢功能紊乱是发生心血管并发症的危险因素,可通过热量限制和运动训练等生理干预措施来有效预防和治疗代谢紊乱[2]。尽管如此,人们对运动获益的了解非常有限,特别是在肌肉功能、局部免疫反应调节和运动之间的相互联系分子还不明确。
已在骨骼肌中发现了一群特定的组织调节性T细胞(Treg),表达着不同的T细胞受体(TCR)和特定的转录组[3]。Treg的特征是表达有CD4、CD25和转录因子Foxp3,其中Foxp3是Treg发育和功能的主要调节因子[4]。这些定位于肌肉等非淋巴组织的Treg在控制和维持组织稳态、完整性和功能等方面发挥着关键作用[5]。肌肉Treg高表达双向调节蛋白(Areg),这是表皮生长因子(EGF)家族成员,其受体EGFR在肌肉的免疫细胞和卫星细胞(SC)中都有表达[5]。运动可促使肌肉释放一种关键的肌细胞因子IL6[6]。与其在肥胖相关代谢疾病中的促炎作用不同,肌肉内的IL6信号在运动后并不激活促炎通路如TNF-α和IL-1β,而是激活抗炎细胞因子如IL-10[7]。分子机制上,IL6可通过经典信号传导通路,先结合膜结合受体IL6Rα,再与gp130(也称为IL6Rβ)结合,启动细胞内信号传导。此外,通过可溶性sIL6R的反式信号传导和树突细胞(DC)以抗原特异性方式介导的T细胞反式呈递都体现了IL6的多效性[8]。然而,运动能否调节肌肉Treg及其功能,肌肉对运动的响应过程Treg是否参与,以及肌肉中的免疫调节分子机制尚不清楚。
2023年9月,Cell Metabolism期刊报道了一项研究,发现运动通过IL6Rα信号传导增加肌肉中Treg的驻留,并诱导其表型和功能成熟。机制上,T细胞IL6Rα缺失小鼠在运动时表现出肌肉Treg的缺陷,在肌肉损伤后表现出更明显的肌肉质量下降,以及损伤后肌肉再生受损。Treg功能的重获得可恢复受损的肌肉再生能力。药理学阻断IL6R会损害肌肉功能,解释了抗IL6R疗法的临床副作用[9]。
首先,研究者评估了肌肉驻留Treg与运动训练后肌肉功能的相关性。选取16周龄雄性C57BL/6J小鼠,研究不同肌肉纤维亚型在久坐稳定状态下的比率,包括比目鱼肌(Sol,主要是氧化肌纤维)、腓肠肌(GC,混合肌纤维)、胫前肌(TA)和趾长伸肌(EDL,主要是糖酵解肌纤维)。使用流式细胞分选(FACS)从四种不同肌肉中分离出CD4+ T细胞亚群(图一A),且Sol中Foxp3+ Treg的比率最高(图一B和C)。为解析Treg在运动训练中引导肌肉功能的作用,研究者将小鼠分为对照静息组和运动组,10天后对Sol进行基因表达分析,发现短期运动训练显著诱导了与肌肉生成相关基因的表达,包括Myf5和Myog(图一D)。此外,经典的肌细胞因子Il6以及Areg的表达在运动反应中也显著增加(图一D)。以上数据表明,短期运动可以诱导肌肉修复相关的肌源性细胞因子的表达。
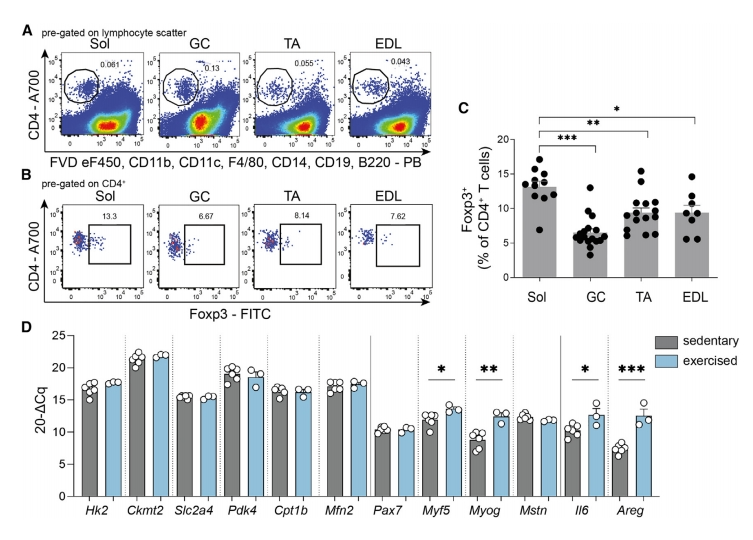
图一 骨骼肌中CD4+ T细胞和Foxp3+ Treg的鉴定以及肌肉对运动的反应[9]
接下来,研究者探索运动训练对肌肉驻留Treg数量的影响。将小鼠分为静息、运动和预运动三组(图二A),8周后从Sol和GC中分离出Treg(图二B),发现运动后Treg数量显著增加,特别是预运动组(图二C)。增殖标志物Ki67分析表明,运动终止后,预运动小鼠的Treg增殖显著增加,表明Treg在运动终止后得到维持,运动可以对肌肉Treg产生肌肉-免疫记忆效应(图二D)。研究者进一步探究运动训练是否影响Treg的表型特征和功能成熟,以支持组织稳态。发现在Sol和GC中,预运动组的Areg+ Foxp3+ Treg显著增加(图二E)。研究表明,与其他EGFR配体相比,Aregs以异常低的亲和力结合EGFR ,并对EGFR表现出不同的结合能力[10]。结果显示,运动终止后的GC中,EGFR+ Treg直接开始下降,而预运动组两块肌肉中的EGFR+ Treg显著增加(图二F)。为了解运动介导的细胞互作是否涉及Treg,分析IL-33的受体ST2,发现与静息组和运动组小鼠相比,预运动组小鼠GC中ST2+ Treg显著增加(图二G),IL6Rα表达也显著增加(图二H)。以上数据表明,运动诱导肌肉Foxp3+ Treg的表型和功能成熟,涉及Areg/EGFR/ST2和IL6Rα信号传导。
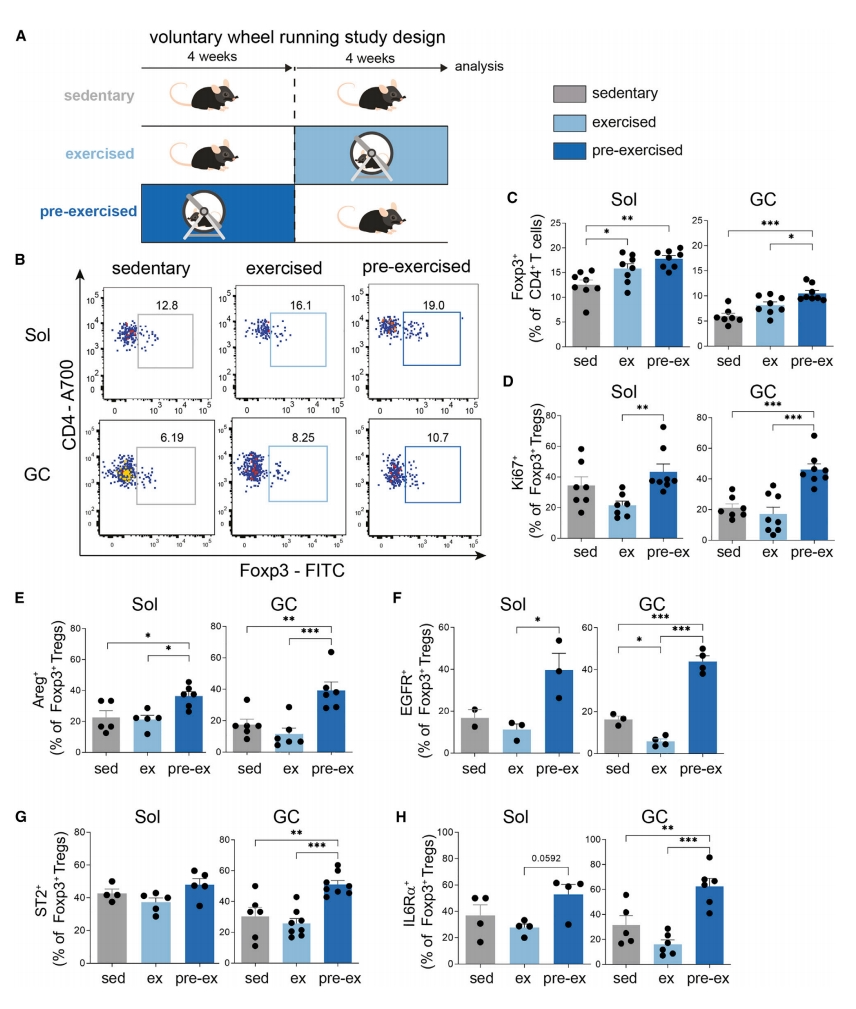
图二 运动增加肌肉中Treg比率并诱导其表型成熟[9]
考虑到肌肉Treg对运动的反应强烈而持久,研究者探索Treg是否调节肌肉基因表达作为对运动的响应。给雄性Foxp3 DTR+和对照Foxp3 DTR-小鼠注射白喉毒素(DT),导致Foxp3 DTR+小鼠肌肉中的Treg有效耗竭(图三A和B),显著降低了代谢(Hk2、Ckmt2和Cpt1b)和运动肌源性反应(Myf5和Pax7)所需的肌肉特异性基因表达(图三C),表明Treg通过控制运动相关基因的表达来指导肌肉功能。柠檬酸合酶的酶活性是评估肌肉氧化酶和呼吸能力的关键调节酶和代谢标志物。Treg耗竭导致肌肉中柠檬酸合成酶活性显著降低(图三D和E),表明肌肉功能降低。此外,还观察到Treg耗竭后肌肉横截面积减少(图三F和G),最大肌肉握力显著下降(图三H)。以上数据表明,Treg耗竭会消除对运动反应所需的肌肉特异性基因表达,损害肌肉功能,强调Treg在控制肌肉功能和运动反应能力方面具有关键作用。
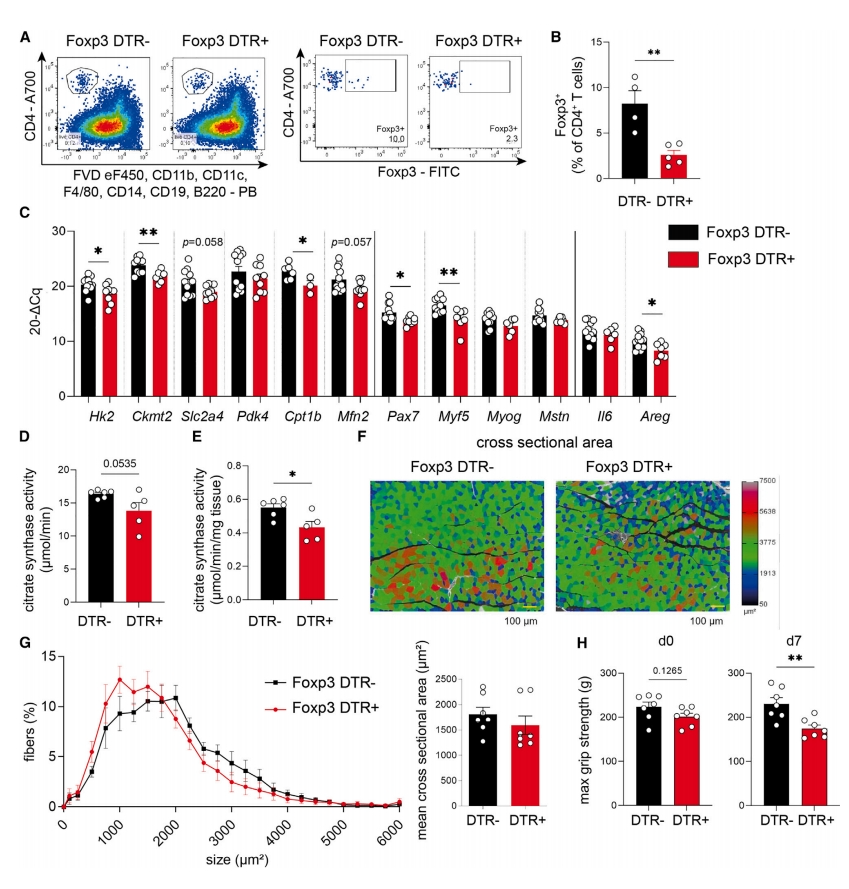
图三 Treg耗竭严重损害肌肉功能[9]
紧接着,研究者剖析运动反应中肌肉Treg与免疫互作机制,研究运动诱导的Treg增多是否由肌细胞因子Il6介导。使用骨骼肌特异性肌球蛋白轻链启动子(MLC)驱动Cre重组酶表达的Myl1 Cre小鼠和Il6 fl/fl小鼠产生肌纤维特异性IL6 KO小鼠。结果显示,运动后IL6 KO小鼠肌肉中Treg的增加与IL6对照组相似(图四A和B),表明肌肉中IL6本身的存在并不是驱动运动后肌肉Treg增加的必要条件。但是,运动确实也没有诱导IL6 KO小鼠肌肉中Treg的增殖(图四C),表明除了运动时Treg扩增外,其他机制,如Treg诱导和/或募集,也有助于运动介导的肌肉Treg增加。IL6的缺失还导致了Foxp3+ Treg中运动介导的Areg、EGFR和ST2表达上调的缺失(图四D-F)。以上数据表明,肌纤维来源的IL6参与指导肌肉组织Treg表型及其功能的上调。
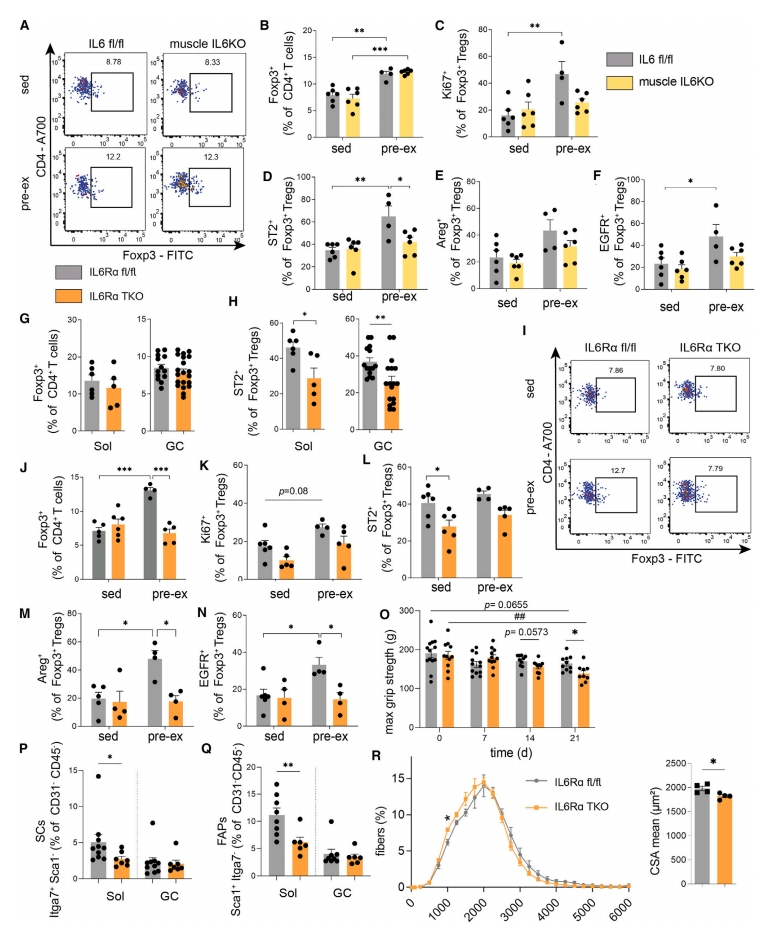
图四 IL6/IL6Rα介导的肌肉-T细胞互作在控制肌肉适应、功能和再生中具有关键作用[9]
预运动组小鼠GC肌肉Treg中的IL6Rα表达增强,因此,研究者提出T细胞上IL6Rα的表达是否是响应运动介导Treg诱导的先决条件。使用T细胞特异性缺失IL6Rα小鼠(Cd4 Cre × Il6rα fl/fl,简称IL6Rα TKO)。与对照相比,IL6Rα TKO小鼠肌肉中Foxp3+ Treg比率没有差异(图四G),但在缺失IL6Rα的T细胞中,具有组织表型的Treg显著减少(图四H),表明IL6Rα在形成肌肉Treg表型方面有作用。接下来,研究者对IL6Rα TKO和对照Il6rα fl/fl小鼠进行静息和预运动处理。结果显示,运动后的对照Il6rα fl/fl小鼠的肌肉驻留Treg显著增加,而在IL6Rα TKO小鼠中,运动介导的肌肉Treg增加完全缺失(图四I和J)。IL6Rα TKO小鼠运动后没有观察到Ki67+ Foxp3+ Treg的任何显著变化(图四K),也缺乏Areg+、EGFR+和ST2+的Foxp3+ Treg的诱导(图四L-N)。IL6Rα TKO小鼠在右聚糖硫酸钠(DSS)诱导肌肉质量损伤模型中,发现最大肌肉握力显著下降(图四O)。肌肉再生由一个动态网络组成,其中包括卫星细胞(SC)和成纤维脂肪前体细胞(FAP)。SC主要通过分化为肌纤维和自我更新来维持SC池,从而负责肌肉再生。FAP作为间充质基质细胞,在组织再生过程中支持SC的分化。发现IL6Rα TKO小鼠的Sol和GC中SC和FAP比率显著降低,特别是在SC密度最高的Sol中(图四P和Q);肌肉横截面积也显著减少(图四R)。以上数据表明,T细胞上IL6Rα的存在对于运动介导肌肉Treg的诱导及其对Areg、EGFR和ST2功能活性的增强是必需的。
鉴于上述观察,研究者对小鼠进行肌肉损伤,将甘油注射到对照或IL6Rα TKO小鼠的肌肉中(图五A)。损伤后4天进行FACS分析,显示IL6Rα TKO小鼠损伤肌肉中的SC比率显著降低(图五B和C)。损伤14天后的IL6Rα TKO小鼠的肌肉的横截面积显著减少(图五D)。以上数据表明,Treg需要IL6Rα信号来控制损伤后的肌肉再生能力。
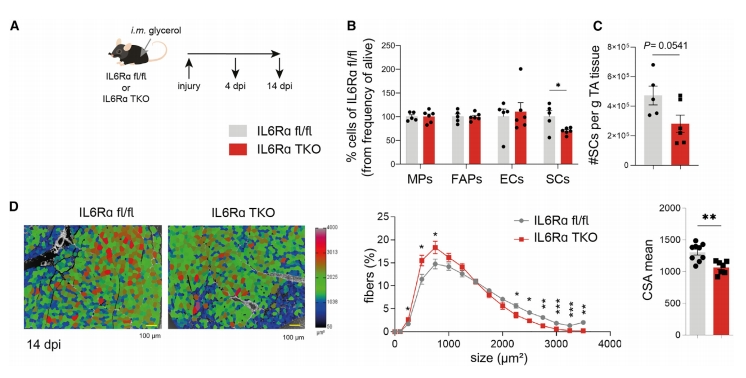
图五 T细胞特异性IL6Rα缺失小鼠的肌肉损伤再生明显受损[9]
下一步,研究者探索Foxp3 DTR小鼠中Treg的恢复是否促进肌肉功能的重新获得,使用DT耗竭Treg(图六A)。与Treg耗竭前的第0天相比,Treg耗竭导致肌肉功能显著降低,而Treg的内源性再增殖促进肌肉功能的重新获得(图六B)。研究者还在IL6Rα TKO小鼠中通过腹腔注射6 mg的抗IL2/IL2抗体复合物,进行功能获得性实验(图六C)。结果发现,注射后IL6Rα TKO小鼠的Treg显示出与对照类似的扩增动力学(图六D)。在Treg扩增14天后,IL6Rα TKO肌肉中减少的SC和FAP比率完全恢复到对照小鼠水平(图六E-G)。以上数据表明,Treg耗竭后的重新获得可恢复肌肉功能。
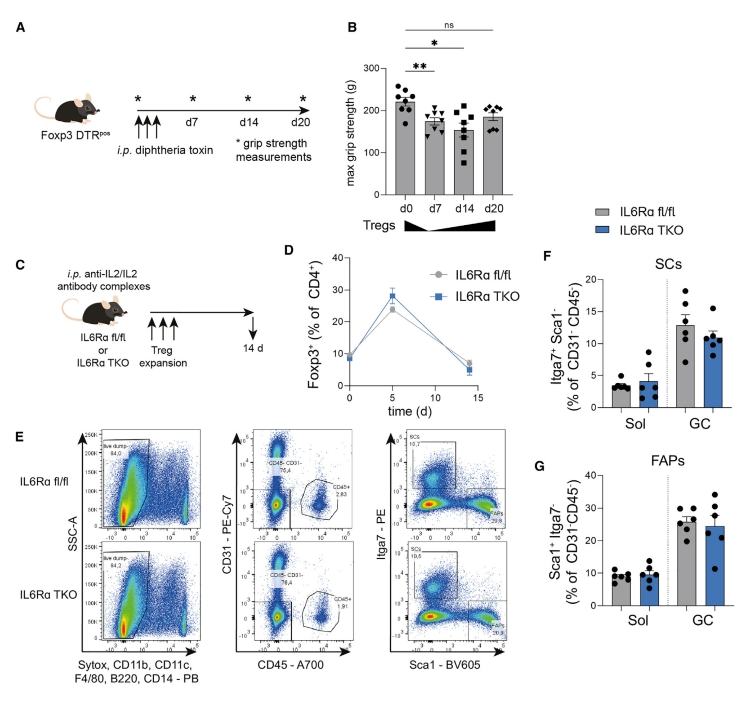
图六 使用抗IL2/IL2抗体复合物扩增Treg可恢复IL6Rα TKO小鼠的肌肉再生能力[9]
最后,鉴于上述使用IL6Rα TKO小鼠的功能模型对肌肉功能损伤的表型,研究者评估这些发现可能的临床意义。使用WT小鼠接受同型对照抗体或特异性IL6R抗体,时间疗程为4周(图七A),采用肌肉握力测试来确定每周一次可能出现的肌肉功能损伤(图七B)。在处理过程中,接受IL6R抗体的小鼠在第14天和第21天就表现出肌肉力量下降的趋势。4周后,与对照小鼠相比,接受IL6R抗体的小鼠肌肉力量下降了25%,表现出肌肉功能的显著降低。以上数据表明,靶向IL6R会损害肌肉功能。
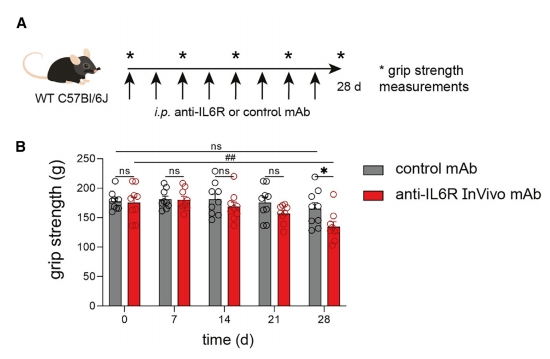
图七 药物靶向IL6R损害WT小鼠的肌肉功能[9]
综上所述,该研究通过选择性Treg耗竭、功能获得、运动训练和肌肉损伤诱导模型,确定了T细胞IL6Rα的表达是介导基于Treg的肌肉功能成熟、适应和修复的关键因素,强调了IL6Rα信号传导与肌肉-Treg互作在调控肌肉修复和再生中的重要性。T细胞特异性IL6Rα缺失小鼠在肌肉损伤时存在更显著的肌肉功能和再生能力受损,而Treg功能的获得可恢复受损的肌肉再生能力。抗IL6R抗体会损害肌肉功能,解释了抗IL6R疗法的临床副作用。该研究确定了肌肉与免疫调节之间的相关性,对未来设计精准靶向特异性Treg的药物具有重要意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hotamisligil GS: Foundations of Immunometabolism and Implications for Metabolic Health and Disease. Immunity 2017, 47(3):406-420.
2. Mattson MP, Longo VD, Harvie M: Impact of intermittent fasting on health and disease processes. Ageing research reviews 2017, 39:46-58.
3. Panduro M, Benoist C, Mathis D: T(reg) cells limit IFN-γ production to control macrophage accrual and phenotype during skeletal muscle regeneration. Proc Natl Acad Sci U S A 2018, 115(11):E2585-e2593.
4. von Boehmer H, Daniel C: Therapeutic opportunities for manipulating T(Reg) cells in autoimmunity and cancer. Nature reviews Drug discovery 2013, 12(1):51-63.
5. Burzyn D, Kuswanto W, Kolodin D, Shadrach JL, Cerletti M, Jang Y, Sefik E, Tan TG, Wagers AJ, Benoist C et al: A special population of regulatory T cells potentiates muscle repair. Cell 2013, 155(6):1282-1295.
6. Pal M, Febbraio MA, Whitham M: From cytokine to myokine: the emerging role of interleukin-6 in metabolic regulation. Immunology and cell biology 2014, 92(4):331-339.
7. Pedersen BK, Febbraio MA: Muscle as an endocrine organ: focus on muscle-derived interleukin-6. Physiol Rev 2008, 88(4):1379-1406.
8. Rose-John S: IL-6 trans-signaling via the soluble IL-6 receptor: importance for the pro-inflammatory activities of IL-6. International journal of biological sciences 2012, 8(9):1237-1247.
9. Becker M, Joseph SS, Garcia-Carrizo F, Tom RZ, Opaleva D, Serr I, Tschöp MH, Schulz TJ, Hofmann SM, Daniel C: Regulatory T cells require IL6 receptor alpha signaling to control skeletal muscle function and regeneration. Cell Metab 2023, 35(10):1736-1751.e1737.
10. Macdonald-Obermann JL, Pike LJ: Different epidermal growth factor (EGF) receptor ligands show distinct kinetics and biased or partial agonism for homodimer and heterodimer formation. The Journal of biological chemistry 2014, 289(38):26178-26188.



