技术分享:肝切除术后肝再生的血管重建机制研究
剩余肝脏体积(FLR)不足通常会导致肝切除术后肝功能衰竭(PHLF),造成手术患者的高发病率和高死亡率[1]。为减少术后并发症,已开发多种不同手术策略,其中联合肝脏分隔和门静脉结扎的二步肝切除术(ALPPS)已成功用于治疗原本不可手术切除的肝癌患者[2]。部分肝切除术(PHx)和ALPPS的术后肝功能恢复都主要依赖于肝细胞增殖,因此剩余肝脏的再生能力对于患者的生存至关重要[3]。占据肝脏质量80%的肝细胞在肝切除术后最先增殖,其次是其他肝脏细胞[3]。肝细胞能够分泌多种因子来恢复血管系统和肝小叶[3],而肝血管重建在肝脏再生中也起着至关重要的作用。肝细胞和基质细胞之间的信号传递,包括肝星状细胞(HSC)、肝窦内皮细胞(LSEC)和库普弗细胞(KC),可以协同调节肝脏的再生[4]。LSEC可以动态调节肝细胞增殖,对血管生成和血管重建也至关重要[5]。然而,肝切除术后肝血管重建的调控机制在很大程度上仍然未知,以及LSEC的增殖和功能调控机制也尚不清楚。
2023年10月,Journal of Hepatology期刊在线报道了一项肝切除术后肝再生中调控肝血管重建的机制研究,鉴定出两个关键调节因子Gata3和Ramp2。具体而言,在肝切除术后的肝再生过程中,肝细胞的Gata3下调表达和Ramp2上调表达可将原先表达色素上皮衍生因子(PEDF)转向为表达血管内皮生长因子A(VEGFA),促进肝窦内皮细胞(LSEC)增殖和肝血管重建。临床研究揭示GATA3是肝脏再生的风险因素,为预防和治疗肝切除术后肝功能衰竭(PHLF)提供了新的潜在靶点[6]。
首先,研究者探究肝细胞对肝再生中血管重建的调节作用。肝脏再生包括启动、增殖和终止阶段。在启动阶段,细胞因子如肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)和抑瘤素M(OSM),触发静止肝细胞进入增殖细胞周期(G0至G1期)[7]。在增殖阶段,肝细胞生长因子(HGF)、表皮生长因子(EGF)、肝素结合EGF(HB-EGF)和转化生长因子α(TGF-α)驱动细胞周期进入S期[8]。再生动力学显示,肝血管体积在部分肝切除术(PHx)后第5天和第7天分别恢复到原始体积的80%和90%(图一A和B)。为了中断启动和进展阶段,研究者分别将表达sgRNA的腺相关病毒8(AAV8)递送到Alb-Cre-CRISPR/CAS9小鼠中,实现肝细胞特异性地敲除OSM受体(OSMRΔHep)、TNFR(TNFRΔHep)、c-Met(MetΔHep)或EGFR(EGFRΔHep)。相比对照组,发现在PHx后的肝细胞增殖阶段(第1-3天),OSMRΔHep和MetΔHep小鼠的肝脏体积显著变小(图一C)。在血管生成期(第2-7天),OSMRΔHep和MetΔHep小鼠表现出稀疏的微血管结构(图一D),更少的CD31+(图一E)和Ki67+/ERG+细胞(图一F),以及低水平的VEGFR2和CD146(图一G)。以上数据表明,干扰肝细胞启动或进展阶段阻碍了PHx后LSEC的增殖和肝血管重建,提示肝细胞可调节肝再生过程的肝血管重建。
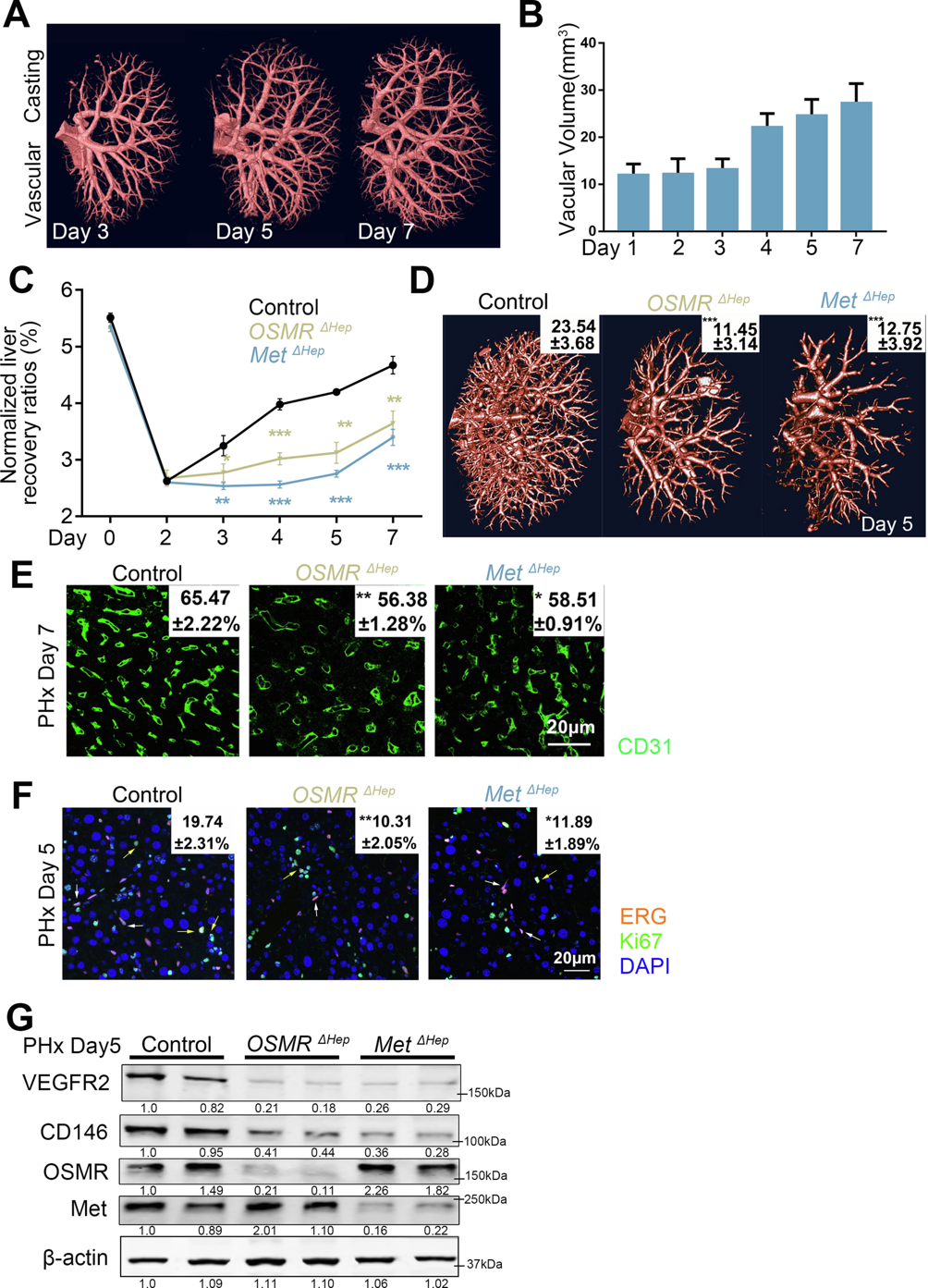
图一 肝细胞在肝再生过程中调节肝血管重建[6]
接下来,研究者探究肝细胞如何调节LSEC增殖。在PHx后12小时对三组不同的肝细胞进行RNA测序:假手术(空白组)、肝切除野生型(对照组)和肝切除MetΔHep小鼠。在对照组和空白组之间鉴定了1238个差异表达基因,其中与MetΔHep组和空白组的差异基因重叠480个,提示它们可能参与调节肝细胞增殖(图二A)。富集分析显示,除了480个重叠基因外,其余758个差异基因也与血管生成相关,共包括40个血管生成相关基因(图二B)。对这40个基因进行RT-PCR分析显示,与空白组相比,33个差异基因在PHx后第1天和第2天经历了类似的变化,包括对照组内的3个下调基因和30个上调基因。为鉴定调节LSEC增殖的候选基因,分别用表达33个差异基因的慢病毒转导小鼠AML-12肝细胞后,与LSEC共培养(图二A)。结果显示,AML-12共培养可以促进LSEC增殖和血管形成,但两者都被Ramp2的敲低或Gata3的过表达所强烈抑制(图二C)。有趣的是,在再生肝细胞中检测到Gata3和Ramp2之间的相反表达谱式(图二D)。研究者推测PHx后肝细胞的Gata3下调和Ramp2上调可能有助于肝血管重建,于是将表达Gata3 cDNA或Ramp2 sgRNA的AAV8递送到Alb-Cre-CRISPR/CAS9小鼠中,建立Gata3过表达(Gata3Hep)或Ramp2敲除(Ramp2ΔHep)小鼠。肝切除术前,对照组、Gata3Hep和Ramp2ΔHep小鼠的肝脏质量没有差异。PHx后第1-3天,所有三组小鼠的肝脏质量均稳定增加(图二E)。然而,在PHx后第4-7天,Gata3Hep或Ramp2ΔHep小鼠的肝脏质量恢复、肝脏微血管和血管体积显著降低(图二E-G),Ki67+/LYVE1+显著减少(图二H)。以上数据表明,Gata3和Ramp2在肝细胞中分别作为血管生成抑制剂和激活剂,促进LSEC的增殖和肝血管重建。
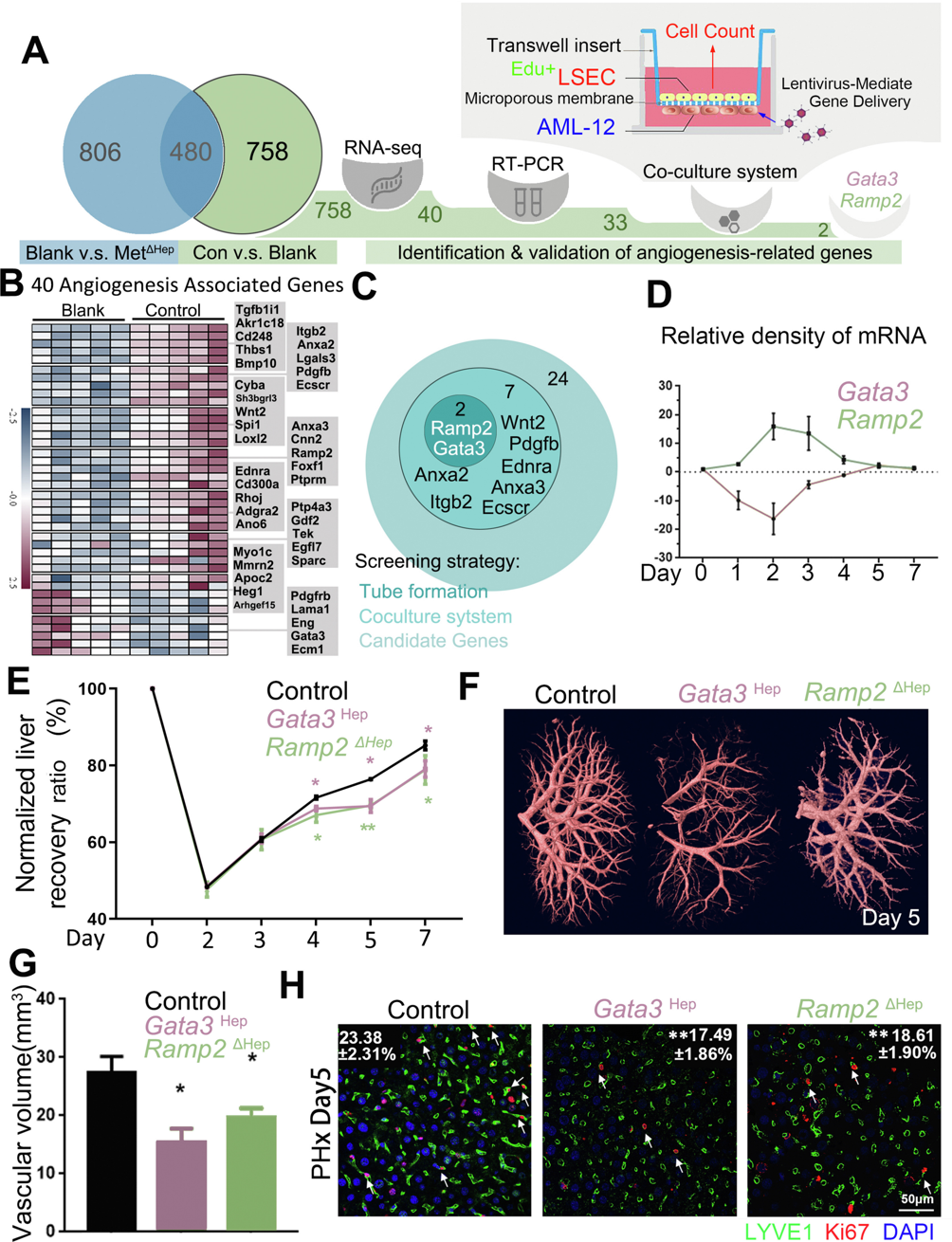
图二 肝细胞Gata3和Ramp2的相反表达调节肝再生中LSEC增殖和血管形成[6]
研究者进一步阐明Gata3和Ramp2如何调节肝血管重建,在PHx后48小时收集门静脉血清,以确定候选的促血管生成因子和抗血管生成因子。在肝切除的Gata3Hep或Ramp2ΔHep小鼠中,检测到促血管生成因子包括VEGFA的水平降低,但抗血管生成因子的水平如PEDF和TGF-ꞵ1增加(图三A)。为验证这些因子是否来自肝细胞,在空白组和对照组的肝细胞、LSEC、HSC和KC中检测了它们的表达谱式,发现在PHx后第3天的肝细胞中,VEGFA表达达到峰值,而PEDF表达下降,再生肝中VEGFA和PEDF的蛋白质水平也发生了相反的变化。然而,在PHx后第2-3天,肝切除术触发的Gata3Hep或Ramp2ΔHep小鼠的表达变化被逆转(图三B),表明Gata3和Ramp2对肝血管重建的影响可能依赖于PEDF和VEGFA的改变。进一步在VEGFA敲除(VEGFAΔHep)和PEDF过表达(PEDFHep)小鼠中进行PHx。结果与Gata3Hep和Ramp2ΔHep小鼠类似,在第4-7天,两组小鼠的肝脏再生受到抑制(图三C),LSEC增殖显著减少,表现为VEGFR2和CD146蛋白水平降低(图三D),LYVE1+/Ki67+细胞(图三E)和VEGFR2+/CD34-细胞(图三F)减少。注射重组mVEGF164或PEDF中和抗体(αPEDF)可在PHx 4和7天后显著改善Gata3Hep和Ramp2ΔHep小鼠的肝脏恢复(图三G)。以上数据表明,肝细胞内Gata3和Ramp2的相反变化通过将PEDF表达转向VEGFA表达促进肝血管重建。
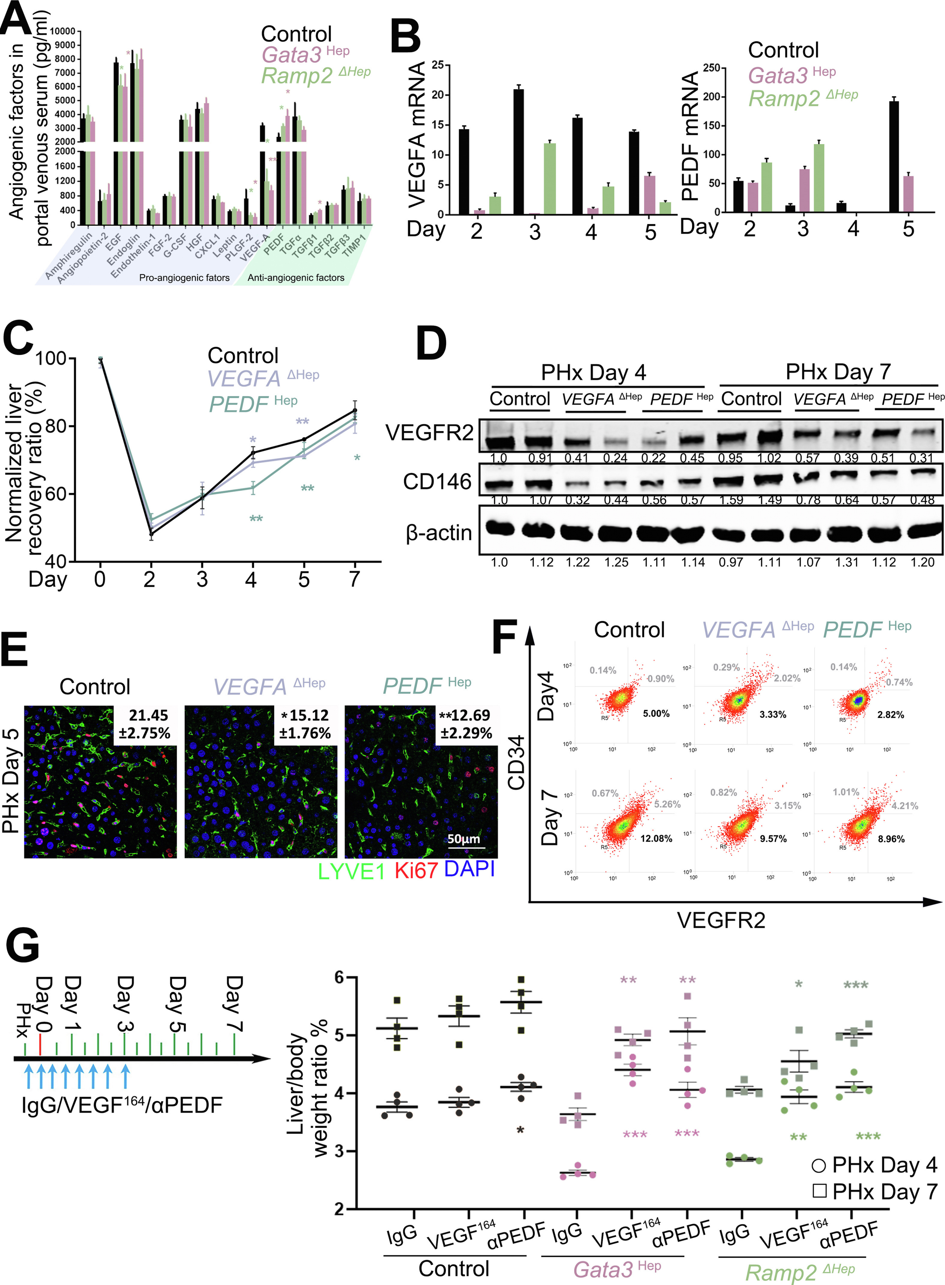
图三 Gata3和Ramp2通过在肝再生早期改变PEDF和VEGFA的平衡来调控LSEC增殖[6]
VEGFA可以快速刺激LSEC增殖[9]。在小鼠肝再生中,VEGFA和PEDF的表达在第3天发生变化,LSEC增殖在第5天达到峰值(图四A)。骨髓来源的LSEC祖细胞(BM-SPC)是LSEC的主要来源。研究者探究VEGFA和PEDF在这一过程中的作用,对VEGFAΔHep和PEDFHep小鼠进行辐照,并用来自GFP小鼠的BM移植(GFP-BM),两周后,受体小鼠均接受PHx(图四B)。PHx后第3-5天,在VEGFAΔHep或PEDFHep肝脏中检测到较少的GFP+-BM(图四C-D),表明VEGFA和PEDF在肝再生过程中对骨髓移植产生相反的影响。CD133+-BM细胞具有与BM-SPC相似的表型,可参与正常的肝脏再生[10]。研究者将来自GFP小鼠的CD133+-BM细胞(GFP-CD133+-BM)与来自WT小鼠的CD133--BM细胞1:1均匀混合,移植到辐照后的受体小鼠,并在两周后进行PHx(图四E)。PHx后第2-3天,发现移植的GFP-CD133+-BM接近受体肝脏中的LYVE1+细胞,并且主要在第5天检测到它们的共定位(图四F)。PHx后,VEGFAΔHep或PEDFHep受体小鼠肝脏中的GFP-CD133+-BM显著减少(图四G),但外周血中GFP-CD133+-BM在第2和第3天先减少,在第4和第5天增加(图四H),表明CD133+-SPC在VEGFAΔHep或PEDFHep受体小鼠中的植入和分化受到抑制,导致CD133+-SPC在外周血中的积累。以上数据表明,在PHx后,VEGFA的增加和PEDF的减少是BM-SPC向肝脏循环动员和移植以及向LSEC分化所必需的(图四I)。
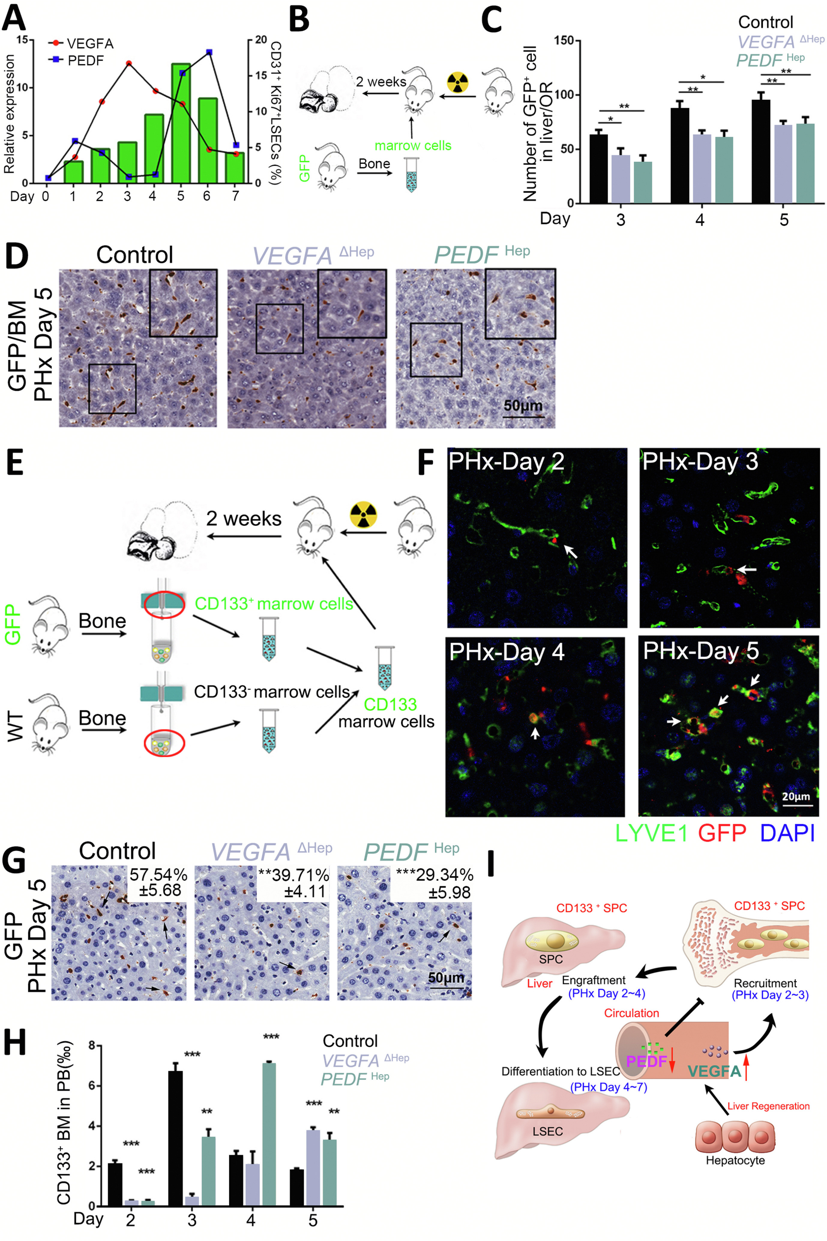
图四 VEGFA和PEDF反向调节内皮祖细胞向再生肝的募集[6]
接下来,研究者探究Gata3和Ramp2在ALPPS引起的肝脏再生中如何发挥作用。ALPPS是一种新的二步肝切除术,通过加速肝脏再生以增加肿瘤切除的限度。ALPPS和PHx的术后恢复在很大程度上依赖于肝脏再生能力。根据之前的研究[11],研究者对小鼠进行ALPPS,观测到HNF4α+/Ki67+细胞比例在I期手术后的第3天达到峰值,而LYVE1+/Ki67+细胞在第5天达到峰值,这证实了ALPPS小鼠肝细胞的增殖先于LSEC的增殖(图五A)。值得注意的是,Gata3在I期手术后第3天显著下调,而Ramp2在第5天显著上调(图五B)。随后研究者评估它们在这一过程中的作用,在Gata3Hep和Ramp2ΔHep小鼠中进行ALPPS。在II期手术阶段(第3天至第9天),Gata3Hep和Ramp2ΔHep ALPPS小鼠的剩余肝脏体积与体重的比值(RLV-BWR)显著降低(图五C),LYVE1+/Ki67+细胞的比例显著降低(图五D和E)。3D超声分析证实,在I期手术后第5天,Gata3Hep和Ramp2ΔHep ALPPS小鼠的肝脏体积显著减少(图五F)。此外,ALPPS-WT小鼠I期手术后检测到PEDF下调和VEGFA上调,而ALPPS-Gata3Hep和Ramp2ΔHep小鼠中的表达变化趋势被逆转(图五G)。预注射VEGF164或αPEDF使得ALPPS-Gata3Hep和Ramp2ΔHep小鼠的肝脏重量在第5天和第9天显著增加(图五H),表明Gata3和Ramp2也在ALPPS后的肝脏再生中发挥作用。
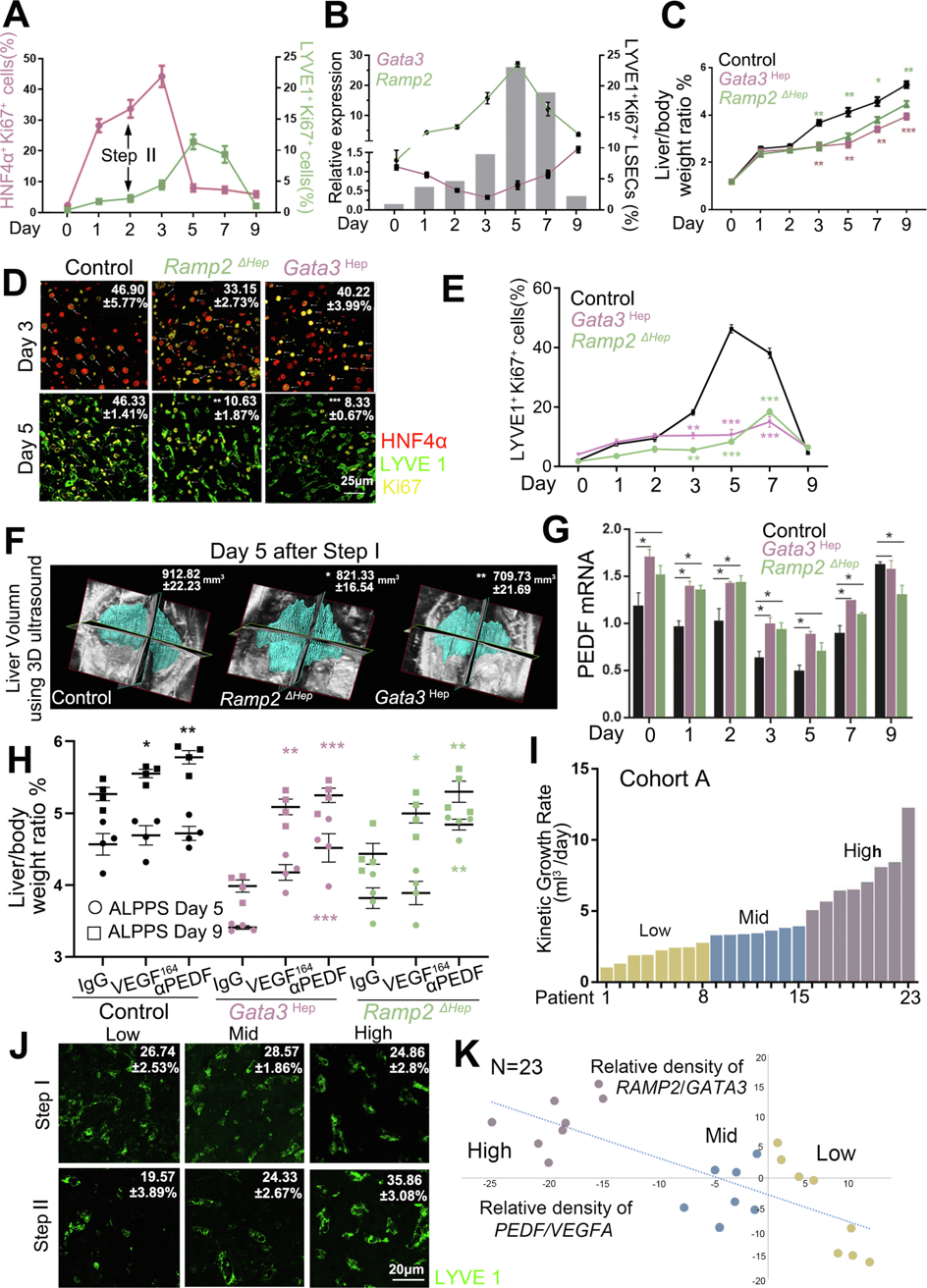
图五 Gata3和Ramp2通过改变PEDF和VEGFA的平衡在ALPPS引起的肝脏再生中发挥作用[6]
为评估这四种关键分子与病人ALPPS的相关性,研究者对23名接受ALPPS的患者进行回顾性分析。根据ALPPS两期手术之间标准化剩余肝脏体积(sFLR)的增加,将患者分为低、中、高再生组(图五I)。三组患者的LYVE1+细胞比例也相应表现为低、中、高(图五J)。三组患者的基线年龄、肝炎和肝硬化无显著差异,每个基因的水平与术后肝脏体积之间没有检测到相关性。然而,在高再生组和低再生组中,RAMP2/GATA3比值与sFLR生长率呈正相关,但中再生组数据不符合趋势(图五K)。相反,在高再生组和低再生组中,PEDF/VEGFA比值与sFLR生长速率呈负相关(图五K)。以上数据表明,ALPPS患者的RAMP2/GATA3和PEDF/VEGFA比值与sFLR生长率部分相关,提示它们在预测术后肝脏恢复能力中的作用。
实验显示,ALPPS-Gata3Hep小鼠在II期手术后表现出术后死亡率增加,高达60%(图六A),并伴有肝衰竭(PHLF),死亡前24小时内转氨酶下降和胆红素上升(图六B)。由于肝衰竭通常发生在ALPPS的II期,暴发性肝衰竭可能是ALPPS-Gata3Hep小鼠高死亡率的原因。通过αPEDF预处理,ALPPS-Gata3Hep小鼠的总生存率得到大大提高(图六A),并且它们的RLV-BWR在I期手术后第5和第9天恢复(图五H)。研究者进一步将28名接受肝切除术患者的肝细胞体外3D培养获得人类肝脏类器官,并取出上清培养基用于刺激人脐静脉内皮细胞(HUVEC,图六C)。根据GATA3的表达,将类器官分为GATA3High、GATA3Int和GATA3Low三组(图六D)。临床发现,GATA3High组(n=8)的4名患者和GATA3Int组(n=11)的1名患者出现PHLF,但在GATA3Low组(n=9)中没有出现(图六D),表明GATA3High组的PHLF风险相对较高。与GATA3Low组的类器官相比,来自GATA3High组或GATA3Int组类器官的上清培养基抑制了HUVEC的扩增(图六E)和血管形成(图六F和G)。而添加GATA3抑制剂K-7174可逆转这种抑制作用(图六F和G)。以上数据表明,肝细胞GATA3的高表达与内皮功能受损有关,可提示发生PHLF的高风险。
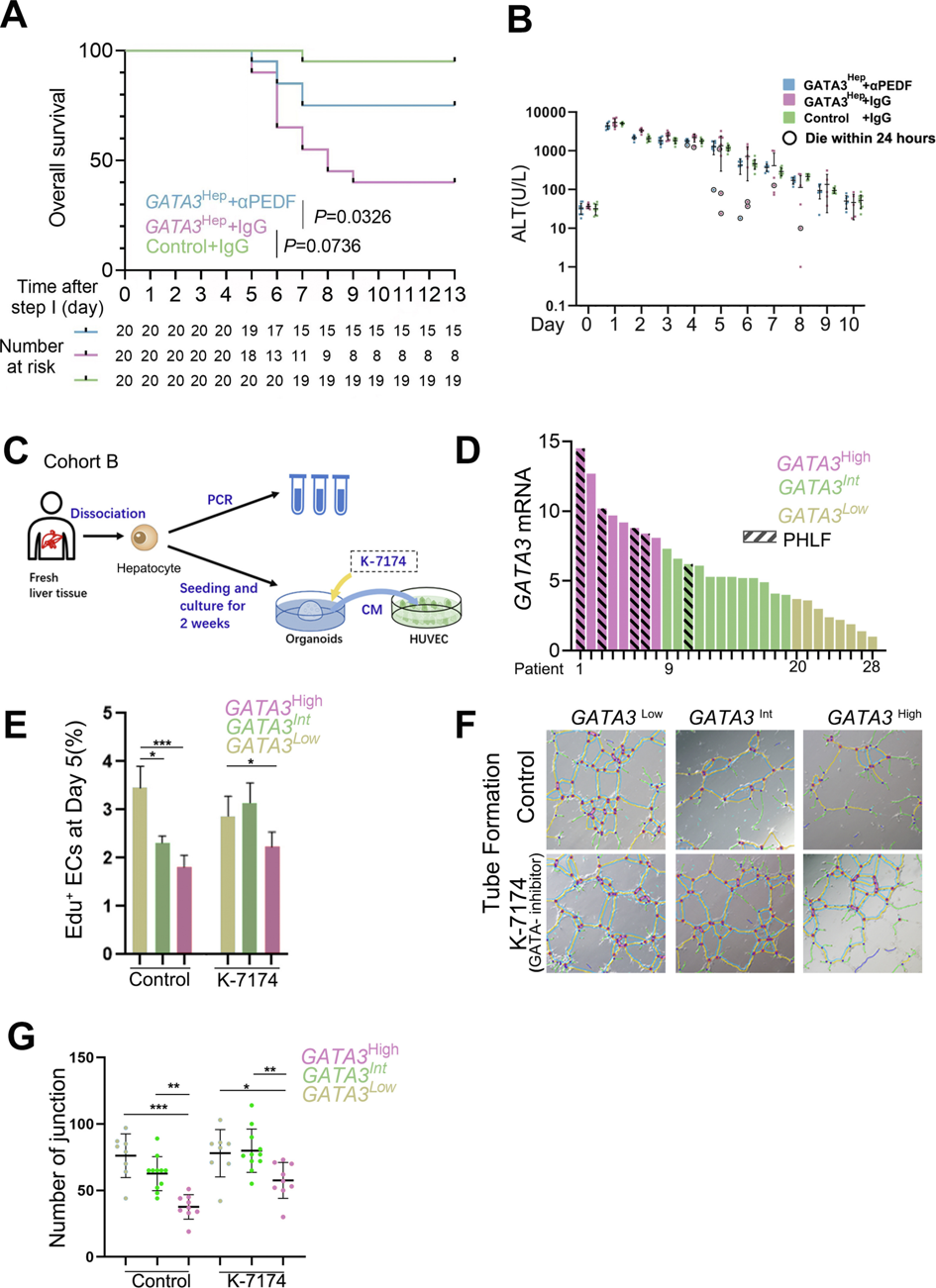
图六 GATA3是肝脏再生的风险因素[6]
综上所述,该研究阐明了肝切除术后肝脏再生过程中肝细胞调节血管重建的机制。Gata3和Ramp2分别是肝血管重建的抑制剂和激活剂,两者之前的平衡通过在肝再生过程中将PEDF表达转向VEGFA表达来调节LSEC增殖和肝血管重建;PEDF和VEGFA平衡的改变促进BM-SPC的动员和植入再生肝脏,从而促进肝血管重建(图七)。GATA3的表达与术后死亡率和肝衰竭的增加相关,提示它是不利于肝再生的风险因素,是治疗PHLF的一个潜在靶点。此外,研究者发现在接受ALPPS手术的患者中,GATA3/RAMP和PEDF/VEGFA比值与肝再生呈负相关性,由此构建了一个包含血清PEDF/VEGF指数(SPVI)等多种因素的列线图模型,可用于有效预测PHLF的风险。该研究鉴定出可预测肝切除患者PHLF的生物标志物,为预防和治疗PHLF提供了新的潜在靶点。
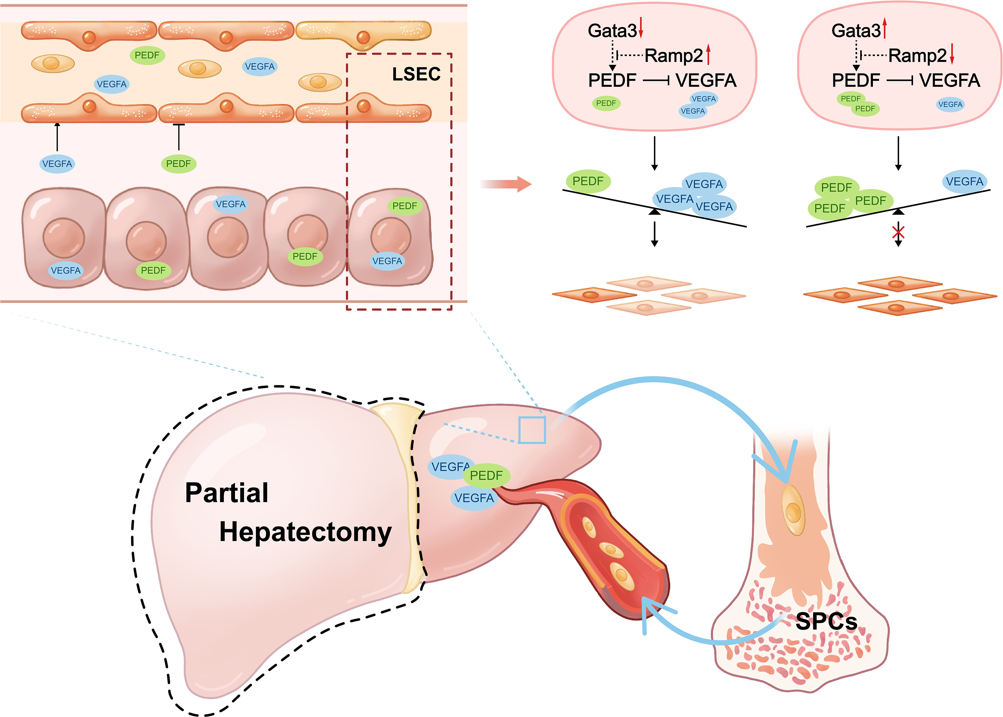
图七 肝脏再生过程中肝细胞调节肝血管重建的机制[6]

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献:
1. Adam R, Karam V, Delvart V, O'Grady J, Mirza D, Klempnauer J, Castaing D, Neuhaus P, Jamieson N, Salizzoni M et al: Evolution of indications and results of liver transplantation in Europe. A report from the European Liver Transplant Registry (ELTR). J Hepatol 2012, 57(3):675-688.
2. Boggi U, Napoli N, Kauffmann EF, Presti GL, Moglia A: Laparoscopic Microwave Liver Ablation and Portal Vein Ligation: An Alternative Approach to the Conventional ALPPS Procedure in Hilar Cholangiocarcinoma. Annals of surgical oncology 2016, 23(Suppl 5):884.
3. Michalopoulos GK, Bhushan B: Liver regeneration: biological and pathological mechanisms and implications. Nature reviews Gastroenterology & hepatology 2021, 18(1):40-55.
4. Forbes SJ, Rosenthal N: Preparing the ground for tissue regeneration: from mechanism to therapy. Nature medicine 2014, 20(8):857-869.
5. Hu J, Srivastava K, Wieland M, Runge A, Mogler C, Besemfelder E, Terhardt D, Vogel MJ, Cao L, Korn C et al: Endothelial cell-derived angiopoietin-2 controls liver regeneration as a spatiotemporal rheostat. Science 2014, 343(6169):416-419.
6. Bibo W, Hao S, Yating W, Fucheng L, Yuan Y, Han Y, Jing F, Ting Y, Hui D, Ying X et al: Balance of Gata3 and Ramp2 in hepatocytes regulates hepatic vascular reconstitution in postoperative liver regeneration. J Hepatol 2023.
7. Yamaguchi Y, Shiraki K, Saitou Y, Nakano T, Mizuno S, Uemoto S: Tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) during liver regeneration. J Hepatol 2004, 40(4):718-719.
8. Rizvi F, Everton E, Smith AR, Liu H, Osota E, Beattie M, Tam Y, Pardi N, Weissman D, Gouon-Evans V: Murine liver repair via transient activation of regenerative pathways in hepatocytes using lipid nanoparticle-complexed nucleoside-modified mRNA. Nature communications 2021, 12(1):613.
9. DeLeve LD, Wang X, Wang L: VEGF-sdf1 recruitment of CXCR7+ bone marrow progenitors of liver sinusoidal endothelial cells promotes rat liver regeneration. American journal of physiology Gastrointestinal and liver physiology 2016, 310(9):G739-746.
10. Liu WH, Ren LN, Wang T, Navarro-Alvarez N, Tang LJ: The Involving Roles of Intrahepatic and Extrahepatic Stem/Progenitor Cells (SPCs) to Liver Regeneration. International journal of biological sciences 2016, 12(8):954-963.
11. Langiewicz M, Schlegel A, Saponara E, Linecker M, Borger P, Graf R, Humar B, Clavien PA: Hedgehog pathway mediates early acceleration of liver regeneration induced by a novel two-staged hepatectomy in mice. J Hepatol 2017, 66(3):560-570.



