技术分享:遗传谱系示踪揭示妊娠期肝细胞增殖的时空动态
肝细胞增殖是肝脏稳态维持和再生过程中产生新生肝细胞的主要机制[1]。在妊娠期间,母体肝脏会显著增大,以适应各种生理变化[2]。然而,在整个妊娠期间,驱动肝脏生长的细胞来源仍不清楚,争论点在于妊娠诱导肝脏生长的原因到底是肝细胞增殖(细胞分裂)还是肥大(细胞增大)。先前研究通常使用细胞增殖标记物Ki67的免疫染色来识别细胞增殖。但是,正在经历多倍体化的肝细胞也表达Ki67,因此Ki67染色无法区分肝细胞分裂和多倍体化。因肝小叶中的肝细胞表现出异质性,可将肝小叶分成3个不同区域[3]。现已确定zone 1和zone 3肝细胞的特异性标志物,进而可以使用谱系示踪工具研究其细胞命运。目前仍缺乏zone 2肝细胞的特异性标志物,阻碍了人们对zone 2肝细胞的谱系示踪与操纵。最近研究表明,zone 2肝细胞是肝脏稳态维持和再生过程中新生肝细胞的主要来源[4]。然而,目前尚不清楚妊娠期间哪个区域的细胞来源对新生肝细胞的贡献最大,以及不同区域肝细胞的增殖动态。
2023年11月,Cell Stem Cell期刊报道了一项使用细胞增殖示踪系统ProTracer示踪妊娠期间肝细胞增殖的时空动态研究。研究发现妊娠期间肝细胞增殖从zone 1开始,然后转移到zone 2,最后到zone 3,其中zone 2肝细胞的增殖是肝脏增大的主要细胞来源。研究还发现Ccnd1在zone 2肝细胞中高度富集,Ccnd1+肝细胞在妊娠期出现优势扩增,并且妊娠期雌激素诱导的zone 2肝细胞增殖依赖于Ccnd1[5]。
首先,研究者使用ProTracer系统示踪妊娠期间新生肝细胞的来源,使用腺相关病毒AAV8-TBG-Dre(AAV8-Dre)提前激活肝细胞中的ProTracer,通过观察GFP荧光来监测肝细胞增殖(图一A)。并且在妊娠期间的不同时间点收集肝脏样本(图一B)。发现与之前的研究一致[6],妊娠期间的肝脏明显增大(图一C和D)。为研究妊娠期肝细胞的增殖动态,使用GFP、zone 1肝细胞标志物E-CAD、zone 3肝细胞标记物谷氨酰胺合成酶(GS)和细胞边界标志物β-catenin对肝切片进行免疫染色(图一E)。结果显示,GFP+肝细胞在妊娠前的肝脏中很少见,但从Preg 9.5到18.5期间逐渐增多(图一E)。在Preg 9.5时,GFP+肝细胞主要分布在zone 1和zone 2,其中zone 1比例更高;在Preg 12.5时,zone 1和zone 2的GFP+肝细胞都显著增加,zone 2的百分比与zone 1相似,zone 3的GFP+肝细胞仍然最少;在Preg 16.5和18.5时,zone 2的GFP+肝细胞进一步增加,超过了zone 1和zone 3的GFP+肝细胞显著增加(图一E和F)。以上数据表明从妊娠早期到晚期,肝细胞增殖从zone 1/2转移到zone 2/3,并且zone 2肝细胞的增殖在妊娠期间对肝脏生长的贡献最大(图一G和H)。
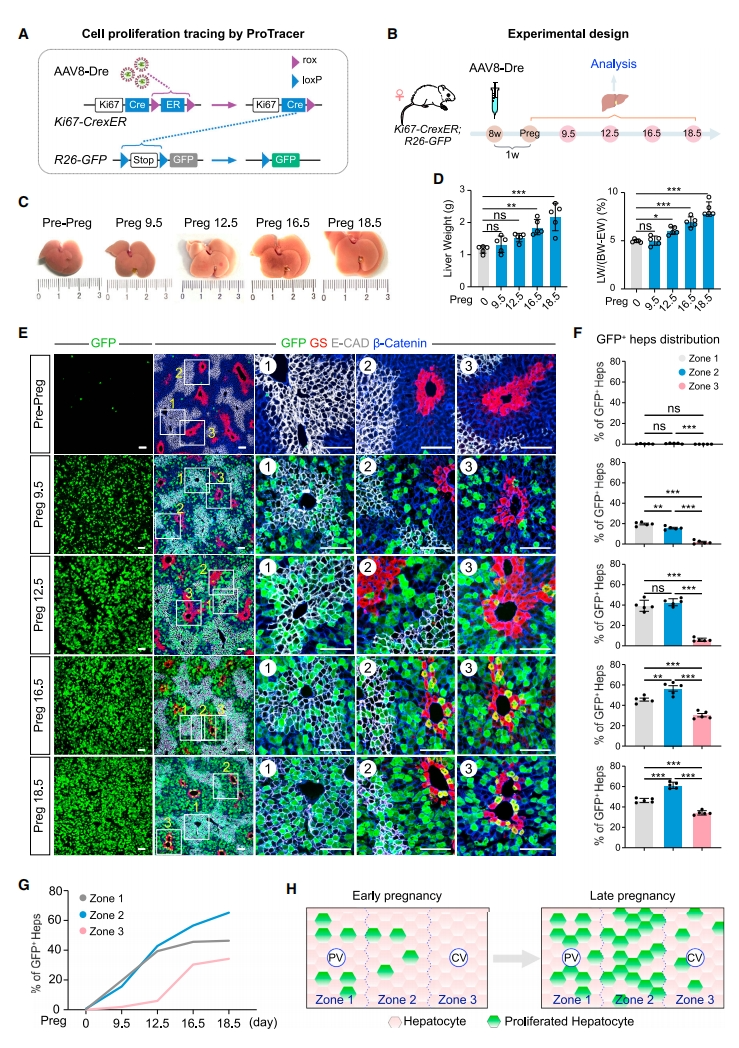
图一 ProTracer揭示妊娠期间肝细胞增殖的时空动态[5]
接下来,研究者探究ProTracer标记的GFP+肝细胞在妊娠期间经历细胞分裂或者多倍体化的情况。使用低剂量的AAV8-Dre提前标记Ki67+肝细胞,并收集Preg 18.5孕鼠肝脏进行分析(图二A)。成对出现的GFP+肝细胞可指示细胞分裂,单个GFP+细胞可指示曾经表达Ki67的细胞多倍体化。为精准检测肝细胞分裂和多倍体化,研究者在厚度为50-100 μm肝脏切片上获得不同聚焦深度的连续图像,创建共聚焦3D成像(图二B)。结果显示,大多数GFP+肝细胞成对出现(图二C和D)。定量分析表明,超过90%的GFP+肝细胞形成的细胞簇包含2个及以上的细胞,而只有不到10%的GFP+肝细胞是单细胞(图二E)。使用更低剂量的AAV进一步证实了这些结果(图二F)。为研究细胞肥大对妊娠期肝脏生长的影响,研究者使用R26-LSL-MtdT小鼠标记肝细胞的细胞膜,比较妊娠前和Preg 18.5母鼠的肝细胞体积。对300 μm的肝脏切片进行组织透明化处理,并进行E-CAD和GS免疫染色,使用双光子显微镜拍摄2D连续图像,创建3D成像来精确测量肝细胞体积(图二G)。定量数据显示,妊娠后所有3个肝区的肝细胞体积都显著增加,与妊娠前和Preg 18.5组的zone 1和zone 3肝细胞相比,zone 2肝细胞的体积都更大些(图二H)。以上数据表明,细胞分裂和细胞肥大在妊娠期的肝脏生长中均起着重要作用。
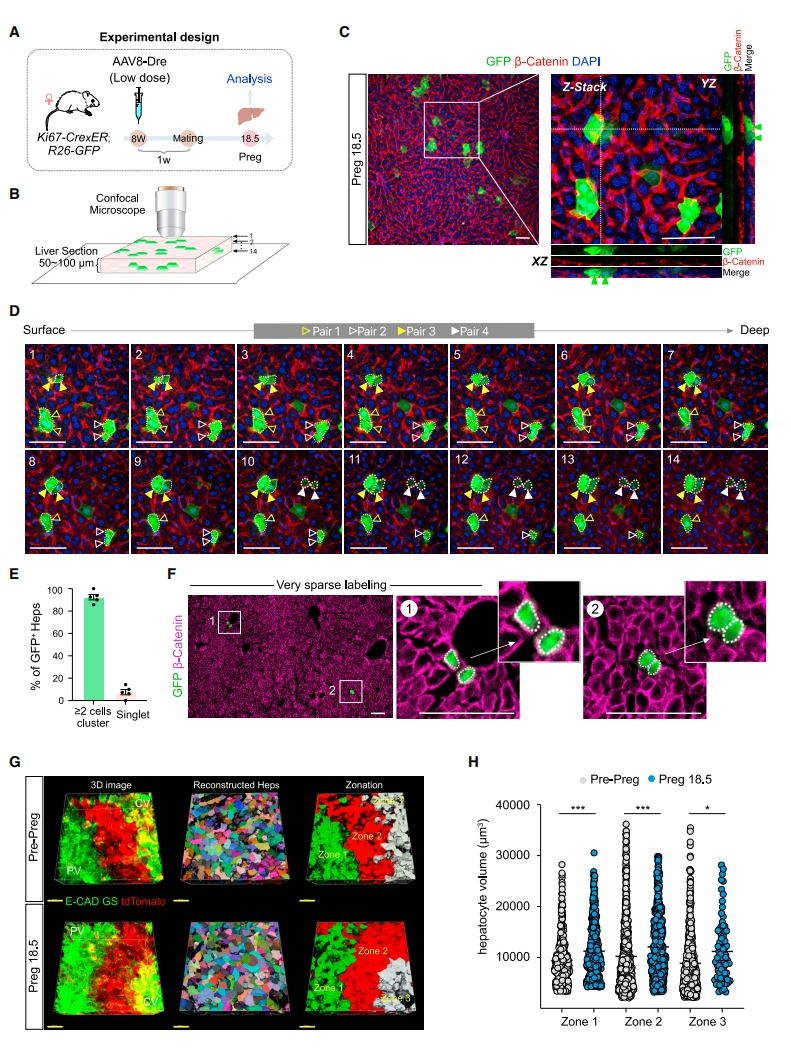
图二 肝细胞在妊娠期间同时存在细胞分裂和细胞肥大[5]
随后,研究者鉴定在zone 2肝细胞中特异性表达的基因,将8周龄小鼠的肝细胞进行单细胞RNA测序(scRNA-seq),发现Ccnd1的表达高度局限于zone 2肝细胞。进而利用Ccnd1-RSR-CreER小鼠开发了一种双重组酶介导的遗传策略来示踪定位zone 2肝细胞(图三A)。通过将该小鼠品系与Alb-DreER和R26-tdTomato品系杂交,获得Alb-DreER;Ccnd1-RSR-CreER;R26-tdTomato小鼠,使得对Alb+ Ccnd1+肝细胞进行特异性tdTomato标记(图三B)。用他莫昔芬处理小鼠发现tdTomato标记的肝细胞呈环状,主要分布在zone 2(图三C-E),表明Alb-DreER;Ccnd1-RSR-CreER;R26-tdTomato小鼠可用于准确示踪zone 2肝细胞。于是,研究者用该小鼠示踪妊娠期间zone 2肝细胞,他莫昔芬处理小鼠4周后开始交配,并收集妊娠前和Preg 18.5母鼠肝脏(图三F)。tdTomato、E-CAD和GS的肝切片免疫染色显示,Preg 18.5时tdTomato+肝细胞明显扩增(图三G和H)。定量分析显示,tdTomato+细胞面积的比例从妊娠前的49.81±1.14%增加到Preg 18.5的60.77±1.32%(图三I),数量从1003±223.40增加到2603±85.43(图三J)。以上数据表明,妊娠期间zone 2肝细胞的优势扩增对孕鼠肝脏增大的重要贡献(图三K)。
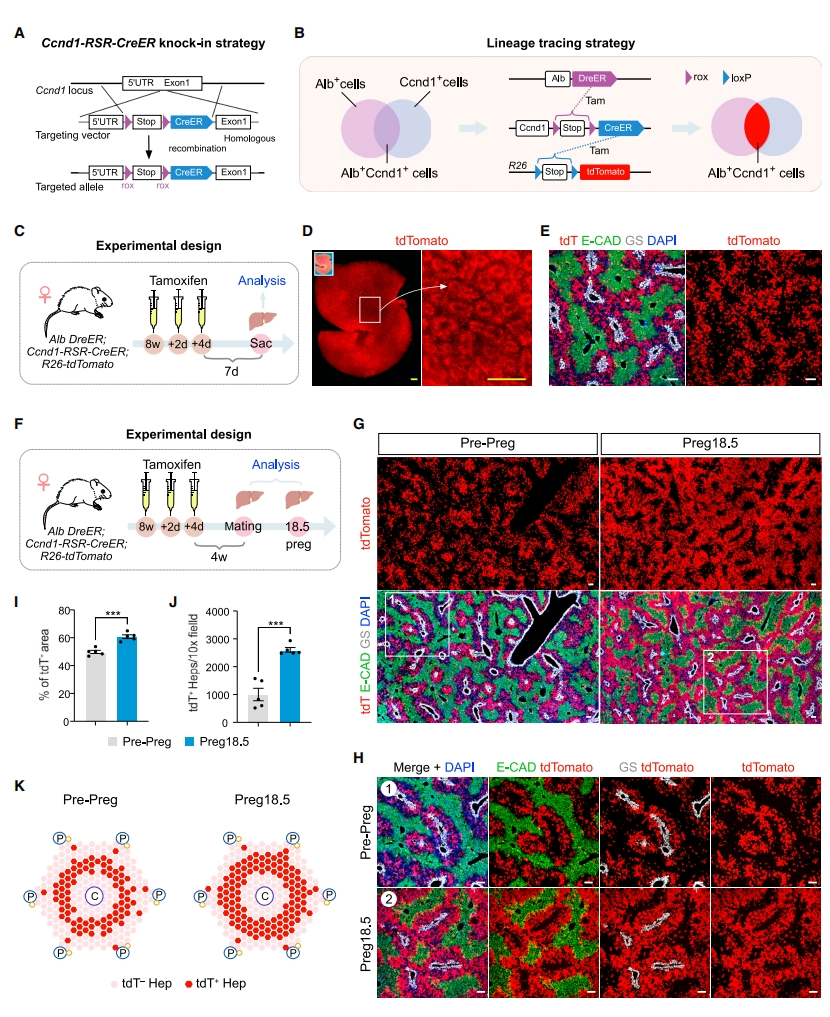
图三Ccnd1+ zone 2肝细胞在妊娠期间优势扩增[5]
妊娠会引发各种生理变化,包括性激素水平的升高。先前研究表明,雌激素等可以促进肝细胞增殖[7]。为了研究雌激素在妊娠诱导的肝脏增大和肝细胞增殖中的具体作用,研究者测量了妊娠前和妊娠期间的血浆雌二醇(E2)水平,发现妊娠后血浆E2浓度逐渐显著增加(图四A)。为探究雌激素是否会促进肝细胞增殖,研究者用E2或者联合雌激素受体拮抗剂AZD9496(AZD)处理雌性ProTracer小鼠,使用玉米油和单独AZD作为对照组,7天后采集肝脏样本进行分析(图四B)。发现与对照组相比,E2处理组的肝脏大小、肝脏重量与体重的比值、GFP+增殖肝细胞的数量均显著增加(图四C-E)。免疫染色和定量数据进一步显示,显著增加的GFP+细胞主要定位于zone 2肝细胞(图四F和G)。有趣的是,雌激素受体ERa在所有肝细胞中都有表达,没有出现区域偏好性(图四H)。以上数据表明雌激素优先诱导zone 2肝细胞的增殖。
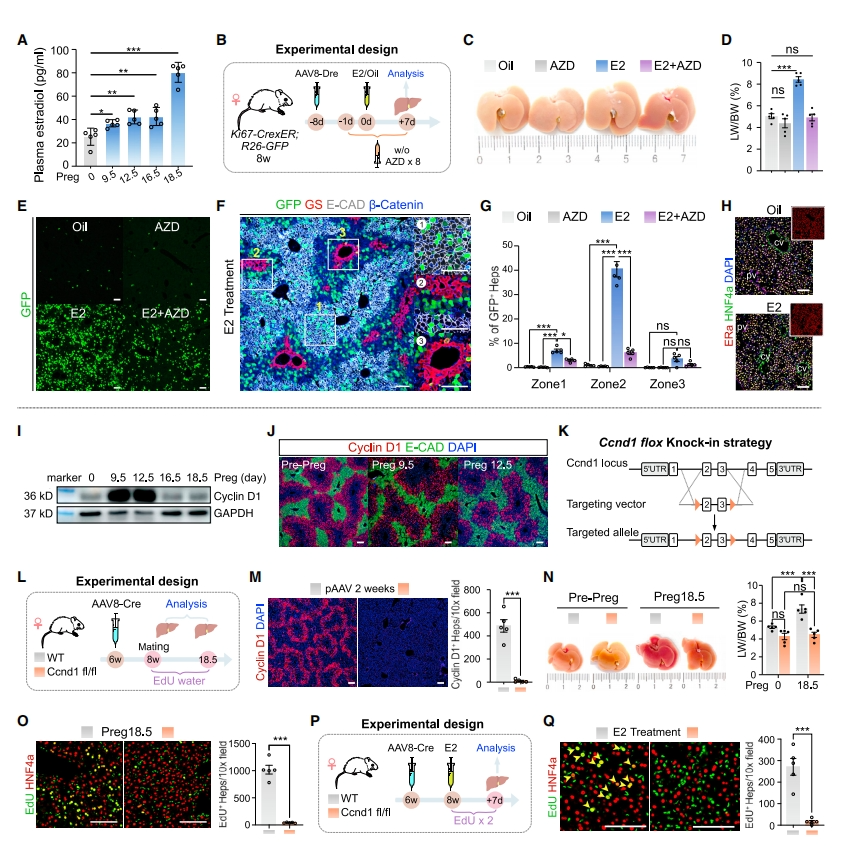
图四 妊娠期雌激素诱导zone 2肝细胞的增殖依赖于Ccnd1[5]
先前研究表明Ccnd1在zone 2肝细胞稳态和增殖中具有关键作用[8]。最后,研究者探索Ccnd1在妊娠期的作用。蛋白质印迹分析显示,在Preg 9.5和Preg 12.5时Ccnd1编码的细胞周期蛋白D1(Cyclin D1)的表达增加(图四I),并且始终富集表达在zone 2肝细胞中(图四J)。由于zone 2肝细胞增殖主要发生在Preg 9.5和Preg 16.5之间(图一E-G),研究者推测妊娠期zone 2肝细胞增殖可能依赖于Cyclin D1的表达。为验证这一假设,研究者构建了Ccnd1 flox小鼠(图四K),注射AAV8-TBG-Cre(AAV8-Cre)来特异性敲除肝细胞的Ccnd1(图四L和M)。发现肝细胞特异敲除Ccnd1后,妊娠引起的肝脏增大被消除(图四N)。在妊娠期间掺入EdU检测肝细胞增殖,观察到Ccnd1敲除后肝细胞增殖显著减弱(图四O)。进一步探讨雌激素诱导的肝细胞增殖是否依赖于Ccnd1,研究者将E2注射到Ccnd1敲除小鼠和对照小鼠中,并检测EdU+肝细胞(图四P)。发现肝细胞特异敲除Ccnd1显著减弱了E2诱导的肝细胞增殖(图四Q)。以上数据表明,在妊娠期间,雌激素主要诱导zone 2肝细胞增殖,且这一过程依赖于Ccnd1。
综上所述,该研究使用多种独特的遗传工具小鼠来揭示妊娠期母体肝脏增大的细胞起源和调控机制。研究者利用细胞增殖示踪系统ProTracer,发现细胞分裂和细胞肥大对于妊娠期的肝脏增大都具有重要贡献。从妊娠早期到晚期,肝细胞增殖主要发生在zone 1、zone 2,最后到zone 3,并且zone 2肝细胞是妊娠期新生肝细胞的主要来源。此外,研究者发现Ccnd1在zone 2高度富集,由此开发了一种基于Ccnd1的遗传工具小鼠来示踪zone 2肝细胞,进一步揭示Ccnd1+肝细胞在妊娠期间的优势扩增,且雌激素诱导的zone 2肝细胞增殖依赖于Ccnd1。该研究建立了强有力的肝脏研究遗传工具,揭示了妊娠期间肝细胞增殖的时空动态,有助于深入描绘肝脏细胞命运和研究肝脏再生机制。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献:
1. He L, Pu W, Liu X, Zhang Z, Han M, Li Y, Huang X, Han X, Li Y, Liu K et al: Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 2021, 371(6532):eabc4346.
2. A QB, Vesco KK, Purnell JQ, Francisco M, Goddard E, Guan X, DeBarber A, Leo MC, Baetscher E, Rooney W et al: Pregnancy and weaning regulate human maternal liver size and function. Proceedings of the National Academy of Sciences of the United States of America 2021, 118(48):e2107269118.
3. Ben-Moshe S, Itzkovitz S: Spatial heterogeneity in the mammalian liver. Nature reviews Gastroenterology & hepatology 2019, 16(7):395-410.
4. Chen F, Jimenez RJ, Sharma K, Luu HY, Hsu BY, Ravindranathan A, Stohr BA, Willenbring H: Broad Distribution of Hepatocyte Proliferation in Liver Homeostasis and Regeneration. Cell stem cell 2020, 26(1):27-33.e24.
5. He S, Guo Z, Zhou M, Wang H, Zhang Z, Shi M, Li X, Yang X, He L: Spatial-temporal proliferation of hepatocytes during pregnancy revealed by genetic lineage tracing. Cell stem cell 2023, 30(11):1549-1558.e1545.
6. Goddard ET, Hill RC, Nemkov T, D'Alessandro A, Hansen KC, Maller O, Mongoue-Tchokote S, Mori M, Partridge AH, Borges VF et al: The Rodent Liver Undergoes Weaning-Induced Involution and Supports Breast Cancer Metastasis. Cancer Discov 2017, 7(2):177-187.
7. Tsugawa Y, Hiramoto M, Imai T: Estrogen induces estrogen receptor α expression and hepatocyte proliferation in late pregnancy. Biochemical and biophysical research communications 2019, 511(3):592-596.
8. Wei Y, Wang YG, Jia Y, Li L, Yoon J, Zhang S, Wang Z, Zhang Y, Zhu M, Sharma T et al: Liver homeostasis is maintained by midlobular zone 2 hepatocytes. Science 2021, 371(6532):eabb1625.



