技术分享:胎儿通过父系表达印记基因Igf2调控妊娠期母体代谢
对于哺乳动物而言,母亲与胎儿之间的关系既有合作也存在冲突。胎儿已经进化出操纵怀孕母体生理来增强胎盘营养输送的方法,但其机制尚不清楚。母亲与胎儿之间的关系在很大程度上被认为是合作的,因为互相关心彼此的健康与生存。妊娠增加了母亲的代谢需求,以满足胎儿生长和发育的营养供应[1]。然而,相比母亲提供的资源,胎儿总是寻求获得更多。但是,如果怀孕母亲对当前胎儿投入过多的资源,将可能对后续繁育造成不良影响[2]。
这种胎儿“操纵”母体生理使自身受益被认为主要是通过两种机制介导的,与胎盘形成共同进化的基因组印记和胎盘激素的产生[2, 3]。迄今为止,大多数研究表明,印记基因在调节母体通过胎盘向胎儿营养供应或胎儿反向获取资源的过程中发挥关键作用。胰岛素样生长因子2(Igf2)是一种父系表达的印记基因,母系基因拷贝通过表观遗传学机制被沉默[4]。Igf2在小鼠胎盘内分泌细胞中高表达,并且人类胎盘IGF2表达与妊娠并发症的胎儿生长改变有关[5]。然而,目前还缺乏关于胎盘基因印记或激素作为胎儿操纵母体资源的直接证据。
2023年7月,Cell Metabolism上报道了一项研究,发现父系表达印记基因Igf2控制胎盘激素的产生,对建立妊娠相关的母体胰岛素抵抗和将营养物质分配给胎儿至关重要,胎盘内分泌细胞Igf2缺失导致胎儿生长受限和低血糖。在机制上,Igf2控制蛋白质合成和细胞能量稳态,其作用依赖于胎盘内分泌细胞。这种Igf2缺失对成年子代的代谢也有长期的不良影响[6]。
首先,研究者探索胎盘Igf2,特别是来自胎盘内分泌细胞的Igf2如何调节母体资源分配。Tpbpa基因只由胎盘外锥细胞表达,随后分化为胎盘内分泌细胞,形成小鼠胎盘的内分泌区(也称为junctional zone,Jz)。由此,采用基于Cre-LoxP技术的小鼠模型,构建由Tpbpa启动子驱动Cre重组酶表达的TpbpaCre小鼠[7],证明TpbpaCre确实只在Jz表达,而在胎盘转运区(也称为labyrinth zone,Lz)、胎儿及成年期的不同组织中都没有表达(图一A)。于是,使用纯合TpbpaCre和Igf2Flox小鼠相互杂交,分别获得胎盘内分泌细胞特异性的母系遗传Igf2等位基因缺失的妊娠对照组(Igf2表达正常)和父系遗传Igf2等位基因缺失的UE实验组(Igf2表达缺失)(图一B)。实验证实UE组小鼠胎盘Jz中IGF2蛋白丰度显著降低(图一C)。胎盘Jz内分泌细胞中Igf2的缺失导致产仔数减少和胎儿生长受限(图一D-G)。然而,两组之间的胎盘重量、Jz体积和Jz细胞组成没有显著变化(图一H-J),表明胎儿生长受限不是由于胎盘形态缺陷造成的。葡萄糖是驱动胎儿生长和能量代谢的主要底物,研究者随后测量母体-胎儿葡萄糖稳态参数。与妊娠对照组相比,UE胎儿血糖显著降低了33%,体内胎盘葡萄糖清除率降低了24%(图一K-M);排除胎儿体重变化的影响,则未观察到胎儿葡萄糖积累的变化(图一N)。以上数据表明,胎盘内分泌Igf2(简称为Jz-Igf2)通过改变胎儿的葡萄糖获取来调节胎儿生长。
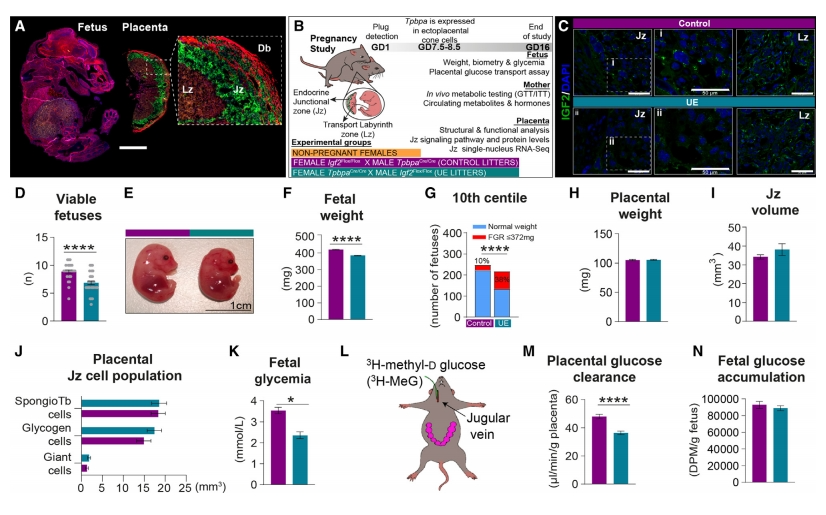
图一 胎盘内分泌细胞Igf2缺失导致胎儿低血糖和生长受限[6]
妊娠期间确保足够的葡萄糖水平输送至胎儿的一个主要机制是自然发生的短暂母体胰岛素抵抗[8]。体内代谢耐受性测试表明,相比妊娠对照组,UE组孕鼠没有出现葡萄糖不耐受和胰岛素抵抗(图二A和B),其胆固醇、甘油三酯和游离脂肪酸的循环水平也没有增加,保持在未怀孕雌鼠的相似水平(图二C–E)。母体胰岛素抵抗通常由胰腺胰岛素分泌的增加来补偿,在一定程度上是通过妊娠期间β细胞质量的增加来实现的[9]。尽管UE组孕鼠胰腺重量在妊娠期有所增加,但胰腺β细胞质量没有增加,与未怀孕雌鼠相似(图二F和G)。此外,UE组孕鼠的胰腺胰岛素含量的增加程度也较低(图二H)。肝脏是胰岛素反应器官,对全身葡萄糖和脂质代谢至关重要。相比妊娠对照组,UE组孕鼠的肝脏重量没有增加(图二I),而肝脏中脂质代谢相关蛋白LPL和PPARs,以及被胰岛素激活的mTORC1-GβL显著增加(图二J和K)。以上数据表明,胎盘中的Jz-Igf2可调控母体的代谢适应,以支持胎儿的营养获取和生长,其缺失会导致妊娠母体的胰岛素抵抗受损。
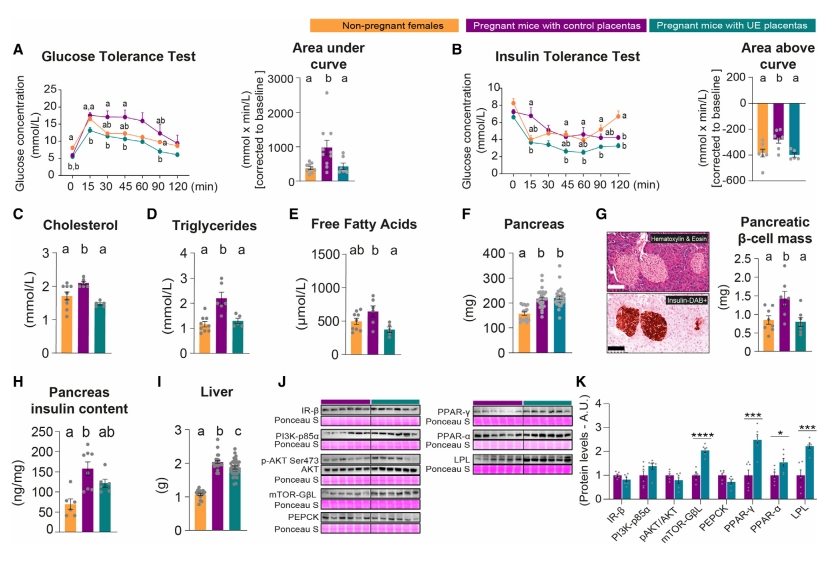
图二 胎盘Jz-Igf2缺失导致妊娠母体胰岛素抵抗受损[6]
随后,研究者分析导致UE组孕鼠胰岛素抵抗受损的机制。对妊娠第16天孕鼠血浆的循环激素水平进行LC-MS/MS分析,发现妊娠对照组和UE组孕鼠之间的IGF2浓度没有显著差异(图三A),但UE组孕鼠的循环雌二醇与孕酮的比值更大(图三B),表明类固醇激素的产生受到干扰。根据蛋白质组学分析在孕鼠血浆中检测到的180种蛋白质中可靠量化的80种蛋白质的总体特征,观察到妊娠状态不同的样本之间存在明显的分离,与妊娠对照组相比,UE组孕鼠之间的聚类差异更少(图三C-E)。表达差异蛋白中(图三E),与妊娠对照组相比,UE组孕鼠的两种蛋白质显著减少,包括与脂质水平相关的激肽抑制素和在代谢调节中发挥作用的催乳素(图三F和G)。以上数据表明,母体循环的多种蛋白质/激素水平受胎盘Jz-Igf2直接或间接调控,并可能驱动母体的代谢变化。
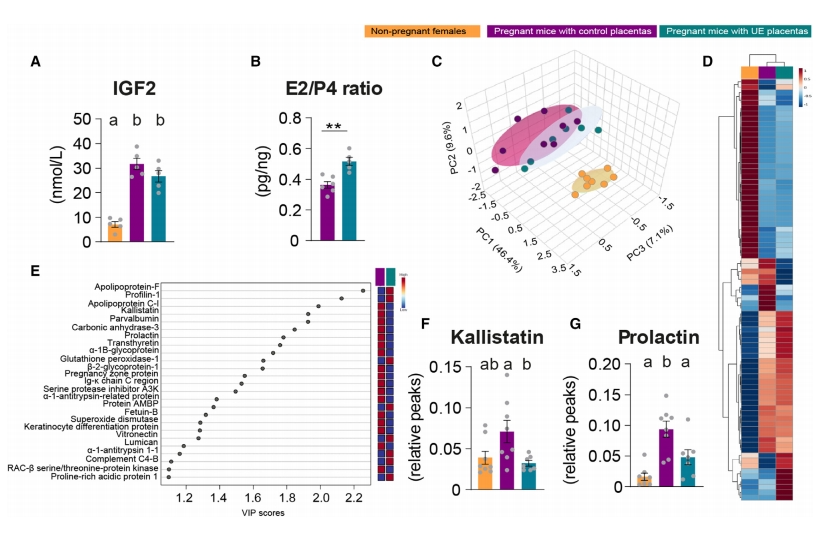
图三 胎盘Jz-Igf2缺失改变母鼠血浆循环蛋白和激素的丰度[6]
接下来,研究者探索UE组孕鼠代谢功能障碍的胎盘因素。发现与妊娠对照组相比,UE组胎盘的IGF受体IGF2R和IGF1R和下游信号蛋白的蛋白质水平没有变化,但胰岛素受体IR-β、PI3K调节亚基p85α和总AKT的丰度被破坏(图四A和B),表明UE组胎盘的代谢反应受损。进一步地,研究者从两组胎盘制备了胎盘内分泌细胞的原代培养物,并使用定性LC-MS/MS分析细胞分泌组,共检测到1408种蛋白质(图四C),包括已知的分泌蛋白胎盘催乳素/泌乳素家族成员、妊娠特异性糖蛋白和IGFBPs。两组胎盘内分泌细胞的分泌蛋白质组和相关富集功能表现出不同的模式(图四D和E),提示胎盘分泌的蛋白质/激素的变化可直接或间接地影响母体循环,胎盘Jz-Igf2缺失表现出分泌蛋白的信号异常和功能改变。
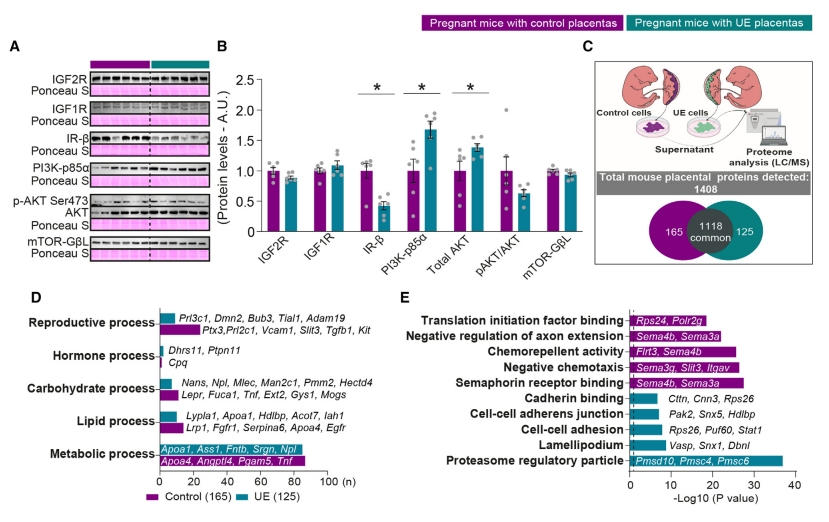
图四 胎盘Jz-Igf2缺失导致蛋白信号异常和功能改变[6]
为进一步确定IGF2自分泌/旁分泌机制的作用,研究者对胎盘内分泌细胞进行单核RNA测序(snRNA-seq,图五A),确定了五个主要的内分泌细胞群(图五B和C)。差异表达分析显示其中三个细胞群海绵滋养层细胞(SpT)、海绵滋养层前体细胞(SpTP)和糖原细胞类型(Gly1)显示出最高数量的差异表达基因(DEGs),这些差异表达基因大多在UE组中被下调(图五D-G),主要富集在翻译、核糖体生物合成、对雌二醇的反应、细胞迁移和线粒体呼吸能力相关通路(图五H)。以上数据表明,胎盘Jz-Igf2缺失影响胎盘内分泌细胞的蛋白质/激素的合成,进而从胎盘分泌到母体循环中影响母体代谢功能。
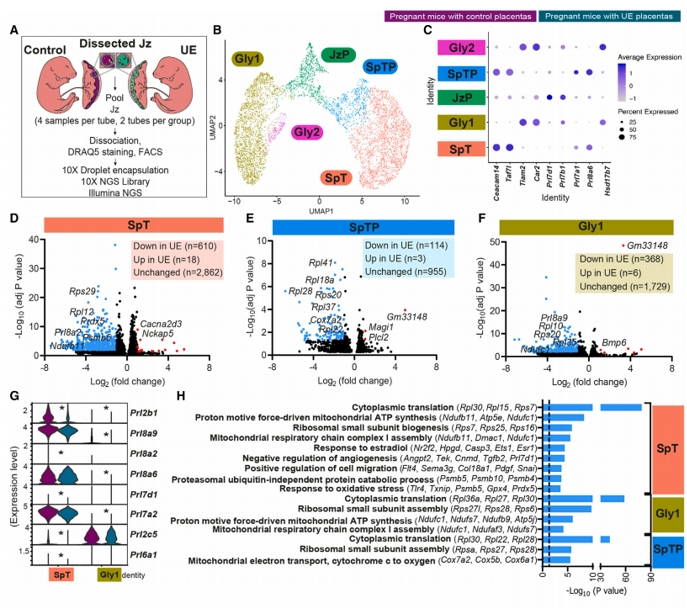
图五 胎盘Jz-Igf2缺失改变胎盘内分泌细胞转录组学[6]
最后,研究者评估扰动胎盘印记对子代产生的影响。给妊娠对照组和UE组子代在断奶后喂食正常饮食或高糖高脂饮食(HSHFD)(图六A),结果显示尽管两组子代断奶后的食物摄入量相当,但HSHFD-UE组子代出现胰岛素抵抗(图六B和C)和更多的肥胖增加(图六D和E),而循环脂质水平如胆固醇、甘油三酯和游离脂肪酸有略微差异(图六F-K)。此外,研究者还检测了子代的肝功能标志物、胰岛素信号传导和脂质代谢相关蛋白,发现UE组雄性子代在肥胖饮食中更容易发生代谢紊乱。以上数据表明,胎盘内分泌细胞Igf2缺失获得的子代更容易出现胰岛素耐受性受损和代谢功能紊乱。
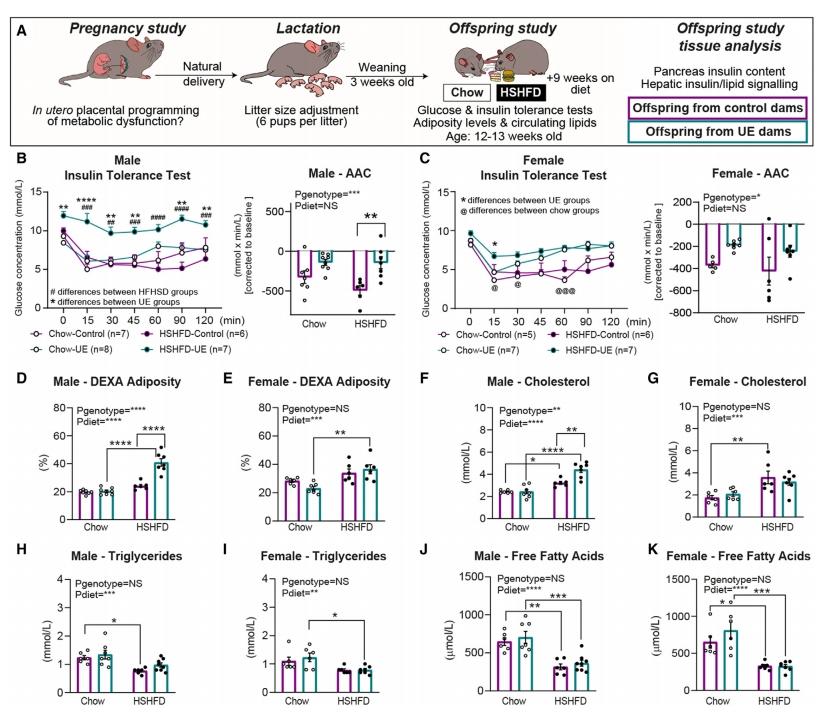
图六 胎盘Jz-Igf2缺失获得的子代出现胰岛素耐受性受损[6]
综上所述,该研究证明了印记基因Igf2在小鼠胎盘内分泌细胞中高表达,帮助母体适应葡萄糖和脂质代谢以支持胎儿生长。小鼠胎盘内分泌细胞的Igf2缺失改变了内分泌细胞的转录组,直接或间接影响了进入母体循环的关键信号蛋白质/激素的分泌,进而导致母体的胰岛素抵抗受损。胎盘内分泌细胞的Igf2缺乏会造成胎儿生长受限和低血糖,并且在成年后更容易出现代谢功能障碍。该研究证明在胎盘中存在着固有的胎儿操纵系统,可改变母体代谢以争取更多的资源分配,并且对子代自身的代谢健康产生长期影响。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Díaz P, Powell TL, Jansson T: The role of placental nutrient sensing in maternal-fetal resource allocation. Biology of reproduction 2014, 91(4):82.
2. Fowden AL, Moore T: Maternal-fetal resource allocation: co-operation and conflict. Placenta 2012, 33 Suppl 2:e11-15.
3. Moore GE, Ishida M, Demetriou C, Al-Olabi L, Leon LJ, Thomas AC, Abu-Amero S, Frost JM, Stafford JL, Chaoqun Y et al: The role and interaction of imprinted genes in human fetal growth. Philosophical transactions of the Royal Society of London Series B, Biological sciences 2015, 370(1663):20140074.
4. DeChiara TM, Robertson EJ, Efstratiadis A: Parental imprinting of the mouse insulin-like growth factor II gene. Cell 1991, 64(4):849-859.
5. Su R, Wang C, Feng H, Lin L, Liu X, Wei Y, Yang H: Alteration in Expression and Methylation of IGF2/H19 in Placenta and Umbilical Cord Blood Are Associated with Macrosomia Exposed to Intrauterine Hyperglycemia. PLoS One 2016, 11(2):e0148399.
6. Lopez-Tello J, Yong HEJ, Sandovici I, Dowsett GKC, Christoforou ER, Salazar-Petres E, Boyland R, Napso T, Yeo GSH, Lam BYH et al: Fetal manipulation of maternal metabolism is a critical function of the imprinted Igf2 gene. Cell Metab 2023, 35(7):1195-1208.e1196.
7. Hu D, Cross JC: Ablation of Tpbpa-positive trophoblast precursors leads to defects in maternal spiral artery remodeling in the mouse placenta. Developmental biology 2011, 358(1):231-239.
8. Musial B, Fernandez-Twinn DS, Vaughan OR, Ozanne SE, Voshol P, Sferruzzi-Perri AN, Fowden AL: Proximity to Delivery Alters Insulin Sensitivity and Glucose Metabolism in Pregnant Mice. Diabetes 2016, 65(4):851-860.
9. Baeyens L, Hindi S, Sorenson RL, German MS: β-Cell adaptation in pregnancy. Diabetes, obesity & metabolism 2016, 18 Suppl 1(Suppl 1):63-70.



