技术分享:Mas激活可增强脂噬和脂肪酸氧化,改善小鼠药物性肝损伤
药物性肝损伤(DILI)是指在正常治疗或临床试验剂量范围内的药物使用过程中,因药物本身或其代谢产物引起的程度不同的直接或间接的肝脏损害。DILI是全球主要的健康问题,也是急性肝功能衰竭(ALF)的最常见原因[1]。其中,对乙酰氨基酚(APAP)过量是药物诱导ALF的主要原因,其特征是小叶中心坏死和转氨酶水平显著升高。APAP是研究最广泛的肝毒性药物,其毒性主要是由于过量服用后的反应性代谢产物N-乙酰基对苯醌亚胺(NAPQI)迅速消耗谷胱甘肽(GSH),损害线粒体功能,并诱导核DNA损伤。肝细胞死亡随后激活库普弗细胞并诱导外周免疫细胞的肝脏浸润,进一步加重肝脏损伤[2]。
自噬是细胞吞噬和降解受损细胞器和细胞质大分子的过程,为随后的细胞代谢提供ATP和底物。它是一种广泛存在于真核细胞中的循环再利用系统,通常在细胞应激时上调。脂噬(lipophagy)是一种特殊类型的自噬,它选择性地识别脂滴(LD),将其有效地整合到自噬体中,以降解甘油三酯(TG)并释放出游离脂肪酸(FFA),从而为脂肪酸氧化(FAO)提供底物。据报道,在APAP诱导的肝毒性中,增强的自噬通过去除受损线粒体和APAP蛋白加合物来减少活性氧的产生,起到保护的作用[3]。
Mas是一种G蛋白偶联受体,由癌基因Mas1编码。Mas在人类和小鼠组织中广泛表达,尤其富集在单核细胞-巨噬细胞和神经系统[4]。Mas参与自噬和脂质代谢。Mas的激活通过抑制PI3K-Akt mTOR信号通路诱导自噬,并通过调节脂质代谢减少活性氧的产生[5]。在肝脏中,Mas激活的保护作用已在非酒精性脂肪变性、炎症和纤维化中得到证明[4, 6, 7]。然而,Mas在DILI中的作用仍有待阐明。
2023年3月,Journal of Hepatology期刊上报道了一项Mas激活保护肝脏免受药物性损伤的作用机制研究。具体而言,肝细胞特异性Mas信号的激活可通过增强脂噬和FAO来减轻APAP诱导的肝毒性,而这两种作用都依赖于AKT信号通路的抑制和FOXO1信号通路的激活。该研究提示Mas-AKT/FOXO1脂肪酸降解途径可能对制定APAP过量的治疗策略至关重要[8]。
首先,研究者探究人和小鼠DILI的肝内Mas表达情况。免疫组织化学染色(IHC)显示,与健康对照组相比,DILI病人的肝内Mas显著上调(图一A);Mas在DILI病人的肝实质细胞和非实质细胞中广泛表达,包括单核细胞、巨噬细胞、中性粒细胞、肝星状细胞和内皮细胞(图一B)。同样的,不同剂量的APAP处理后的小鼠肝内Mas的表达也显著上调(图一C和D);小鼠的多种组织和细胞类型也广泛表达Mas(图一E)。以上数据表明,Mas可能参与DILI进程。
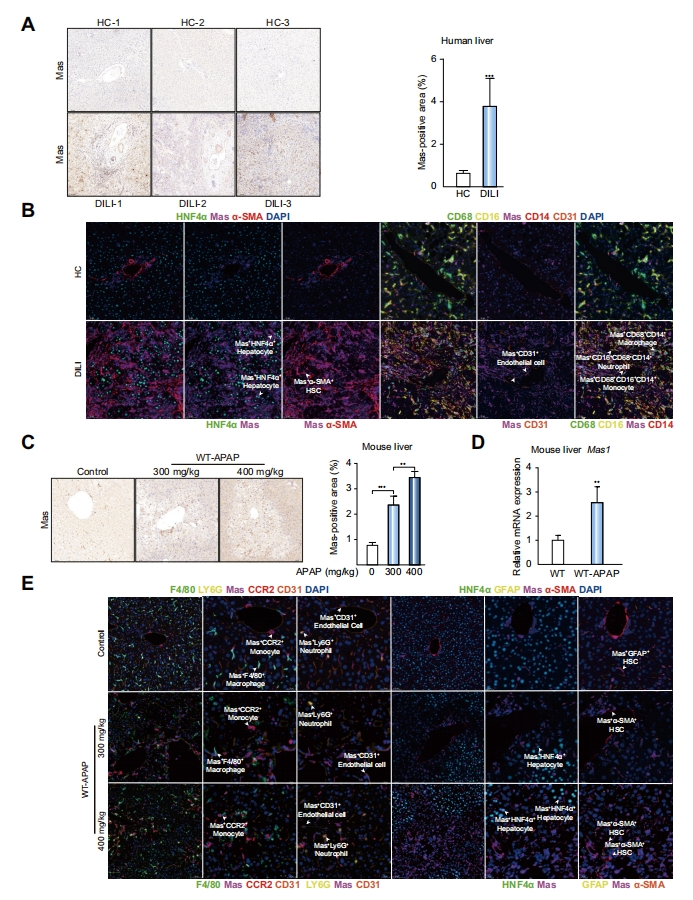
图一 人和小鼠DILI的肝内Mas表达上调[8]
接下来,研究者探索Mas在小鼠体内的作用,用300 mg/kg的APAP处理Mas1-/-和野生型(WT)小鼠,24小时后进行疾病表型分析。发现与对照小鼠相比,Mas1-/-小鼠肝细胞死亡和炎症浸润明显,血清丙氨酸氨基转移酶(ALT)水平显著升高(图二A和B),表明Mas1-/-小鼠对APAP具有明显的不耐受性。当用致死剂量的APAP处理时,Mas1-/-小鼠的存活率显著降低(图二C)。蛋白质印迹(WB)显示,Mas1-/- APAP小鼠肝脏中炎症(IL-1β)、线粒体应激(p-JNK)和细胞死亡(Cl-cas3、Bax)标志物的蛋白表达水平均显著升高(图二D)。KEGG通路富集分析显示,Mas1-/- APAP小鼠肝脏特异性高表达的基因主要富集在凋亡、坏死、铁死亡和炎症相关通路(图二E)。使用数字自适应光学扫描光场相互迭代断层扫描(DAOSLIMIT)直观地监测活体小鼠的肝内炎症细胞,显示Mas1-/- APAP和WT-APAP组的中性粒细胞活性显著增强,数量显著增多(图二F)。以上数据表明,全身性Mas1缺失加剧了APAP诱导的小鼠肝脏毒性。
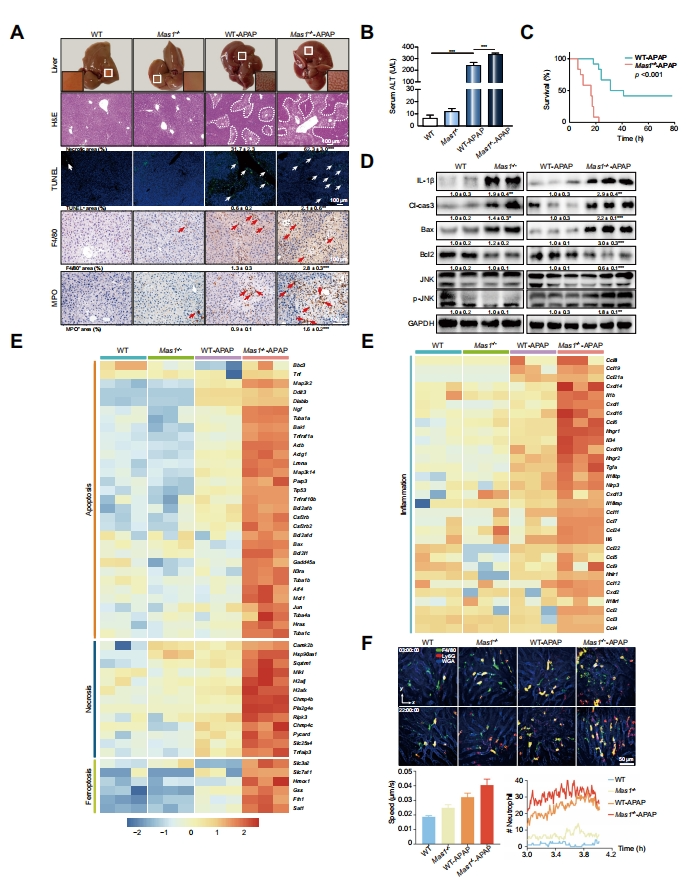
图二 全身性Mas1缺失加剧APAP诱导的小鼠肝毒性[8]
随后,研究者进一步探究全身性Mas1缺失加剧APAP诱导小鼠肝毒性的机制。将Mas1-/- APAP和WT-APAP组小鼠肝脏分别进行转录组、蛋白质组、代谢组测序,经KEGG分析, Mas1-/- APAP组特异性表达的mRNA和蛋白质对(图三A)、mRNA(图三B)和代谢物(图三C)都富集在自噬和脂肪酸降解这两种通路上。热图也显示Mas1-/- APAP组相比WT-APAP组,出现脂肪酸降解和自噬通路的下调以及脂滴形成相关通路的上调(图三D)。于是,研究者推测在APAP过量的情况下,Mas1缺失通过AKT-FOXO1下调自噬和脂肪酸降解,并对此进行验证。第一,WB分析相应标志物的蛋白质表达,相比WT-APAP组,Mas1-/- APAP组小鼠肝内的LC3-II、ATG7、LAMP1减少以及P62积累,表明自噬受损;ATGL、ACOX1和CPT1A减少,表明脂解和FAO受损,以及AKT增强和FOXO1抑制(图三E)。第二,透射电子显微镜(TEM)检测到Mas1-/- APAP小鼠的自噬液泡(AV)数量显著减少(图三F和G)。第三,免疫荧光显示,Mas1-/- APAP小鼠肝内的脂滴显著积累,脂噬和脂解减少(图三H-J)。第四,Mas1-/- APAP小鼠的TG水平显著升高(图三K)。以上数据表明,Mas1-/- 小鼠对APAP处理表现出的不耐受性可能源于脂噬和FAO不足,该过程可能受到AKT和FOXO1信号通路的调控。
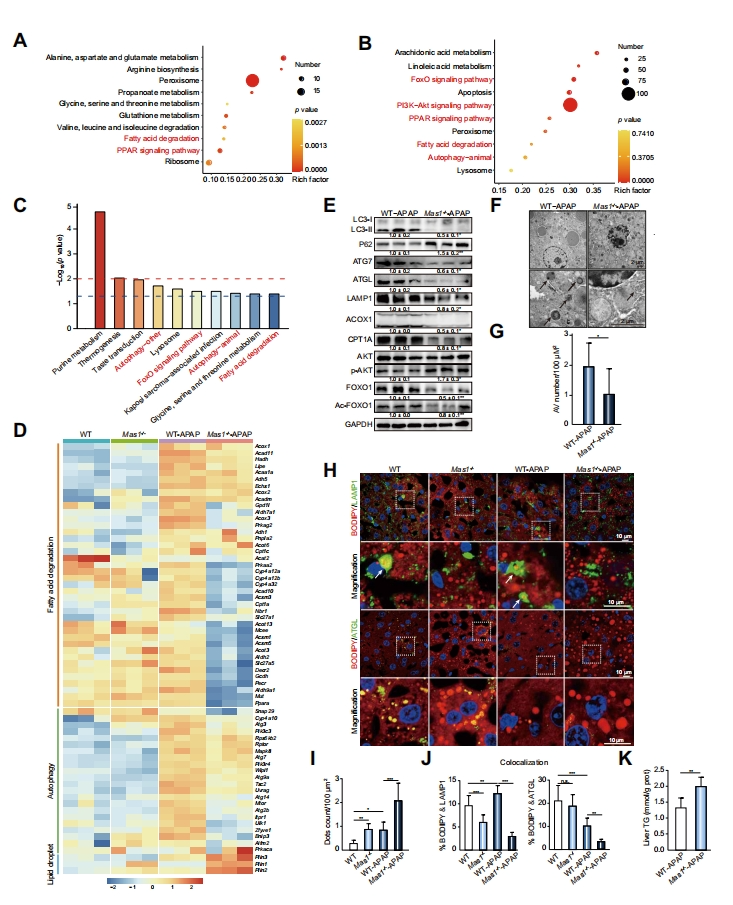
图三 全身性Mas1缺失在APAP诱导的小鼠肝毒性中削弱脂噬和FAO[8]
接下来,研究者使用Mas激活剂AVE0991进行研究。发现AVE0991的预给药对WT-APAP小鼠产生了显著的保护作用(图四A和B);显著提高了WT-APAP小鼠的存活率(图四C),显著减轻了肝内炎症、细胞死亡和线粒体应激(图四D)。此外,DAOSLIMIT显示AVE0991使得APAP处理的小鼠肝脏的浸润性中性粒细胞数量和迁移速度下降(图四E)。随后,研究者重点研究肝内脂噬和FAO,以探索AVE0991作用的潜在机制。数据显示,AVE0991显著上调WT-APAP小鼠的自噬(图四F)和脂噬(图四G)以及伴随着相应标志物蛋白质的表达(图四H),表明AVE0991挽救了自噬、脂噬和FAO,以及抑制AKT和增强了FOXO1信号传导。KEGG分析显示,与WT-APAP小鼠相比,AVE0991处理组小鼠的脂肪酸降解和自噬增强,而脂滴形成的途径受到抑制(图四I)。代谢组学分析发现AVE0991处理可显著增加三酰基甘油(TAG)的中性脂质产物单酰基甘油(MAG)和磷脂酰乙醇胺(PE)的水平,后者是一种与自噬密切相关的磷脂(图四J)。靶向脂质组学进一步定量肝内TAG、二酰基甘油(DAG)、FFA和PE成分(图四K和L),提示AVE0991可能促进TAG的降解,从而为随后的FAO释放FFA。研究者通过将[U-13C]-棕榈酸转化为13C标记的酰基肉碱和乙酰辅酶A来确定脂肪酸的代谢通量(图四M)。结果显示,AVE0991显著增加了体内脂肪酸转换,表现为肝内13C标记的棕榈酰肉碱(C16)、肉豆蔻酰基肉碱(C14)和月桂酰基肉碱(C12)以及乙酰辅酶A的丰度升高(图四N-P)。以上数据表明,激活的Mas通过增强脂噬和FAO保护小鼠免受APAP过量的肝毒性损伤。
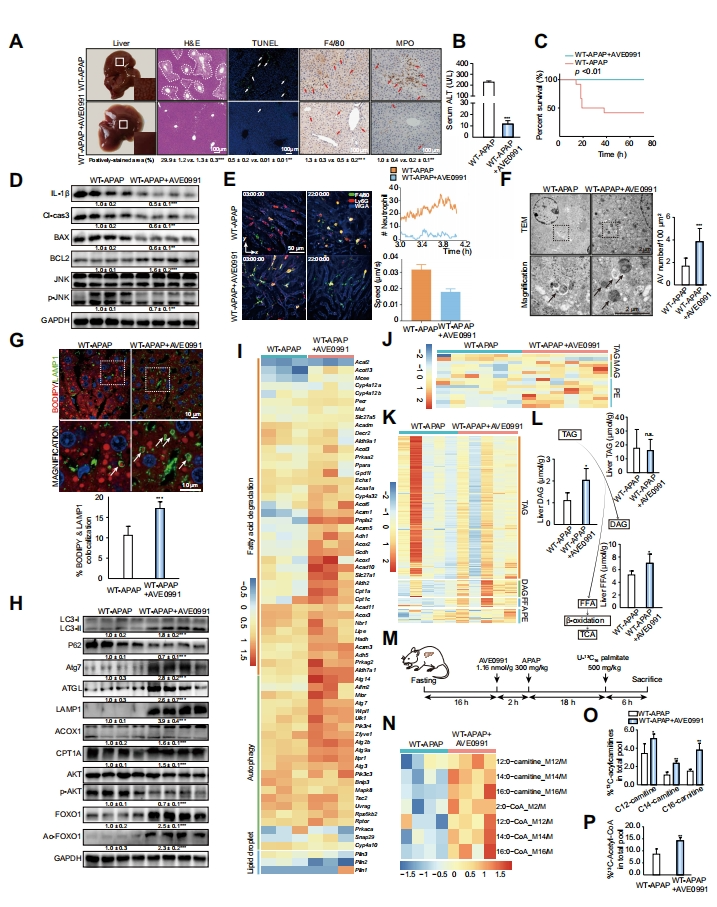
图四 Mas激活诱导脂噬和FAO改善APAP诱导的小鼠肝毒性[8]
进一步,研究者确定APAP处理后脂噬和FAO在Mas信号传导中的作用。通过体内给予自噬诱导剂雷帕霉素(RAPA)、PPARa激动剂非诺贝特或泛PPAR激动剂拉尼兰诺以确定它们是否可以逆转Mas1-/- APAP小鼠的疾病表型,其中PPAR信号通路是参与FAO的关键酶的主要调节因子。结果显示,三者给药都显著减轻了APAP诱导的肝毒性(图五A和B)。RAPA给药显著增强了Mas1-/- APAP小鼠肝内指示自噬、脂解和FAO的蛋白质表达(图五C)以及增加了AV数(图五D),导致TG(图五B)和脂滴显著降低降低(图五E)。此外,Mas1-/- APAP小鼠中非诺贝特或拉尼兰诺给药诱导脂噬和FAO的持续增强(图五F)伴随着AV数的显著增加(图五D),表明自噬和FAO途径之间存在相互依赖性。
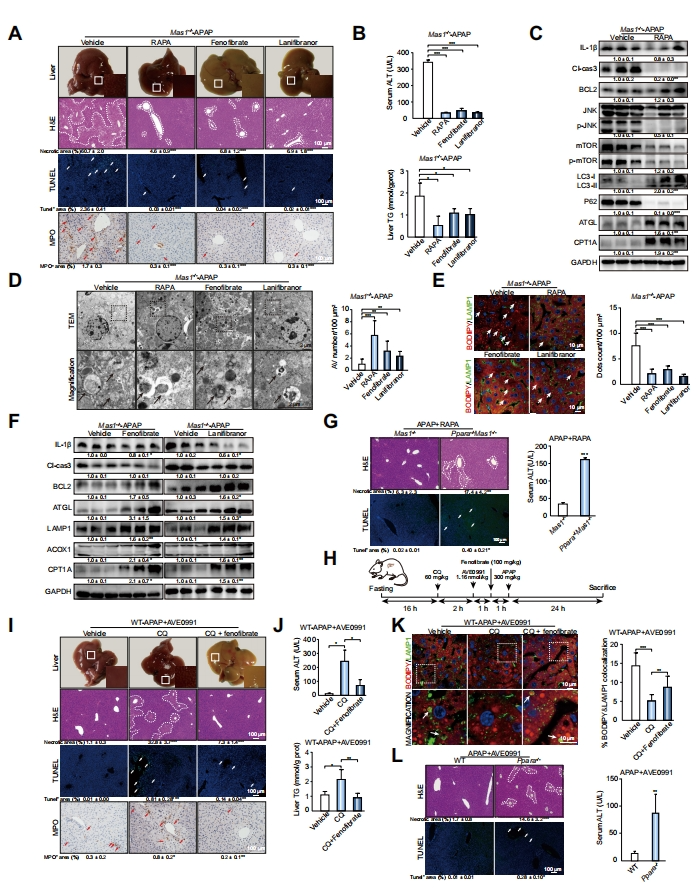
图五 在APAP诱导的小鼠肝毒性中,脂噬和FAO在Mas通路下游关键发挥作用[8]
PPARα是调控编码过氧化物酶体和线粒体FAO酶基因表达的核受体,研究者由此构建Mas1-/- Ppara-/- 小鼠,以探索Mas信号传导中脂噬和FAO之间的上下游关系。与Mas1-/-小鼠相比,Mas1-/- Ppara-/-小鼠中的RAPA的保护作用显著减弱(图五G),表明FAO在脂噬的下游发挥作用。给予WT-APAP小鼠自噬拮抗剂氯喹(CQ)、AVE0991和非诺贝特(图五H),发现CQ显著降低了AVE0991的保护作用,随后的非诺贝特给药显著逆转了CQ的有害作用(图五I和J),表明自噬在FAO的上游。一致地,肝内TG含量(图五J)随着脂噬活性(图五K)的改变而变化。此外,Ppara-/-小鼠中,AVE0991对APAP的保护作用显著减弱(图五L)。以上数据表明,在Mas信号传导中,脂噬产生的脂肪酸作为增强下游FAO的底物。研究者还分别小鼠给药p-AKT抑制剂哌立福新、FOXO1抑制剂AS1842856和去乙酰化酶抑制剂西尔替诺,证明了APAP处理后,Mas可能通过负调控的AKT和FOXO1信号通路调节脂噬和FAO。
最后,研究者通过腺相关病毒递送shRNA至小鼠体内构建肝内Mas1敲降小鼠shMas1(图六A-E),同时构建肝细胞特异性Mas1敲除小鼠AlbcreMas1f/f(图六F-I),实验证明肝内和肝细胞内Mas1缺失加剧了APAP诱导的小鼠肝毒性,表明肝细胞Mas信号在该进程中的关键作用。而APAP处理WT小鼠后2小时给药AVE0991激活Mas,可以显著改善疾病表型,恢复受损的自噬和脂肪酸降解(图六J-L)。
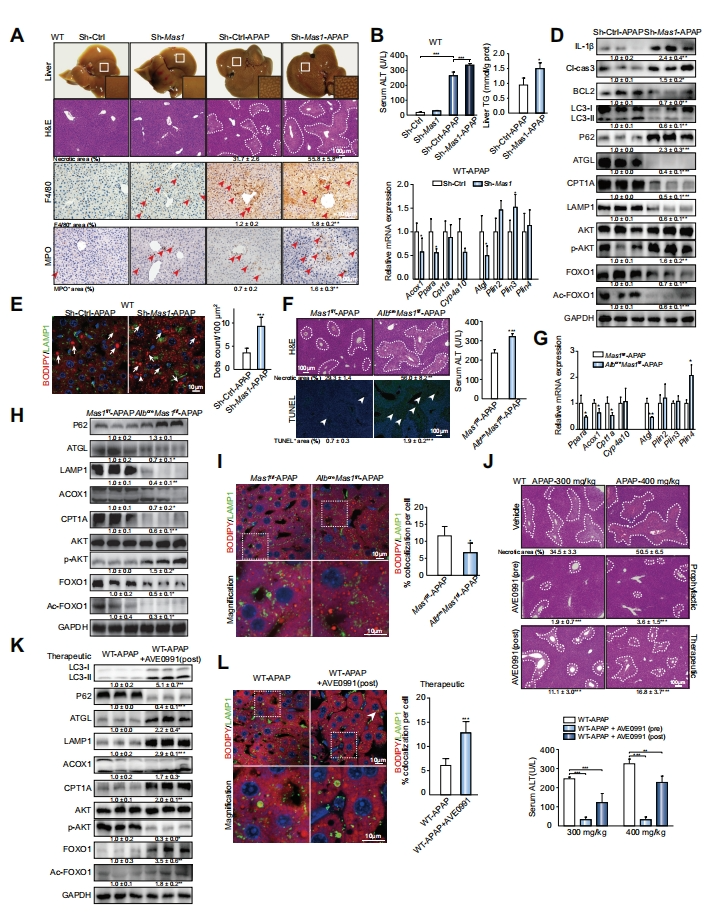
图六 肝内和肝细胞Mas1缺失加剧APAP诱导的小鼠肝毒性[8]
综上所述,该研究阐明了Mas在DILI中的作用,使用不同的遗传操作技术,构建了全身性、肝特异性和肝细胞特异性Mas1缺失小鼠,证明这些小鼠易受APAP诱导的肝毒性影响,表现出明显受损的脂噬和下游FAO抑制,同时伴随着上游AKT的激活和FOXO1的抑制。而肝细胞Mas的激活可增强AKT-FOXO1依赖的脂噬和FAO,保护小鼠改善APAP诱导的肝毒性。该研究结果为治疗APAP过量患者提供了新的线索,提示Mas有望成为治疗APAP诱导肝损伤的一个新靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Ostapowicz G, Fontana RJ, Schiødt FV, Larson A, Davern TJ, Han SH, McCashland TM, Shakil AO, Hay JE, Hynan L et al: Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Annals of internal medicine 2002, 137(12):947-954.
2. Tacke F: Targeting hepatic macrophages to treat liver diseases. J Hepatol 2017, 66(6):1300-1312.
3. Ni HM, McGill MR, Chao X, Du K, Williams JA, Xie Y, Jaeschke H, Ding WX: Removal of acetaminophen protein adducts by autophagy protects against acetaminophen-induced liver injury in mice. J Hepatol 2016, 65(2):354-362.
4. Hammer A, Yang G, Friedrich J, Kovacs A, Lee DH, Grave K, Jörg S, Alenina N, Grosch J, Winkler J et al: Role of the receptor Mas in macrophage-mediated inflammation in vivo. Proceedings of the National Academy of Sciences of the United States of America 2016, 113(49):14109-14114.
5. Song LN, Liu JY, Shi TT, Zhang YC, Xin Z, Cao X, Yang JK: Angiotensin-(1-7), the product of ACE2 ameliorates NAFLD by acting through its receptor Mas to regulate hepatic mitochondrial function and glycolipid metabolism. Faseb J 2020, 34(12):16291-16306.
6. Feltenberger JD, Andrade JM, Paraíso A, Barros LO, Filho AB, Sinisterra RD, Sousa FB, Guimarães AL, de Paula AM, Campagnole-Santos MJ et al: Oral formulation of angiotensin-(1-7) improves lipid metabolism and prevents high-fat diet-induced hepatic steatosis and inflammation in mice. Hypertension (Dallas, Tex : 1979) 2013, 62(2):324-330.
7. Pereira RM, Dos Santos RA, Teixeira MM, Leite VH, Costa LP, da Costa Dias FL, Barcelos LS, Collares GB, Simões e Silva AC: The renin-angiotensin system in a rat model of hepatic fibrosis: evidence for a protective role of Angiotensin-(1-7). J Hepatol 2007, 46(4):674-681.
8. Chen S, Lu Z, Jia H, Yang B, Liu C, Yang Y, Zhang S, Wang Z, Yang L, Li S et al: Hepatocyte-specific Mas activation enhances lipophagy and fatty acid oxidation to protect against acetaminophen-induced hepatotoxicity in mice. J Hepatol 2023, 78(3):543-557.



