技术分享:单细胞水平解析小鼠肝细胞的成熟过程
肝脏是人体重要器官,对血糖稳态维持、代谢调控和药物解毒至关重要。肝细胞是肝脏的主要细胞类型,具有重要的生物学功能,其发育缺陷或病理损伤会干扰甚至破坏肝脏功能。从人类多能性干细胞诱导获得肝细胞是治疗严重肝病的一种很有前景的方法。然而,由于缺乏对肝细胞成熟调控的了解,现有诱导方法产生的肝细胞在功能上尚不成熟[1]。因此,全面阐明肝细胞成熟过程和鉴别关键调控因子对于改进肝细胞体外诱导方法至关重要。
肝细胞来源于胚胎发育过程中的双潜能肝母细胞,在出生后经历一个漫长的发育过程,直到青春期才达到功能成熟[2]。之前的研究表明,胚胎期肝母细胞向肝细胞的分化转变主要发生在胚胎期E14.5和E15.5之间[3]。早期分化的肝细胞在胚胎期增殖速度较低,但在出生后不久迅速增殖,并在成熟过程中回复到静默状态[3]。此外,发育中的肝细胞沿着肝窦建立功能分区并产生多倍体和多核[4]。然而,我们对这些成熟过程的理解有限,仍需进一步研究这些事件的发生机理。
2023年10月,Developmental Cell期刊上报道了一项小鼠肝细胞发育过程的精确研究,利用单细胞RNA测序(scRNA-seq)和单核RNA测序(snRNA-seq)描绘了肝细胞成熟的全面转录组图谱,并探索其成熟过程。该研究定义了出生后的肝细胞建立特定代谢功能的三个成熟阶段,分别表现出不同的增殖率。肝细胞成熟过程中逐渐形成肝脏分区,不同倍性的肝细胞或其细胞核在分布上表现出分区偏好性和成熟异步性。此外,通过结合基因调控网络分析和体内遗传操作,确定了关键的成熟和分区相关的转录因子[5]。
首先,研究者研究肝细胞成熟的发育过程。从Alb-Cre;Rosa-tdTomato小鼠中分离肝细胞进行mSTRT scRNA-seq,检测时间覆盖早期分化到功能成熟时期,包括E17.5、E19.5、 P0、P3、P6、P9、P12、P15、P18、P24、P30和P60。研究者对测序的单个肝细胞进行主成分分析(PCA),以构建发育轨迹(图一A)。大多数细胞沿伪时间顺序PC1轴分布,这与实际发育时程基本匹配。经GO分析,PC1基因主要富集在肝细胞代谢功能,而PC2基因富集在细胞增殖(图一A)。因此,PC1和PC2分别反映出肝细胞的成熟过程和增殖状态。进一步构建扩散映射,使用与细胞周期无关的基因构建肝细胞成熟轨迹,发现与PCA结果一致,E17.5到P60的肝细胞沿着线性路径按时间顺序排布在DC1轴上(图一B)。在发育过程中,肝细胞在E19.5和P0之间失去连续性(图一A和B),表明在出生前后的基因表达谱式发生了显著变化。层次聚类分析显示,E19.5、P0和P3细胞分别特异性显著高表达簇1、2和3的基因(图一C)。簇1基因群主要富集在小分子代谢和生物合成过程,簇2基因群主要与细胞呼吸和线粒体活性相关,功能对应于新生儿的自主呼吸,簇3与脂质和外源代谢相关。以上数据表明,肝细胞在出生前后经历了基因表达的显著动态变化。
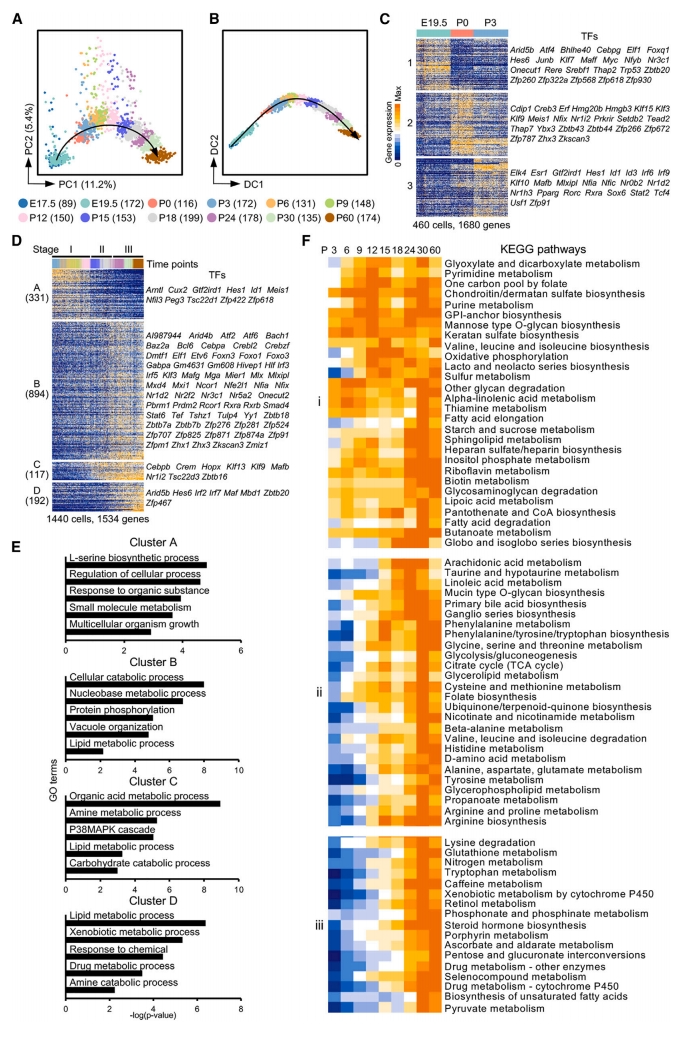
图一 肝细胞在不同成熟阶段建立特定的代谢功能[5]
基于无监督层次聚类分析显示,在P3之后的连续发育路径上,肝细胞可分为I-III阶段,分别对应于P3-P12、P15-P18和P24-P60三个时期(图一D)。根据扩散映射分析(图一B)鉴定出1534个成熟相关基因,进一步分类为簇A-D(图一D)。簇A基因在第I阶段高表达,从第II阶段开始突然下调表达。GO分析表明,簇A基因与生物合成和细胞生长相关,包括参与调节细胞生长的转录因子(TF)Peg3和Tsc22d1。簇B、C和D基因的表达分别从阶段I、II和III开始,并在成熟过程中逐渐增加。GO分析显示,簇B与脂质和核碱基代谢有关,包括一组有助于调节脂质代谢的TF,如Cebpa、Nfe2l1和Nr1d2。簇C与胺、脂质和碳水化合物代谢有关,而簇D与外源性、脂质和胺代谢过程有关(图一D和E)。接着,研究者分析KEGG代谢途径,可分为三组i-iii,其表达模式与簇B-D相似(图一F)。其中,与细胞色素P450的外源代谢和药物解毒相关通路在第iii组中特异性富集(图一F)。因此,从P24开始,肝细胞可以被认为是功能成熟的细胞,而在P24之前被定义为未成熟的肝细胞。以上数据表明,肝细胞的成熟经过不同的中间阶段,各自具有不同的基因表达谱式,大多数代谢途径在特定阶段被建立起来。
K-means聚类结果显示,沿着PC2轴表达细胞周期相关基因的细胞处于增殖状态,而主线上的细胞处于静默状态(图二A和B)。肝细胞增殖率在出生前后仍然很低,在第I阶段稳步上升,在第II阶段连续下降,在第III阶段仅保持约1%增殖率(图二C)。Ki67免疫染色验证了这一结果(图二D和E)。以上数据显示了肝细胞成熟过程中细胞增殖的动态模式,提示肝细胞成熟的不同阶段对细胞周期的调节可能不同。
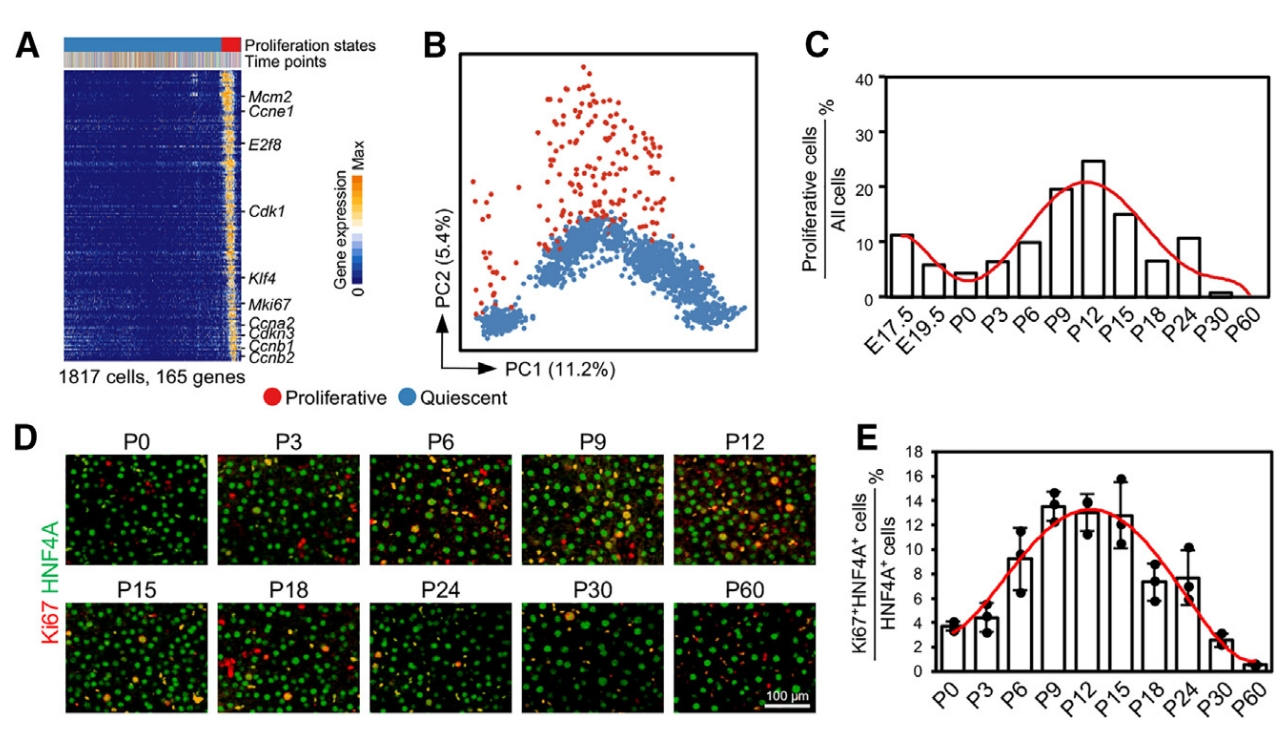
图二 肝细胞增殖与成熟过程相协调[5]
接下来,研究者探究肝细胞分区过程。肝细胞沿着门静脉(PV)和中央静脉(CV)之间的轴线空间分区执行不同的功能[6]。肝细胞的分区早在P3时就开始建立,根据每个时间点排名靠前的分区相关基因的表达模式,在P3-P60定义了CV、中小叶(ML)和PV细胞(图三A)。无监督层次聚类分析分别鉴定出四簇CV(簇a-d)和四簇PV(簇a'-d')基因,表现出发育阶段特异性的表达谱式,其中CV簇包含大量的TF,而PV簇中只发现了少量的TF(图三B)。与成熟相关基因类似,大约80%的分区相关基因在肝脏发育过程中上调,而一小部分基因下调(图一D和图三B)。为了验证不同分区相关基因簇的空间模式,研究者在P0、P12、P30和P60肝切片上进行原位杂交,发现这些基因表现出区域特异的表达模式,并在不同的成熟阶段开始表达(图三C和D)。以上数据确定了分区相关基因的发育阶段特异性转录组图谱,表明肝细胞在出生后不久就开始形成分区,CV和PV区肝细胞在分区过程中采用不同的调控策略。
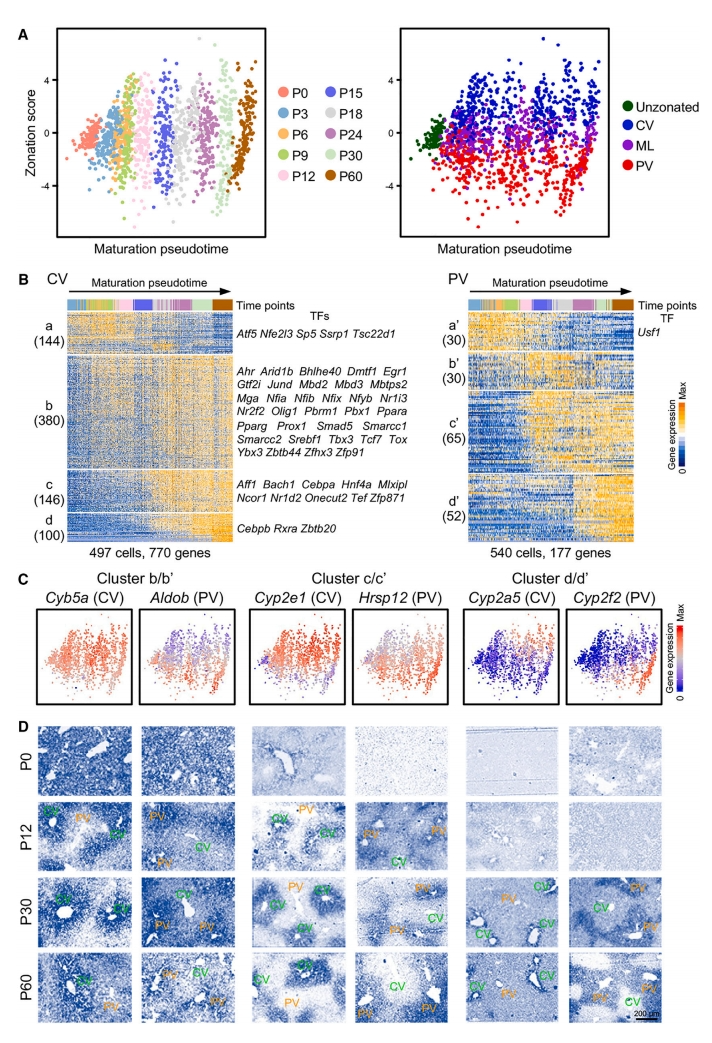
图三 肝细胞分区在成熟过程中逐渐建立[5]
成熟的肝细胞含有多种多倍体,包括二倍体(2N)、四倍体(4N)、八倍体(8N)甚至更多[7],可通过Hoechst 33342染色进行区分,并通过流式细胞荧光分选(FACS)收集。FACS结果显示,P60时93%的肝细胞为4N或8N(图四A)。不同倍体的肝细胞之间的空间和转录组异质性仍然存在争议。分析结果显示,2N肝细胞在分区图上主要位于PV区(图四B)。CD324和CD73分别是PV和CV肝细胞分区表面标记物,CD324+比CD73+含有更多的2N细胞(图四C-E)。4N/8N肝细胞比2N肝细胞表现出更成熟的状态(图四F和G)。研究PV区2N和4N/8N肝细胞之间的转录组差异,发现多倍体肝细胞具有更多的高表达基因(图四H)。GO分析显示,在2N细胞中高表达的基因主要与药物解毒和有机酸代谢有关,而在4N/8N肝细胞高表达的主要与脂质代谢有关(图四I)。以上数据表明,P60时多倍体肝细胞比2N肝细胞更成熟,2N肝细胞在空间上表现出PV定位的偏好性。
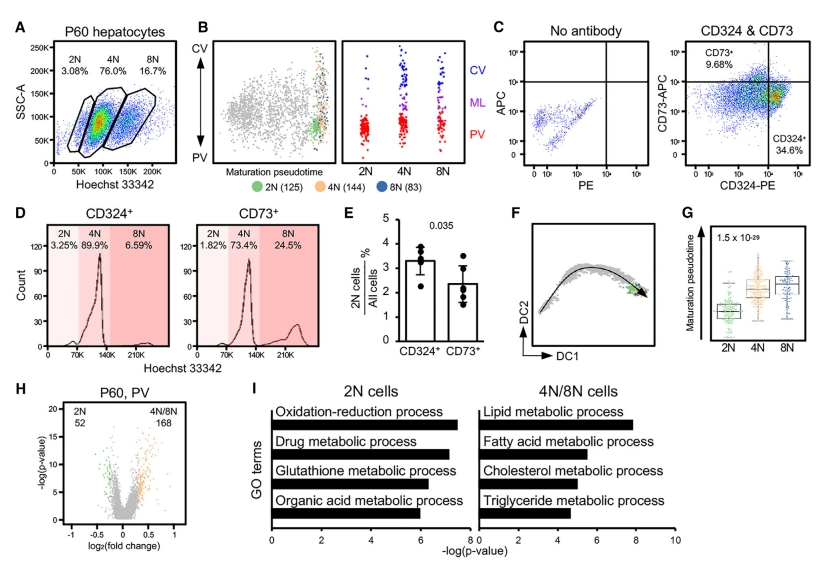
图四 不同倍体的肝细胞在空间上的异质性[5]
接下来,研究者探索不同倍体细胞核的成熟过程。从P0、P9、P18和P60肝细胞中分离细胞核,并用DAPI染色进行FACS分析。发现P0肝细胞中几乎所有的细胞核都是2N,P9肝细胞出现了4N细胞核,P60肝细胞中4N细胞核达到了总细胞核的44.4%,而只有小部分多于4N的细胞核(图五A)。在偏最小二乘回归(PLSR)图上,P60肝细胞的2N细胞核显示出显著的PV偏好性,在P0、P9或P18阶段,不同倍体的细胞核沿着与分区相关的Coord2轴均匀分布(图五B和C)。随后,研究者构建所有细胞核的扩散映射,发现相对于4N细胞核,2N细胞核在P18和P60表现出延迟成熟状态(图五D和E)。差异基因表达分析,发现P60 PV中2N核中高表达的基因与脂肪酸氧化、药物和碳水化合物代谢过程相关,而4N核中高表达的基因与酰胺和脂质代谢相关(图五F和G)。以上数据进一步表明,肝细胞分区建立具有阶段特异性,2N细胞核表现出PV偏好性,不同倍体细胞核的成熟具有异步性,与4N核相比,2N核的成熟状态有所延迟。
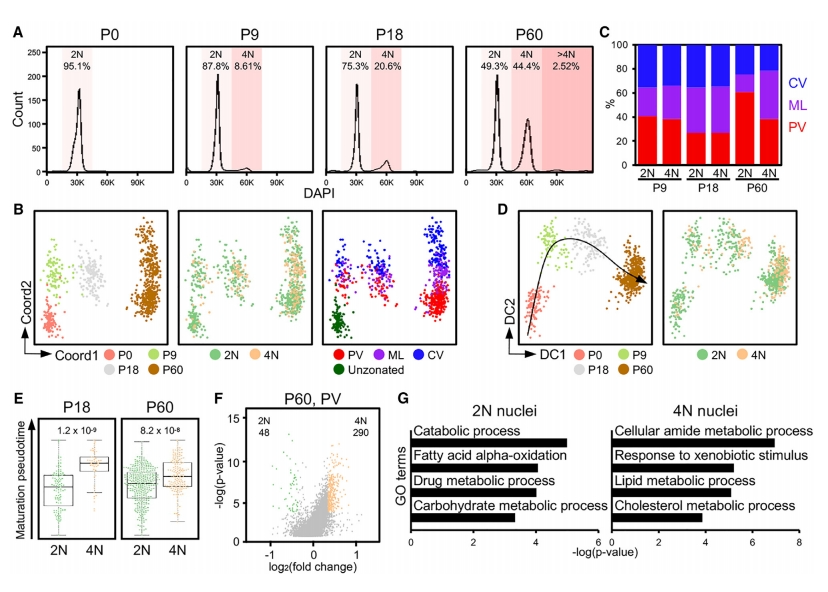
图五 不同倍体细胞核的成熟状态是异步的[5]
随后,研究者鉴定肝细胞成熟调控中至关重要的转录因子,使用P3-P60肝细胞的scRNA-seq数据进行基因调控网络分析,鉴定出36个成熟相关的TF及其下游靶基因(图六A)。这些下游靶基因的表达模式在成熟过程中呈现出阶段特异性(图六B和C)。在肝细胞成熟过程中,内质网(ER)应激的重要调节因子Xbp1的下游靶基因在第III阶段高表达,与昼夜节律有关的Tef的下游靶基因从第II阶段结束的P18开始表达(图六B和C)。为了验证候选TF对肝细胞成熟的调控作用,研究者将gRNA和Tbg-Cre元件递送到P12(I阶段)的Rosa-Cas9转基因小鼠的肝脏中,以分别敲除肝细胞的Xbp1和Tef,并在40天后在P52(III阶段)检测表型(图六D)。与野生型细胞相比,Xbp1-KO和Tef-KO肝细胞均表现出明显的成熟延迟,Tef-KO肝细胞更明显(图六E)。差异基因表达和GO分析显示,378个基因在WT肝细胞中高表达,主要与脂质生物合成相关,而264个基因在Xbp1-KO肝细胞中强表达,与脂肪酸氧化、应激反应和免疫功能有关(图六F)。对于Tef-KO,566个基因在WT肝细胞中高表达,与脂质生物合成相关,而999个基因在Tef-KO肝细胞中高表达,与脂肪酸和葡萄糖分解代谢相关(图六F)。油红O染色证实,Xbp1-KO和Tef-KO动物的肝脏中脂质含量均降低(图六G)。过碘酸雪夫(PAS)染色显示,Tef-KO小鼠肝脏中的糖原含量较低,但Xbp1-KO小鼠的糖原含量没有影响(图六G)。以上数据表明,Xbp1和Tef在调节肝细胞成熟中至关重要。
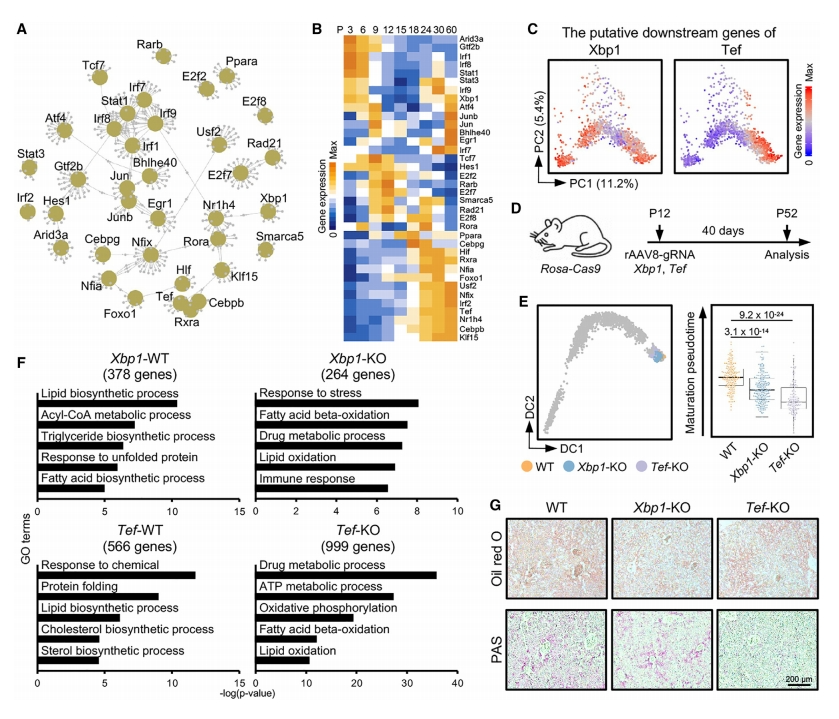
图六 鉴定调控肝细胞成熟的转录因子[5]
最后,研究者对P60肝细胞进行基因调控网络分析,鉴定出25个与肝细胞分区高度相关的TF(图七A)。其中,Nr2f2是类固醇激素超家族的核受体,负责调节脂质代谢和转运。在肝细胞成熟过程中,Nr2f2的表达从第I阶段开始升高,并在CV肝细胞区显著升高(图三B和图七B)。Usf1是唯一发现的在PV肝细胞中高表达的TF(图三B和图七B),它主要调节脂质和葡萄糖代谢,并可能参与肝脏再生。在成熟I阶段的P12,研究者敲除Nr2f2和Usf1检查其对肝细胞分区建立的影响,在P52进行表型分析(图七C)。在成熟III阶段的P60,敲除Nr2f2和Usf1检查其在分区维持中的功能,在P74后进行表型分析(图七D)。与WT肝细胞相比,Nr2f2-KO和Usf1-KO肝细胞在PV区均表现出优势(图七E-H)。此外,P12时期缺失Nr2f2和Usf1的肝细胞在P52显示出延迟成熟,再次表明肝细胞成熟与分区的建立密切相关(图七I)。以上数据表明,Nr2f2和Usf1对肝细胞分区的建立和维持具有显著影响。
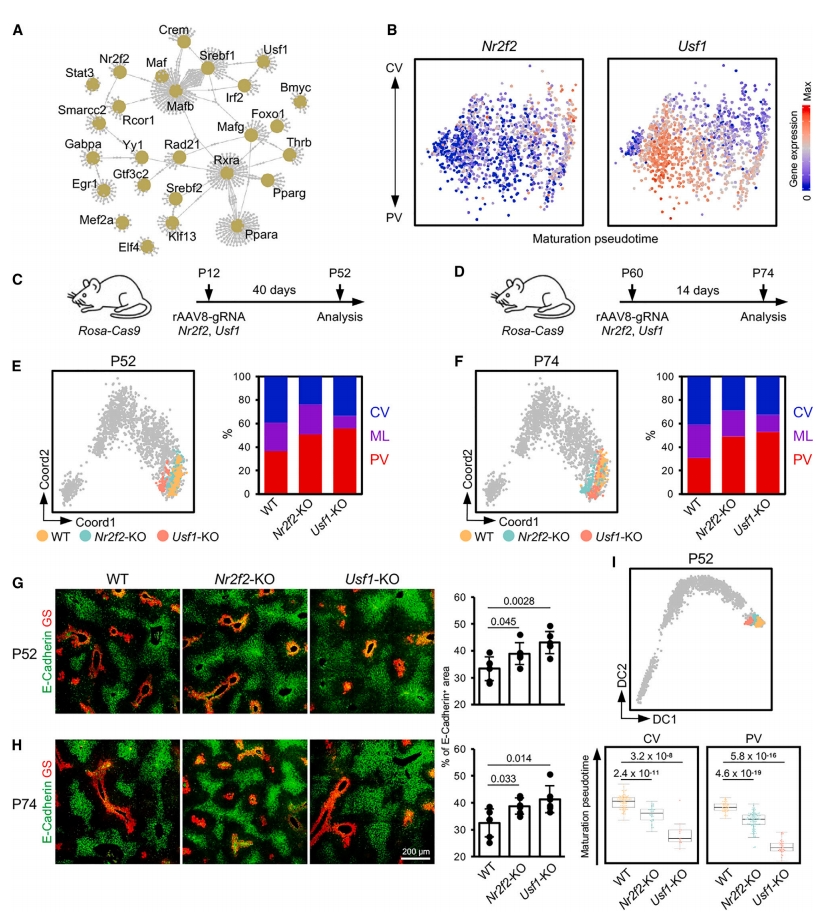
图七 鉴定调控肝细胞分区的转录因子[5]
综上所述,研究者对从E17.5的早期分化阶段到P60的成熟阶段的肝细胞进行详细时间进程的scRNA-seq和snRNA-seq分析,探索了肝细胞成熟过程中的关键事件,包括发育阶段、动态增殖率和分区建立过程中的调控逻辑,以及不同倍体的细胞或细胞核在肝小叶的分布及其转录异质性。此外,研究者还鉴定出许多与肝细胞成熟和分区相关的转录因子,并用遗传学方法验证了Xbp1和Tef调控肝细胞成熟,而Nr2f2和Usf1调控分区建立。该研究不仅全面了解了肝细胞的成熟过程,而且为研究基因在肝细胞成熟和分区发育中的作用建立标准,从而为指导肝细胞成熟提供了重要的发育生物学信息。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Xie Y, Yao J, Jin W, Ren L, Li X: Induction and Maturation of Hepatocyte-Like Cells In Vitro: Focus on Technological Advances and Challenges. Frontiers in cell and developmental biology 2021, 9:765980.
2. Gordillo M, Evans T, Gouon-Evans V: Orchestrating liver development. Development 2015, 142(12):2094-2108.
3. Yang L, Wang WH, Qiu WL, Guo Z, Bi E, Xu CR: A single-cell transcriptomic analysis reveals precise pathways and regulatory mechanisms underlying hepatoblast differentiation. Hepatology 2017, 66(5):1387-1401.
4. Ben-Moshe S, Itzkovitz S: Spatial heterogeneity in the mammalian liver. Nature reviews Gastroenterology & hepatology 2019, 16(7):395-410.
5. Yang L, Wang X, Zheng JX, Xu ZR, Li LC, Xiong YL, Zhou BC, Gao J, Xu CR: Determination of key events in mouse hepatocyte maturation at the single-cell level. Dev Cell 2023, 58(19):1996-2010.e6.
6. Panday R, Monckton CP, Khetani SR: The Role of Liver Zonation in Physiology, Regeneration, and Disease. Seminars in liver disease 2022, 42(1):1-16.
7. Donne R, Saroul-Ainama M, Cordier P, Celton-Morizur S, Desdouets C: Polyploidy in liver development, homeostasis and disease. Nature reviews Gastroenterology & hepatology 2020, 17(7):391-405.



