技术分享:AMPK介导RIPK1磷酸化以抑制代谢应激诱导的细胞死亡
腺苷酸活化蛋白激酶(AMPK)是真核生物中一种进化保守的细胞营养状态传感器和能量稳态调节器,可在葡萄糖缺乏等低细胞能量条件下被激活,以促进能量应激下的代谢适应[1]。当持续的能量应激超过AMPK介导的代谢适应时,它会激活细胞死亡[2]。然而,AMPK在能量应激下调节细胞存活的机制尚不完全清楚。
受体相互作用蛋白激酶1(RIPK1)是细胞死亡和炎症的关键介质[3]。肿瘤坏死因子α(TNFα)刺激肿瘤坏死因子受体1(TNFR1)后可激活RIPK1,激活的RIPK1可能介导受体相互作用蛋白激酶3(RIPK3)和混合谱系激酶结构域样蛋白(MLKL)依赖的坏死或caspase-8依赖的凋亡[4]。RIPK1也在Fas死亡受体(也称为CD95)、TRAIL受体1(TRAIL-R1,也称为DR4)和TRAIL-R2(也称为DR5)以及TNFR的下游被激活[5]。有研究表明,抑制RIPK1的激活可以保护缺血性损伤[6]。然而,目前尚不清楚RIPK1是否以及如何在缺血条件下被激活。
2023年6月,Science上报道了一项研究,揭示了RIPK1响应能量应激调控细胞存活的新机制。具体而言,能量应激促进RIPK1的激活,而AMPK通过Ser416磷酸化抑制RIPK1活性,从而短期抑制能量应激诱导的细胞死亡;在长期能量应激下,AMPK介导的RIPK1磷酸化丧失,抑制RIPK1活性的作用减轻,促使细胞从适应性稳态转变为炎症和死亡。此外,抑制RIPK1活性可以保护髓系Ampka1缺陷小鼠免受缺血再灌注损伤[7]。
首先,研究者探索能量应激条件下RIPK1对细胞存活的影响。将细胞放在无糖培养基中培养不同时间,野生型(WT)小鼠胚胎成纤维细胞(MEF)在葡萄糖剥夺48小时后死亡,而大多数表达无催化活性RIPK1(Ripk1D138N/D138N)的MEF存活(图一A)。葡萄糖剥夺增加了RIPK1(S166)、RIPK3(T231/S232)和MLKL(S345)的磷酸化,但在Ripk1D138N/D138N MEF中均被阻断(图一B和C)。蛋白不溶解性增加是这些蛋白被激活的另一个标志[8]。在葡萄糖剥夺的MEF中,RIPK1、RIPK3和MLKL的浓度在温和裂解液NP-40可溶组分中降低,而在NP-40不溶性且6 M尿素可溶性组分中增加,但这些作用同样在Ripk1D138N/D138N中被阻断(图一C)。RIPK1裂解和caspase-3(CC3)的表达(图一B)表明葡萄糖剥夺诱导了细胞凋亡。将细胞暴露于不同浓度的葡萄糖中,发现只有严重的能量应激才会诱导坏死和细胞凋亡(图一D)。研究者还对WT、Ripk3 KO和Mlkl KO细胞进行不同时间的葡萄糖剥夺,发现Ripk3或Mlkl的敲除部分阻止了葡萄糖剥夺诱导的细胞死亡。WT和Tnfr1/2双敲除(DKO)细胞之间的细胞活力和RIPK1激活程度没有明显区别,表明葡萄糖剥夺诱导的RIPK1激活和细胞死亡独立于TNFα信号通路。
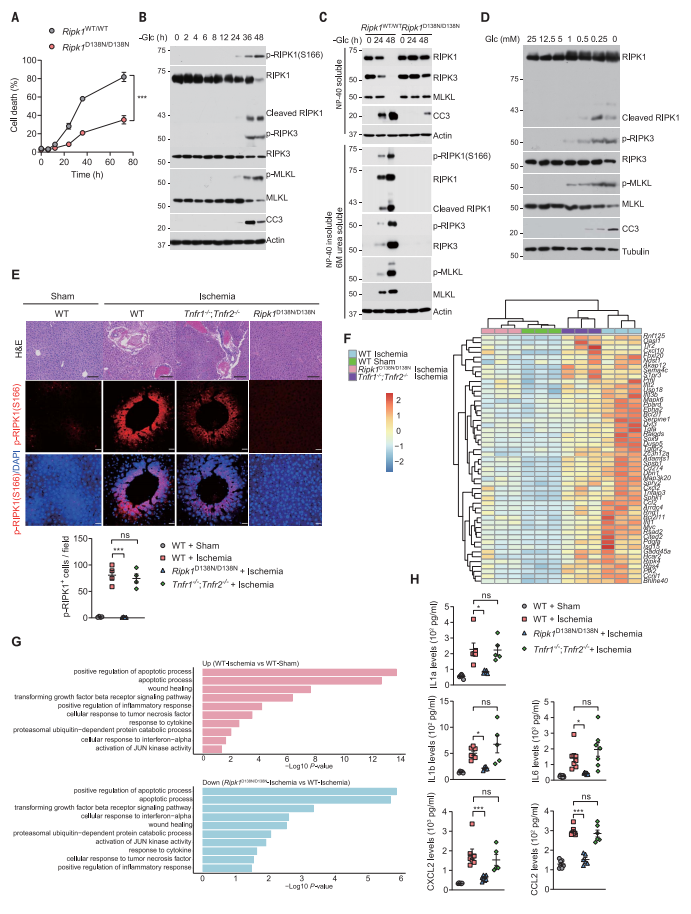
图一 能量应激以RIPK1依赖的方式促进细胞死亡和炎症[7]
接下来,研究者对WT小鼠、Ripk1D138N/D138N小鼠和Tnfr1/2 DKO小鼠进行肝缺血损伤。组织学分析显示,WT和Tnfr1/2 DKO小鼠肝脏有严重的炎症浸润和细胞死亡,而Ripk1D138N/D138N小鼠没有(图一E)。通过RNA-seq分析全肝基因表达谱,与未进行肝缺血损伤的WT小鼠相比,进行肝缺血的WT和Tnfr1/2 DKO小鼠炎症反应相关基因的表达增加,而Ripk1D138N/D138N很大程度上挽救了这些基因的异常表达(图一F和G)。ELISA实验检测Il1a、Il1b、Il6、Cxcl2和Ccl2的表达水平,发现它们均在进行肝缺血的WT和Tnfr1/2 DKO小鼠血清中增加,而在Ripk1D138N/D138N小鼠中减少(图一H)。以上数据表明,缺血损伤以非TNFα依赖的方式诱导RIPK1依赖的细胞死亡和炎症。
随后,研究者探究RIPK1介导能量应激的机制。聚丙烯酰胺凝胶电泳(SDS-PAGE)显示,来源于葡萄糖剥夺细胞的RIPK1具有明显不同的迁移速度,且可以被λ-磷酸酶逆转,表明葡萄糖剥夺可能诱导RIPK1磷酸化(图二A和B)。为检测内源性RIPK1的磷酸化,研究者制备了一种针对人RIPK1的p-S416磷酸化特异性抗体,该抗体与小鼠RIPK1的p-S415相对应。在葡萄糖饥饿后,小鼠RIPK1的p-S415和人RIPK1的p-S416在WT细胞中表达增加,但在Ampk DKO细胞中没有(图二C和D)。模拟AMP功能的AMPK激活剂AICAR处理可以在WT细胞中诱导RIPK1在Ser415的磷酸化(图二E)。同样,可以激活AMPK的小分子化合物991和二甲双胍也可以诱导WT细胞的RIPK1在Ser415的磷酸化(图二F和G)。RIPK1 S415的磷酸化与一个稳定的AMPK底物乙酰辅酶a羧化酶(ACC)的磷酸化相平行(图二C-G)。葡萄糖剥夺4小时后重新加入葡萄糖,磷酸化水平迅速恢复到基础水平(图二H)。研究者进而测试AMPK是否可以直接磷酸化RIPK1。体外激酶测定发现,重组AMPK同样诱导了Flag标记的人源RIPK1在Ser416的磷酸化(图二I)。禁食导致低血糖可激活肝脏AMPK,发现禁食小鼠肝脏的p-RIPK1(S415)表达增加(图二J)。以上数据表明,AMPK可以磷酸化RIPK1以响应能量应激。
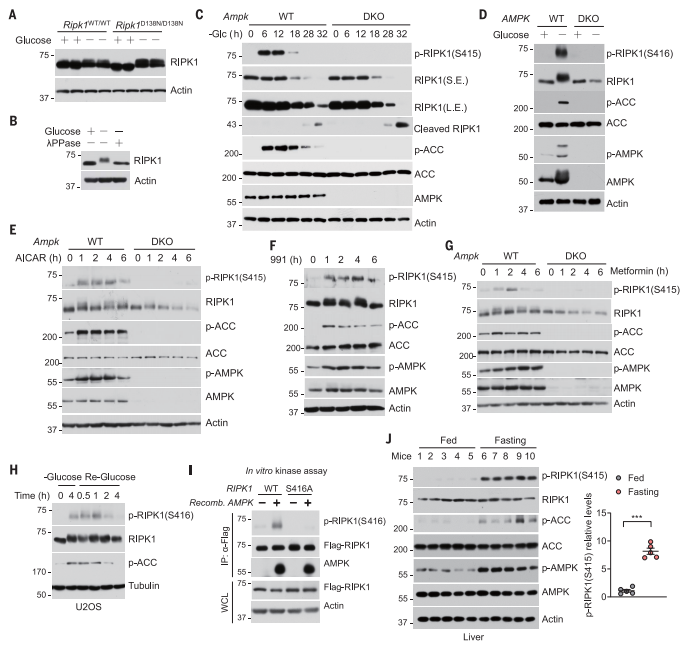
图二 AMPK磷酸化RIPK1以响应能量应激[7]
下一步,研究者探究AMPK对RIPK1的磷酸化调控能量应激的机制。实验显示,Ampk缺失增加细胞对葡萄糖缺乏的敏感性,诱导细胞死亡(图三A)。MEF中Ampk缺失促进了葡萄糖剥夺诱导的RIPK1激活(图三B)。与WT MEF相比,葡萄糖缺乏在Ampk DKO MEF中诱导了更多的RIPK3与RIPK1的共表达,表明Ampk缺失促进了RIPK1驱动的细胞坏死(图三C)。为确定AMPK在体内调节RIPK1活性的作用,研究者构建Ampka1a2f/f;Ubc-CreERT2小鼠。免疫荧光结果表明,他莫昔芬诱导Ampka1和Ampka2的缺失在多种组织中诱导了RIPK1的激活(图三D),并增加了细胞死亡。长时间的葡萄糖剥夺超出能量适应,导致RIPK1激活和细胞死亡(图三E)。同样地,2-脱氧葡萄糖(2-DG)短期处理细胞激活AMPK[9]并增加了RIPK1在Ser415的磷酸化,但长期处理却降低了磷酸化,增强了RIPK1的激活。研究者将RIPK1的WT和S415A突变体重新引入Ripk1 KO MEF中,发现RIPK1 S415A突变体相比WT,对葡萄糖缺乏诱导的细胞死亡更为敏感(图三F)。研究者通过CRISPR-Cas9技术构建Ripk1S415A/S415A突变小鼠,该小鼠出生符合孟德尔遗传比例,体型生长正常,但RIPK1 S415A突变增加了缺血再灌注损伤(IR)肝脏的细胞死亡和炎症(图三G-J)。以上数据表明,AMPK介导的RIPK1 S415磷酸化抑制了RIPK1活性并阻断细胞对能量应激的死亡;但当细胞长期暴露于能量应激时,AMPK介导的RIPK1磷酸化丧失,促使细胞从适应性稳态转变为死亡。
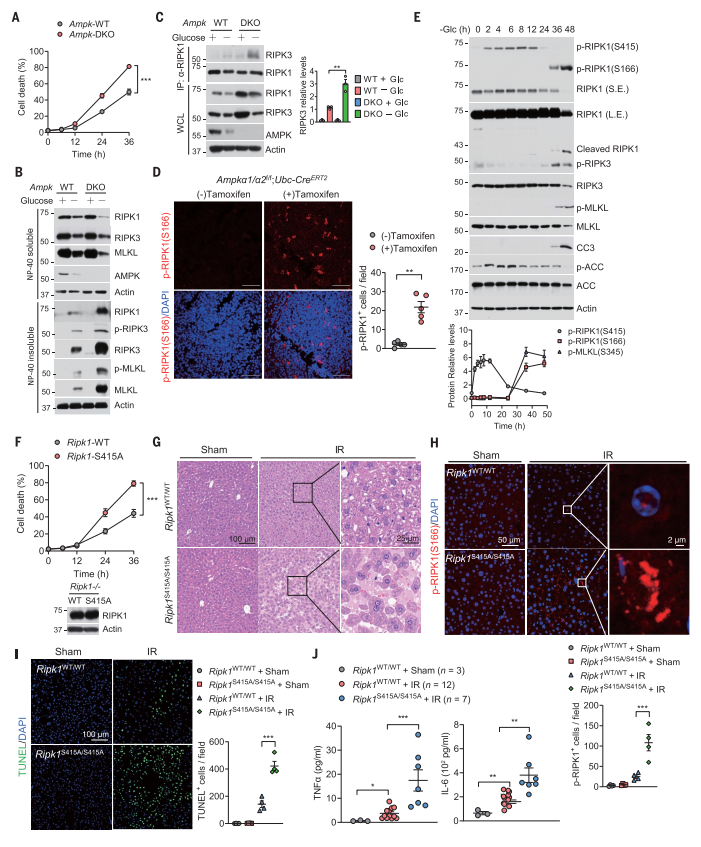
图三 AMPK缺失促进RIPK1驱动的细胞死亡和炎症[7]
最后,研究者进一步验证RIPK1与AMPK之间的关系,构建了Ampka1fl/fl;LysM-Cre小鼠和Ampka1fl/fl;LysM-Cre;Ripk1D138N/D138N小鼠。在肝脏缺血再灌注损伤(IR,图四A)实验中,与对照小鼠相比,IR导致血清中ALT和AST异常增加、肝脏炎症细胞浸润增加,在Ampka1fl/fl;LysM-Cre小鼠表型更为严重,而在Ampka1fl/fl;LysM-Cre;Ripk1D138N/D138N小鼠中表型得到缓解(图四B和C)。同样的,在Ampka1fl/fl;LysM-Cre小鼠肝脏中p-S166 RIPK1+和TUNEL+细胞数量显著增加,促炎细胞因子的表达显著增加,但在Ampka1fl/fl;LysM-Cre;Ripk1D138N/D138N小鼠中则没有(图四D-H)。以上数据表明,抑制RIPK1活性可保护髓系Ampk KO小鼠的肝脏缺血再灌注损伤。
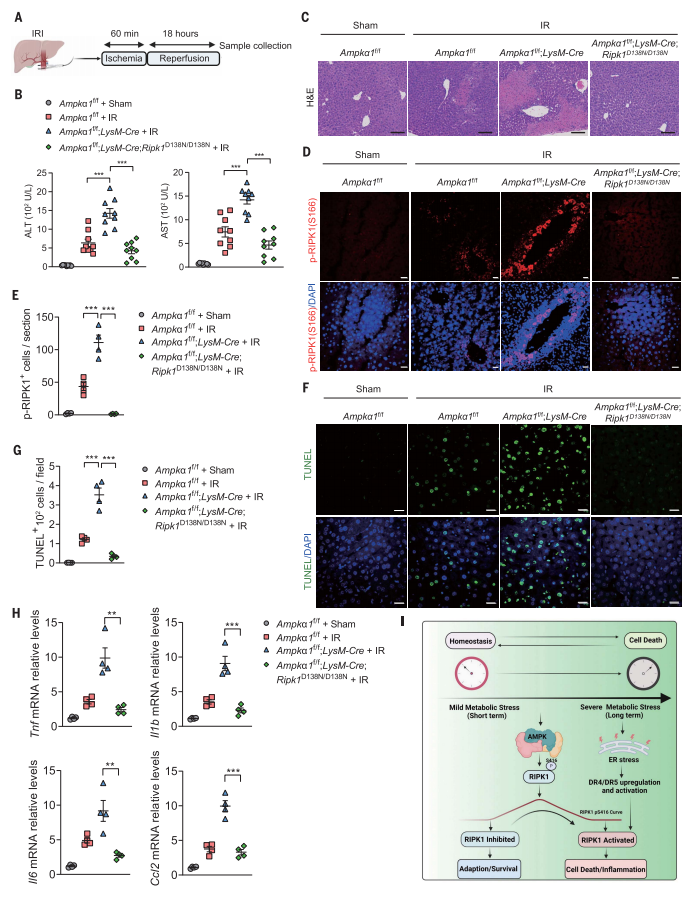
图四 抑制RIPK1活性可保护髓系Ampk KO小鼠免受肝脏缺血损伤[7]
综上所述,该研究阐明了RIPK1响应能量应激,调控细胞存活的新机制。短期的能量应激下,AMPK介导RIPK1 Ser416磷酸化,来抑制RIPK1的活性,进而抑制细胞死亡和炎症。但是当细胞长期暴露于能量应激时,AMPK介导的RIPK1 Ser416磷酸化作用减弱,促进了RIPK1的激活,使细胞从适应性稳态转变为死亡。此外,长期能量应激导致ATF4/CHOP依赖性上调和TRAIL受体DR4和DR5激活,从而促进RIPK1激活,最终导致细胞死亡和炎症(图四I)。AMPK介导的RIPK1 Ser416磷酸化代表了一个关键的代谢检查点,决定细胞对代谢应激的命运反应,并强调AMPK-RIPK1通路在整合代谢、细胞死亡和炎症中的重要作用。该研究扩展了人们对代谢和细胞死亡调节之间相互作用的理解,有助于开发用于预防缺血诱导的细胞死亡和组织损伤的治疗药物。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hardie DG: AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy. Nature reviews Molecular cell biology 2007, 8(10):774-785.
2. Green DR, Galluzzi L, Kroemer G: Cell biology. Metabolic control of cell death. Science 2014, 345(6203):1250256.
3. Yuan J, Amin P, Ofengeim D: Necroptosis and RIPK1-mediated neuroinflammation in CNS diseases. Nature reviews Neuroscience 2019, 20(1):19-33.
4. Mifflin L, Ofengeim D, Yuan J: Receptor-interacting protein kinase 1 (RIPK1) as a therapeutic target. Nature reviews Drug discovery 2020, 19(8):553-571.
5. Newton K, Wickliffe KE, Maltzman A, Dugger DL, Reja R, Zhang Y, Roose-Girma M, Modrusan Z, Sagolla MS, Webster JD et al: Activity of caspase-8 determines plasticity between cell death pathways. Nature 2019, 575(7784):679-682.
6. Tonnus W, Belavgeni A, Beuschlein F, Eisenhofer G, Fassnacht M, Kroiss M, Krone NP, Reincke M, Bornstein SR, Linkermann A: The role of regulated necrosis in endocrine diseases. Nature reviews Endocrinology 2021, 17(8):497-510.
7. Zhang T, Xu D, Trefts E, Lv M, Inuzuka H, Song G, Liu M, Lu J, Liu J, Chu C et al: Metabolic orchestration of cell death by AMPK-mediated phosphorylation of RIPK1. Science 2023, 380(6652):1372-1380.
8. Ofengeim D, Ito Y, Najafov A, Zhang Y, Shan B, DeWitt JP, Ye J, Zhang X, Chang A, Vakifahmetoglu-Norberg H et al: Activation of necroptosis in multiple sclerosis. Cell Rep 2015, 10(11):1836-1849.
9. Ma T, Tian X, Zhang B, Li M, Wang Y, Yang C, Wu J, Wei X, Qu Q, Yu Y et al: Low-dose metformin targets the lysosomal AMPK pathway through PEN2. Nature 2022, 603(7899):159-165.



