技术分享:PHD3羟基化CRTC2调控肝脏糖代谢的新机制
肝脏作为重要的内分泌器官,在糖代谢中发挥着维持机体血糖稳态的重要作用。肝脏糖异生的过度增加和葡萄糖的过多生成会导致高血糖和2型糖尿病。胰高血糖素与胰岛素的作用相反,是一种促进分解代谢的激素,具有很强的促进糖原分解和糖异生作用,使得血糖明显升高。胰高血糖素通过刺激cAMP依赖的蛋白激酶A(PKA)和cAMP反应元件结合蛋白(CREB)的磷酸化来促进肝葡萄糖产生。机制上,CREB与其调节的转录共激活因子CRTC家族蛋白相结合,并进一步结合到糖异生限速酶如磷酸烯醇式丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)启动子上的cAMP反应元件(CRE),促进这些酶的表达,来增强糖异生水平[1, 2]。CRTC2是在肝脏中表达量最高的CRTC家族成员,其翻译后修饰参与调控糖异生。在基础条件下,CRTC2被AMPK和盐诱导激酶(SIKs)在Ser171位点磷酸化,进而与14-3-3相互作用被隔离在细胞质中[3]。在胰高血糖素的诱导响应下,PKA介导抑制了AMPK和SIKs,促使CRTC2去磷酸化和发生核易位,使得CRTC2与磷酸化CREB在细胞核内结合,激活PEPCK和G6Pase转录[4]。
脯氨酸羟化酶(PHD)是一类在氧存在情况下使底物脯氨酸残基羟基化的酶,其介导的脯氨酸羟基化参与调节细胞对缺氧的适应。PHD3能够感应氧信号的变化来调节缺氧诱导因子(HIF)的羟基化水平。有报道称PHD3以HIF依赖的方式调节肝脏中的胰岛素敏感性[5]。然而,PHD3能否感应机体其他生理状态变化,并介导其他非HIF靶点的羟基化,来参与调控糖异生和糖代谢尚不清楚。
2023年5月,PNAS上报道了一项脯氨酸羟化酶PHD3通过羟基化CRTC2调控肝脏葡萄糖代谢的研究,发现PHD3是肝脏葡萄糖代谢的独特调节因子,作用于糖异生关键转录因子CRTC2的上游。在禁食状态下,PHD3通过羟基化CRTC2的P129和P615位点,增加了CRTC2核易位,进而与细胞核内CREB的结合增多,增强糖异生基因的转录和促进葡萄糖产生。PHD3介导的CRTC2羟基化可能代表肝脏糖异生的非经典CRTC2途径[6]。
首先,研究者探究PHD3能否感应机体的能量变化,评估禁食条件下小鼠肝脏中PHD3的表达,发现禁食后PHD3蛋白水平显著升高,并与激活的PKA信号通路和糖异生限速酶PEPCK的表达增加呈正相关(图一A)。腺苷酸环化酶激活剂Forskolin可以激活cAMP信号,采用Forskolin处理小鼠原代肝细胞以模拟禁食信号,也观察到PHD3蛋白表达上调(图一B),进一步添加PKA抑制剂H89逆转了PHD3的升高(图一C),确定了PKA与PHD3之间的直接关系。Tabula Muris数据库中小鼠肝脏单细胞转录组数据显示,PHD3、PEPCK和G6Pase都在肝细胞群中富集表达,提示PHD3可能响应禁食信号在调节肝脏葡萄糖代谢中发挥作用。研究者对此假设进行验证,构建了PHD3条件性敲除小鼠(PHD3 LKO),qPCR验证PHD3在肝脏中的特异性敲除(图一J和K)。丙酮酸耐受性试验表明,与WT小鼠相比,PHD3 LKO小鼠的空腹血糖和丙酮酸转化为葡萄糖的水平都显著降低(图一D和E)。禁食条件下,PHD3 LKO小鼠的PEPCK和G6Pase的表达也显著降低(图一F),而血浆中胰高血糖素和胰岛素水平没有变化(图一G和H),表明PHD3缺失造成糖异生的减少不是通过调节激素信号来介导的。研究者进一步确定PHD3缺失对肝脏糖异生的影响,使用cAMP反应元件荧光素酶(CRE-Luc)报告基因进行小鼠体内测试,发现与WT小鼠相比,禁食诱导的CRE-Luc活性在PHD3 LKO小鼠中显著减弱(图一I)。以上数据表明,肝细胞特异性PHD3缺失降低了肝脏对禁食信号的糖异生反应。
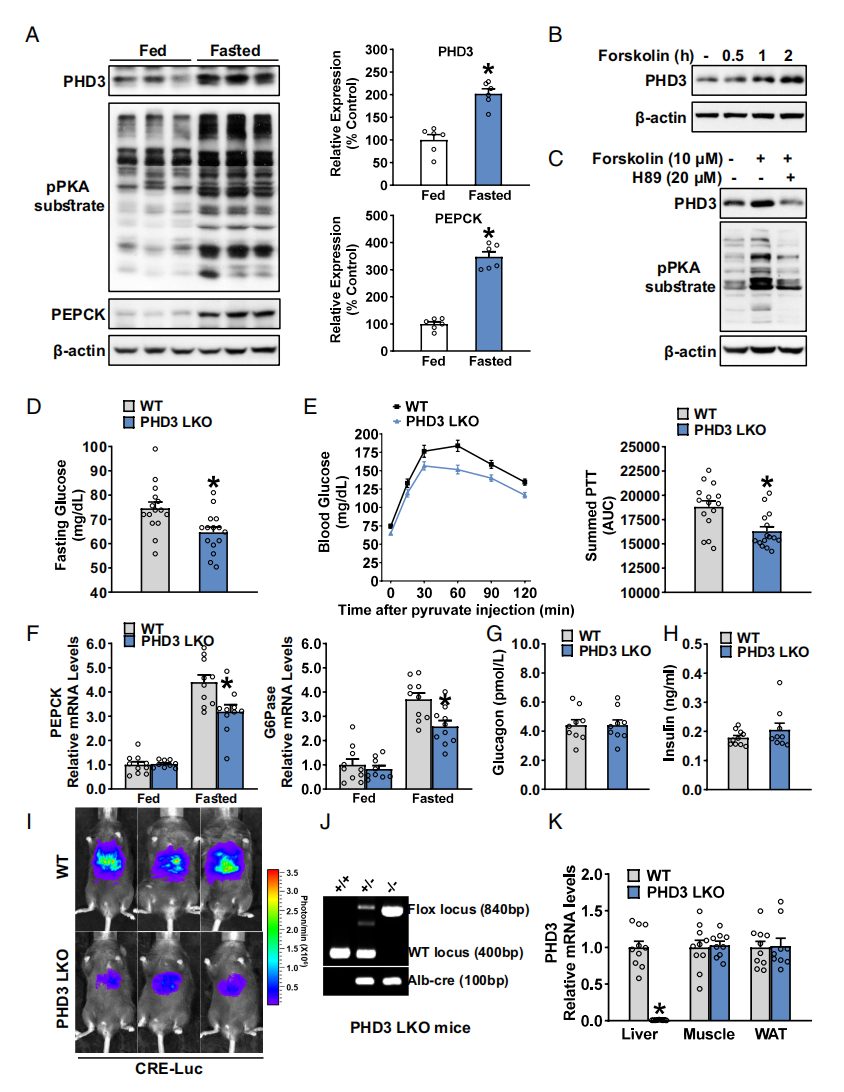
图一 肝细胞特异性PHD3缺失降低了禁食诱导的小鼠肝脏糖异生[6]
在体外实验发现,PHD3缺失导致活性形式的去磷酸化CRTC2的表达下调,以及非活性形式的磷酸化CRTC2的表达上调(图二A),导致Forskolin刺激的CRE-Luc报告基因活性显著降低(图二B)。在PHD3缺失的原代肝细胞和HEK293T细胞中,Forskolin诱导的CRTC2核易位减少(图二C和D),提示CRTC2可能在PHD3介导的糖异生调节中发挥作用。于是,研究者进行染色质免疫共沉淀测定,发现禁食导致WT小鼠肝脏中CRTC2在PEPCK和G6Pase启动子上的结合显著增加,而PHD3 LKO小鼠的这些结合作用被减弱(图二E)。肝细胞的PHD3缺失导致响应Forskolin或胰高血糖素刺激的糖异生基因表达和葡萄糖输出显著减少(图二F和G),说明PHD3以肝细胞自主的方式调节糖异生。以上数据表明,PHD3缺失抑制了CRTC2的核易位,并降低了肝细胞的葡萄糖产生。
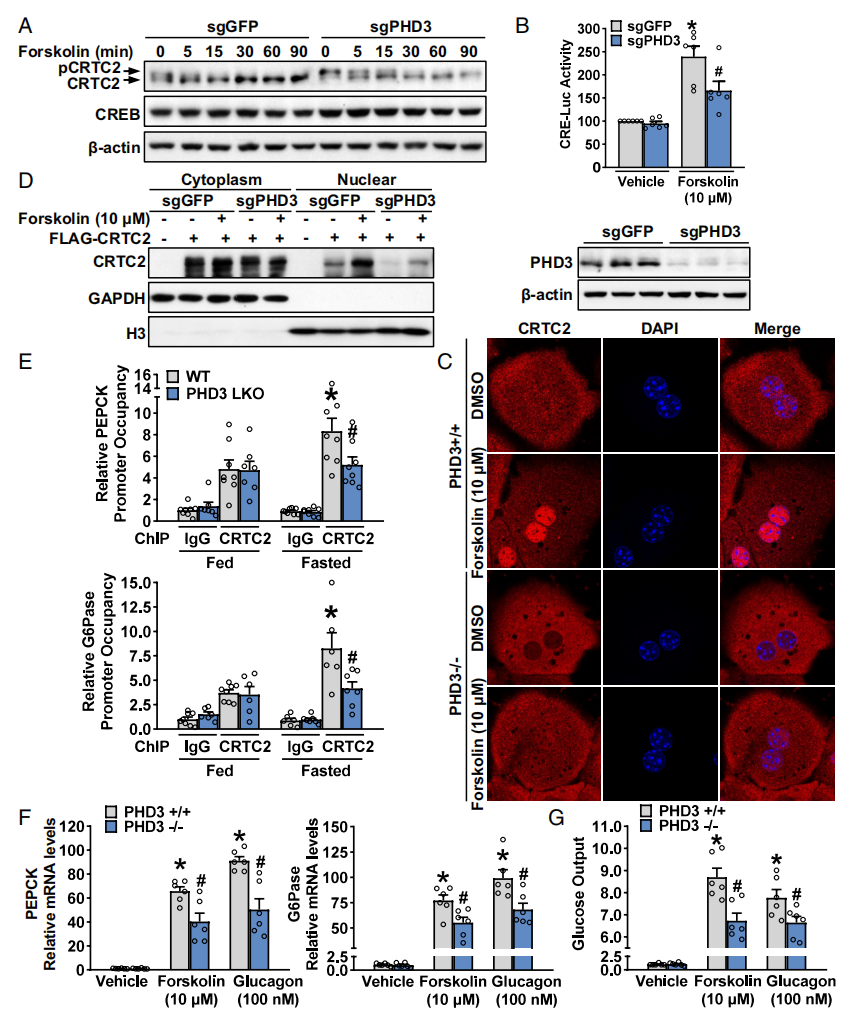
图二 PHD3缺失可抑制CRTC2核易位,降低肝细胞葡萄糖产生[6]
接下来,研究者测试PHD3对糖异生的刺激作用是否需要其脯氨酸羟化酶活性。构建了敲入PHD3的H196A突变造成肝脏特异性脯氨酸羟化酶活性缺陷的PHD3突变小鼠(PHD3 KI)[7],并进行Sanger测序验证PHD3 H196A 基因型点突变(图三G和H)。PHD3 KI小鼠在禁食期间的糖异生特征降低,包括禁食血糖、肝脏葡萄糖生成能力、糖异生基因表达和肝脏CRE-Luc报告基因活性(图三A-F),与PHD3 LKO小鼠的表型一致。进一步地,研究者在体外测定PHD3羟化酶活性调节糖异生的作用。PHD3诱导了CRE-Luc活性,但这一作用在PHD3 H196A中被减弱(图三I)。Forskolin刺激的CRE-Luc活性被脯氨酸羟化酶抑制剂DMOG所抑制(图三I)。在PHD3 H196A原代肝细胞中,观察到Forskolin或胰高血糖素刺激的糖异生基因表达和葡萄糖输出的显著减少(图三J和K)。以上数据表明,PHD3的脯氨酸羟化酶活性对于其响应禁食诱导的糖异生刺激作用是必要的。
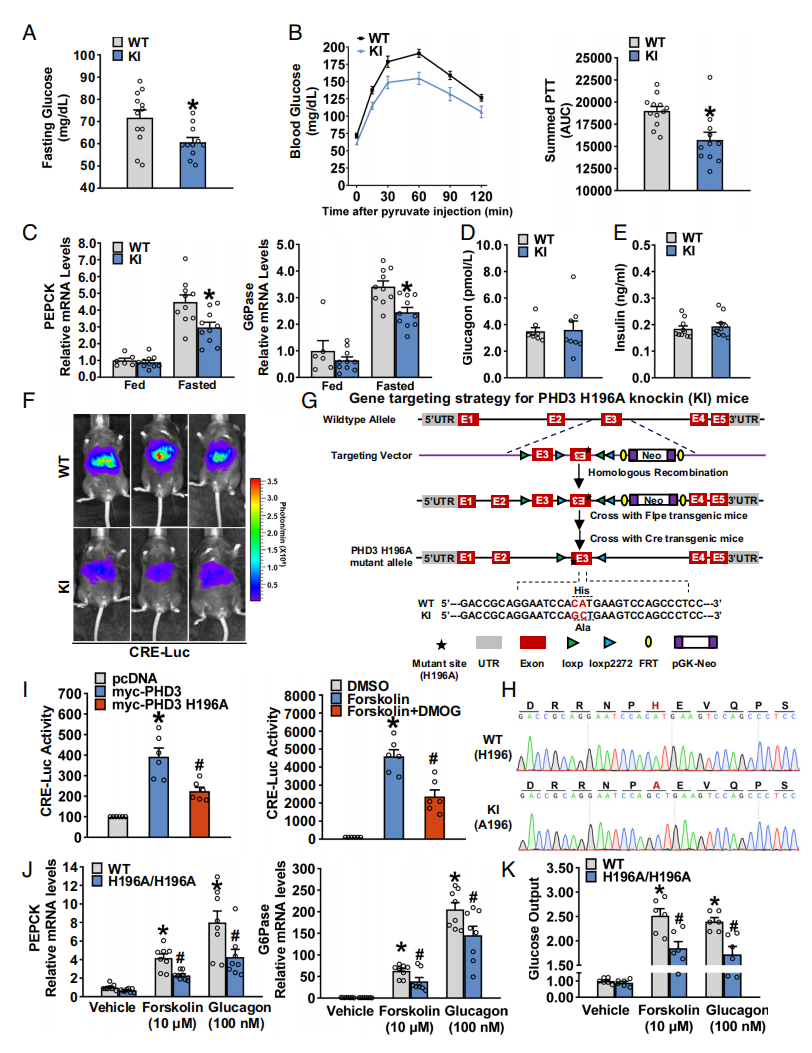
图三 PHD3的脯氨酸羟化酶活性对于禁食刺激小鼠糖异生至关重要[6]
鉴于PHD3缺失导致CRTC2的核易位和活性降低,研究者推测PHD3可能通过羟基化增强CRTC2的活性。采用Forskolin处理、过表达PKA或PHD3均可提高CRTC2的羟基化水平,且随着DMOG抑制羟化酶活性而减弱(图四A-C)。Forskolin在MEF中可诱导CRTC2的羟基化,但在PHD3−/− MEF中则不行(图四D),PHD3 H196A过表达同样不能增加CRTC2的羟基化(图四E),表明PHD3直接调节CRTC2羟基化。采用液相色谱串联质谱(LC-MS/MS)分析CRTC2,发现了6个候选的羟基化脯氨酸位点(图四F),其中Forskolin诱导的CRTC2羟基化仅被P129A和P615A突变体消除(图四G),这两个突变体的单突变和双突变(P2A)确实减弱了CRTC2的核易位(图四H),表明这两个位点是CRTC2核易位所必需的。仅有WT PHD3而不是H196A可增加CRTC2和CREB之间的相互作用(图四I),并且CRTC2 P2A双突变体与CREB的相互作用被减弱(图四J)。P2A双突变还显著降低了CRTC2对CRE-Luc活性的诱导(图四K)。以上数据表明,PHD3羟基化CRTC2的P129和P615位点是促进CRTC2核定位以及增加CRTC2-CREB复合物所必需的。
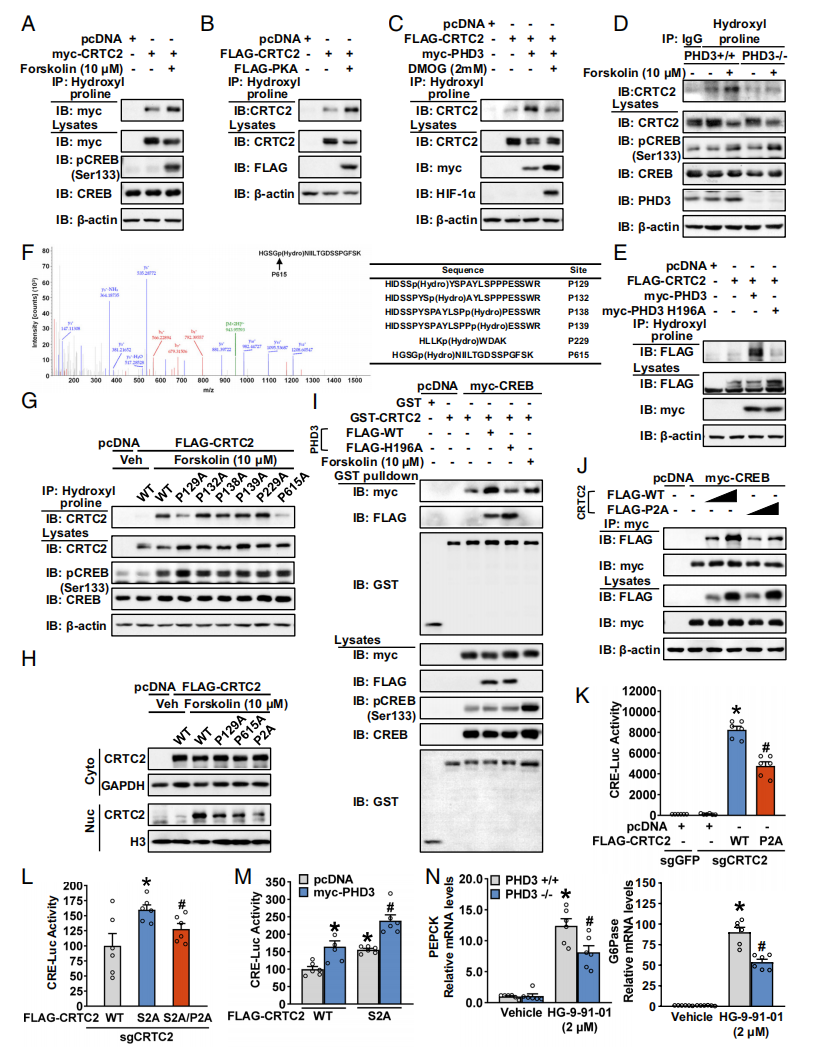
图四 PHD3羟基化CRTC2对于增强CRTC2与CREB结合以及糖异生是必要的[6]
已知小鼠CRTC2在S171和S275(对应人源S274)位点的去磷酸化促进其核易位和激活[8],研究者进一步探索CRTC2的羟基化和磷酸化之间对于其活性调节的相关性。双突变体S171A/S274A(S2A)可增强CRTC2诱导的CRE-Luc活性,但是被双突变体P2A减弱,并可被过表达PHD3叠加增强(图四L和M)。HG-9-91-01处理抑制SIK2,可诱导PEPCK和G6Pase的表达,但PHD3缺失会减弱这一作用(图四N)。以上数据表明,PHD3 介导的CRTC2羟基化,可增强CRTC2核易位、CRTC2结合CREB和肝脏糖异生,而这种CRTC2羟基化导致的核易位可能独立于CRTC2的磷酸化机制,提示可能代表了一种非典型的羟基化依赖的CRTC2通路。
最后,研究者探究了生理和病理条件下小鼠肝脏中CRTC2的羟基化水平。制备了P615脯氨酸羟基化特异性抗体(CRTC2 Pro615-OH),该抗体可特异性识别CRTC2 P615位点羟基化(图五F)。在禁食、高脂高糖(HFHS)饮食诱导、基因驱动的高血糖ob/ob小鼠肝脏中,P615羟基化CRTC2和PHD3表达均显著升高(图五A-C)。在人类肝脏样本中,糖尿病患者肝脏的P615羟基化CRTC2显著表达(图五D和E),并与PHD3和PEPCK的表达呈正相关。研究者还探究了PHD3与人类代谢紊乱的相关性,发现rs1680689的次要等位基因T与胰岛素和胰岛素抵抗指数(HOMA-IR)水平的降低显著相关,rs10148380的次要等位基因G和rs10151526的次要等位基因A与甘油三酯和胆固醇水平降低有关(图五G和H)。以上数据表明,PHD3介导的CRTC2羟基化可能在啮齿动物和人类的血糖稳态调控中均发挥重要作用。
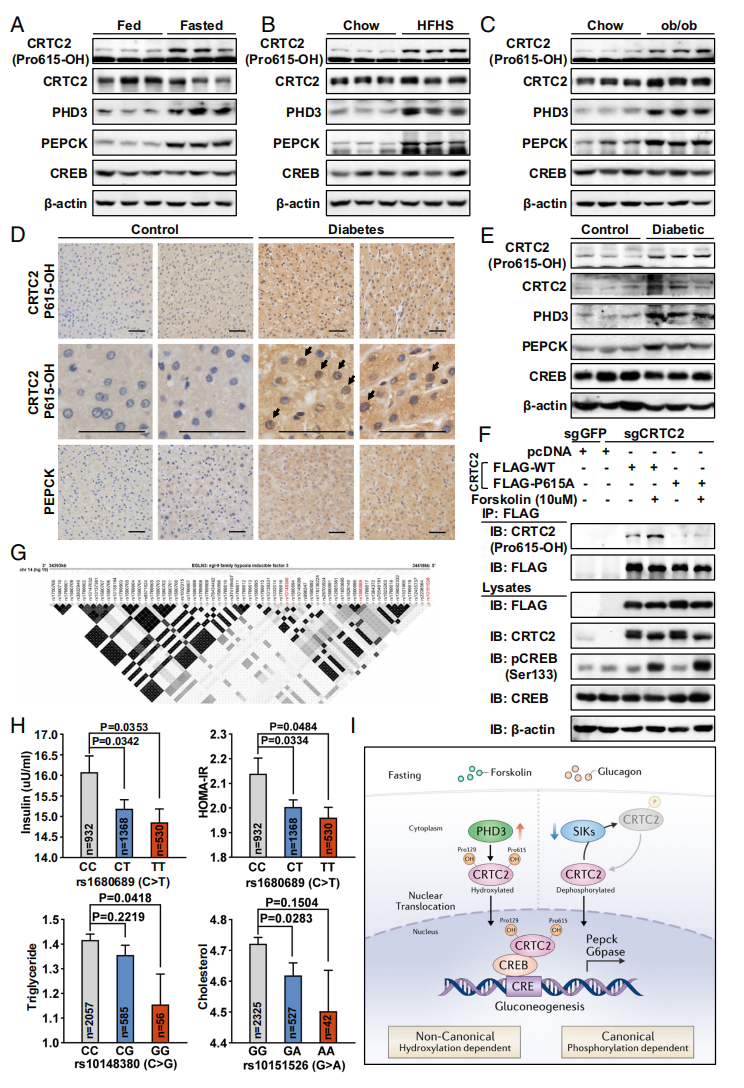
图五 羟基化CRTC2在禁食、糖尿病小鼠和人类肝脏中表达增加[6]
综上所述,该研究发现PHD3通过翻译后修饰在调节肝脏糖异生中起着独特的调节作用。机制上,PHD3与CREB共激活因子CRTC2特异性结合并羟基化P129和P615位点,这种CRTC2羟基化修饰增加了其核易位以及与CREB的结合,进而促进糖异生基因表达的转录增强(图五I)。CRTC2的PHD3依赖性羟基化揭示了一种CRTC2羟基化途径在调节肝脏糖异生和葡萄糖稳态中的全新机制,提出了有别于经典磷酸化依赖的非典型羟基化依赖CRTC2通路。该研究提示抑制肝脏PHD3活性或CRTC2羟基化可能为治疗高血糖和2型糖尿病提供了一种新途径。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Lin HV, Accili D: Hormonal regulation of hepatic glucose production in health and disease. Cell Metab 2011, 14(1):9-19.
2. Habegger KM, Heppner KM, Geary N, Bartness TJ, DiMarchi R, Tschop MH: The metabolic actions of glucagon revisited. Nat Rev Endocrinol 2010, 6(12):689-697.
3. Koo SH, Flechner L, Qi L, Zhang X, Screaton RA, Jeffries S, Hedrick S, Xu W, Boussouar F, Brindle P et al: The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism. Nature 2005, 437(7062):1109-1111.
4. Salminen A, Kaarniranta K, Kauppinen A: Age-related changes in AMPK activation: Role for AMPK phosphatases and inhibitory phosphorylation by upstream signaling pathways. Ageing research reviews 2016, 28:15-26.
5. Taniguchi CM, Finger EC, Krieg AJ, Wu C, Diep AN, LaGory EL, Wei K, McGinnis LM, Yuan J, Kuo CJ et al: Cross-talk between hypoxia and insulin signaling through Phd3 regulates hepatic glucose and lipid metabolism and ameliorates diabetes. Nat Med 2013, 19(10):1325-1330.
6. Xue Y, Cui A, Wei S, Ma F, Liu Z, Fang X, Huo S, Sun X, Li W, Hu Z et al: Proline hydroxylation of CREB-regulated transcriptional coactivator 2 controls hepatic glucose metabolism. Proc Natl Acad Sci U S A 2023, 120(23):e2219419120.
7. Lee S, Nakamura E, Yang H, Wei W, Linggi MS, Sajan MP, Farese RV, Freeman RS, Carter BD, Kaelin WG, Jr. et al: Neuronal apoptosis linked to EglN3 prolyl hydroxylase and familial pheochromocytoma genes: developmental culling and cancer. Cancer Cell 2005, 8(2):155-167.
8. Hogan MF, Ravnskjaer K, Matsumura S, Huising MO, Hull RL, Kahn SE, Montminy M: Hepatic Insulin Resistance Following Chronic Activation of the CREB Coactivator CRTC2. J Biol Chem 2015, 290(43):25997-26006.



