技术分享:双向潜能肝脏祖细胞的发现及其促进肝脏再生机制
肝脏通过其两个上皮细胞区室发挥代谢、内分泌和分泌功能。肝细胞代谢营养物质和外源性物质,生产与回收利用蛋白质,并产生胆汁酸。胆管细胞(BEC)构成胆管网络,负责收集胆汁并将其运输到肠道,从而支持代谢产物的排泄和消化[1]。维持一个功能性肝细胞池对于稳态维持以及在损伤反应期间保证肝脏功能至关重要。先前的遗传谱系示踪研究表明,肝细胞池主要通过原先存在肝细胞的自我更新来补充,而不是由肝干/祖细胞的分化来补充[2]。胆管细胞同样能够在导管反应的再生过程中进行自我增殖并产生胆管[3]。当小鼠肝细胞衰老或者肝细胞介导的肝脏再生修复受损时,胆管细胞可以转分化为肝细胞,进而参与肝脏再生[4]。慢性肝病和肝硬化患者普遍存在肝细胞衰老和肝脏再生受损的现象,因此将胆管细胞转分化为肝细胞可能是一种重要的修复机制,可用于开发新的治疗方法。然而,这种具有组织干细胞潜能的胆管细胞的细胞特征,及其肝细胞转分化机制尚不清楚。
2023年3月,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组和诺华生物医学研究所Jan S. Tchorz研究组合作,以封面故事在Nature Genetics期刊发表了一项研究,鉴定出一群具有双向分化潜能的过渡性肝脏祖细胞(TLPC)[5]。它起源于胆管细胞,并在肝脏严重损伤后的再生过程中分化为肝细胞或胆管细胞。TLPC在胆管细胞转分化过程中短暂出现,呈现过渡性状态。机制上,Notch和WNT/β-catenin信号通路分别调控胆管细胞向TLPC、TLPC向肝细胞的分化。该研究为胆管细胞转分化介导的肝细胞再生提供了重要的细胞类型和机制线索,对肝脏相关疾病的治疗具有重大意义[5]。
首先,研究者构建CK19-CreER;Fah-LSL/LSL;R26-tdT小鼠损伤模型来研究胆管细胞向肝细胞的转分化。该小鼠模型具有Fah缺失的常见病理表型,表现为肝功能衰竭和肝细胞介导的再生受损,但使用NTBC药物治疗可以维持正常生活。并且在他莫昔芬(TAM)诱导Cre-loxP重组后,该小鼠模型的胆管细胞中特异性恢复表达FAH,并标记上tdTomato(tdT)。NTBC的撤药促使胆管细胞向肝细胞转分化,研究者对撤药后25天的EPCAM+细胞进行scRNA-seq(图一a),并与不能实现转分化的DDC饮食诱导肝损伤小鼠的EPCAM+细胞进行比较。利用统一流形逼近和投影(UMAP)技术在该小鼠模型中鉴定出多个EPCAM+细胞群(图一b和c),其中一个亚群富集了增殖标记物Cdk1和Mki67,与DDC损伤后观察到的导管反应增殖一致(图一d)。此外,还鉴定出同时表达胆管细胞标记物Epcam和肝细胞标记物(Hnf4α和Ttr)的胆管细胞亚群(图一b和c),而DDC损伤小鼠模型中不存在这种亚群(图一d)。这种细胞亚群仅存在于具有衰老肝细胞和胆管细胞向肝细胞转分化的小鼠中,研究者将该细胞亚群命名为肝脏祖细胞(LPC)。胆管细胞标记物EPCAM、CK19、A6、OPN和肝细胞标记物HNF4α的免疫染色显示,LPC只在该小鼠模型中出现(图一e),DDC损伤小鼠中则没有(图一f)。随后,研究者对LPC和胆管细胞的基因表达谱进行分析,发现400多个差异表达基因(图一g)。基因集富集分析(GSEA)显示,大多数LPC上调的基因主要与肝细胞功能有关,如羧酸代谢过程、谷胱甘肽代谢过程、脂肪酸代谢过程、解毒和脂质转运(图一h);而下调的基因主要富集在Hippo信号通路及Notch下游基因(图一g)。研究者评估严重肝损伤患者中是否也存在CK19+ HNF4α+细胞。在酒精性脂肪性肝炎(ASH)肝硬化患者的肝脏中检测到大量p21+肝细胞,表明肝细胞实质性衰老,损伤严重(图一i-k)。与健康肝脏相比,ASH肝硬化患者肝脏显示CK19+细胞具有核HNF4α+染色(图一j和l)。并且在11种肝病适应症中,肝细胞衰老与CK19+ HNF4α+ LPC呈正相关;与非肝硬化较轻患者相比,肝硬化患者的p21+肝细胞和LPC的百分比明显更高(图一m)。以上数据表明,LPC在多种肝脏疾病的衰老肝细胞中十分常见。
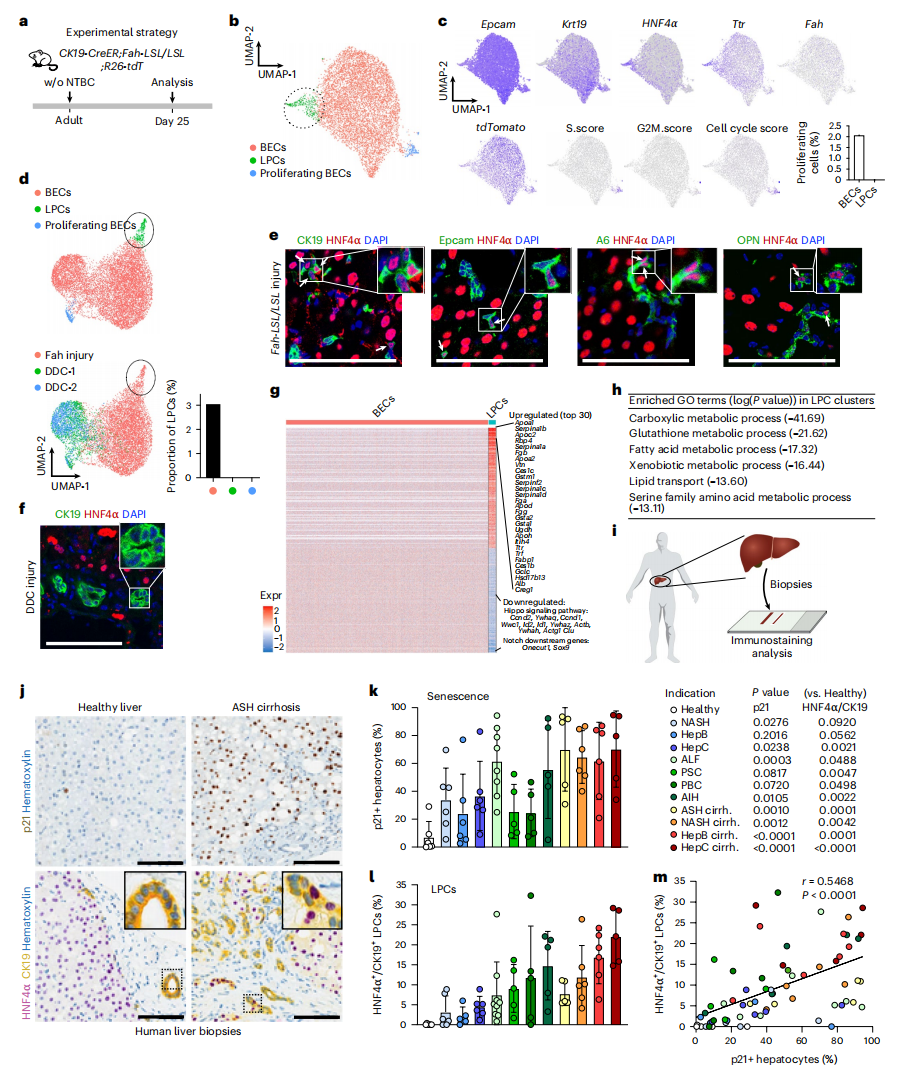
图一 损伤肝脏中肝脏祖细胞的鉴定[5]
随后,研究者表征LPC及其在肝脏再生中的动态。对单细胞转录组测序数据进行拟时序分析,动态轨迹显示了从胆管细胞到LPC的转变(图二a)。对CK19-CreER;Fah-LSL/LSL;R26-tdT小鼠给药TAM以特异性标记胆管细胞,NTBC撤药后25天和33天收集肝脏进行分析(图二b)。免疫荧光结果显示,在撤药后第25天,谱系标记的tdT+ LPC同时表达胆管细胞标记物和肝细胞标记物(图二c),表明LPC来源于胆管细胞。而撤药后第33天几乎没有发现LPC,只检测到了tdT+肝细胞(图二c),表明LPC在转分化过程中处于短暂或过渡状态。因此,研究者认为这群LPC是过渡性肝脏祖细胞(TLPC)。CK19+ HNF4α+ TLPC在第25天没有获得成熟的肝细胞标志物如FAH,而tdT+肝细胞在第33天表达FAH,同时不再表达CK19(图二d)。TLPC在第25天处于静止未增殖的状态,而在第33天时tdT+肝细胞增殖显著(图二e),表明转分化的肝细胞有助于肝脏再生。研究者进一步分析转分化过程中不同时间点的谱系标记胆管细胞、TLPC和肝细胞的表达谱和数量。结果显示,谱系标记的细胞具有不同的标记物表达模式:CK19+ HNF4α-(胆管细胞)、CK19+ HNF4α+(TLPC,1期)、CK19low HNF4α+(TLPC,2期)和CK19- HNF4α+(肝细胞,图二f)。随着TLPC分化为肝细胞,细胞大小逐渐增大(图二g)。量化细胞数量结果显示,1期TLPC在第25天显著富集,而2期TLPC在第28天,HNF4α+ tdT+ 肝细胞在第33天显著富集(图二h)。以上数据表明,胆管细胞通过TLPC逐渐转分化为肝细胞,TLPC在转分化过程中短暂出现,处于过渡状态,整个转分化过程呈现出谱系标记基因表达的动态变化(图二i)。
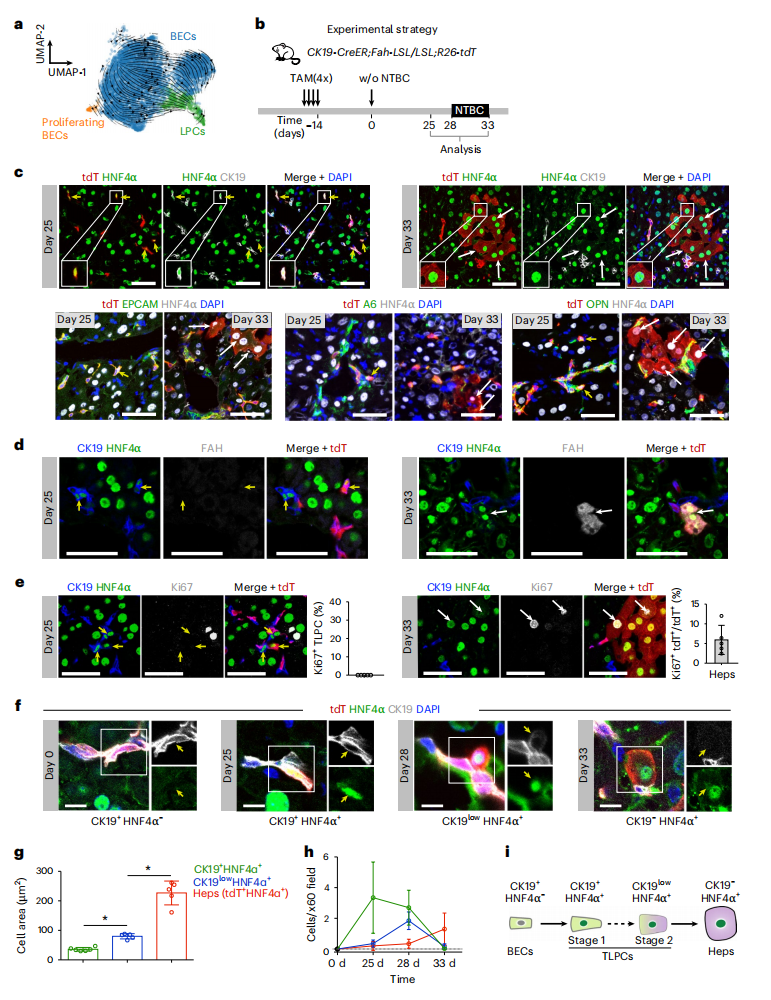
图二 LPC是胆管细胞转分化为肝细胞过程中的过渡细胞状态[5]
接下来,研究者验证CK19+ HNF4α+ TLPC是否具有双向分化潜能。开发了一种基于Cre-loxP和Dre-rox的双遗传谱系示踪方法来永久标记CK19+ HNF4α+ TLPC(1期),构建CK19-CreER;HNF4a-DreER;Fah-LSL/LSL;R26-RL-tdT小鼠模型(图三a)。在NTBC撤药后20天用低剂量的TAM进行处理,并在25天和7周时收集肝脏(图三b)。结果显示,25天时,tdT+细胞分散在门静脉区域,88.61±3.80%的tdT+细胞为TLPC,8.91±2.19%的tdT+细胞为胆管细胞,2.48 ±3.48%的tdT+细胞为肝细胞(图三c)。没有一个tdT+ TLPC是Ki67阳性,证实TLPC处于未增殖的静止状态(图三d)。对照小鼠中均未检测到tdT+细胞(图三e),证实R26-RL-tdT只能通过双重重组激活。接下来,研究者取低剂量TAM处理后7周肝脏评估TLPC随时间的谱系转化潜力,并进行克隆分析。结果显示,在实验小鼠肝脏中观察到零星的tdT+克隆,对照小鼠肝脏中没有(图三f)。tdT+克隆由CK19- HNF4α+肝细胞或CK19+ HNF4α− 胆管细胞组成,未发现CK19+ HNF4α+ TLPC(图三g和h)。对照小鼠肝切片中未发现tdT+细胞(图三i)。其中60.14 ± 10.80%的tdT+克隆为胆管细胞克隆,39.86 ± 10.80%的tdT+克隆是肝细胞克隆(图三j),表明TLPC具有双向分化潜能,在肝脏再生过程中可以分化为胆管细胞或肝细胞。没有一个单独的tdT+克隆同时由肝细胞和胆管细胞组成(图三k)。所有tdT+肝细胞都表达FAH(图三l),不表达p21(图三m),其增殖率显著高于tdT-肝细胞(图三n)。以上数据表明,在肝脏再生过程中,具有双向分化潜能的TLPC可以分化为肝细胞或重新分化为胆管细胞。
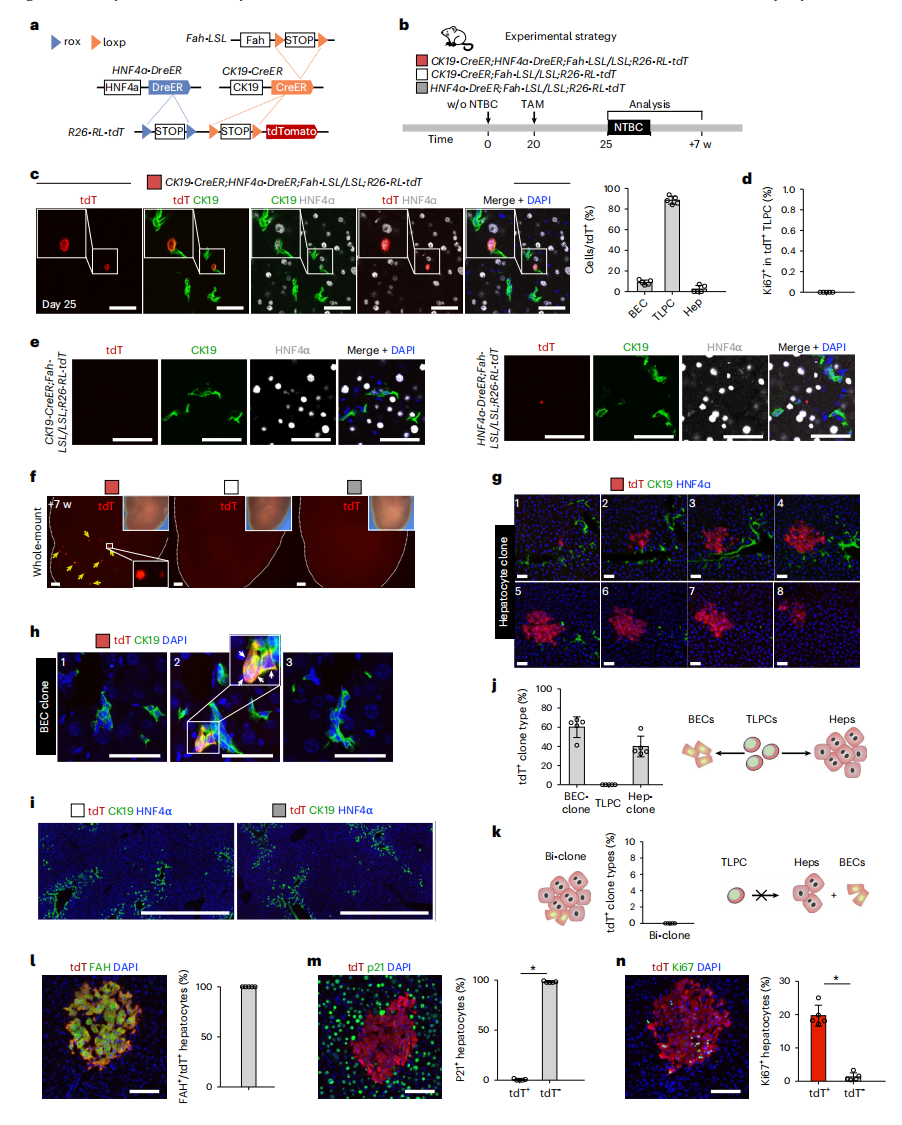
图三 在肝脏再生过程中TLPC具有双向分化潜能[5]
来自CK19-CreER;Fah-LSL/LSL;R26-tdT小鼠的scRNA-seq数据显示,与胆管细胞相比,Notch靶基因如Onecut1和Sox9在TLPC中显著减少(图一g),表明Notch活性降低可能促进TLPC的激活。为验证这一假设,研究者在胆管细胞中缺失Rbpj以阻断Notch信号传导,构建CK19-2A-CreER;Fah-LSL/LSL;R26-GFP;Rbpjfl/fl小鼠(Rbpjfl/fl,图四a)。与对照组小鼠相比,Rbpjfl/fl小鼠胆管细胞中的Rbpj表达显著降低(图四b),两组之间的GFP+胆管细胞比例没有明显区别(图四g),但Rbpjfl/fl小鼠的TLPC数量显著增加(图四c和d),且在撤药后7周,GFP+胆管细胞来源的肝细胞数量显著增加(图四e-g),而两组之间的GFP+肝细胞的增殖效率没有明显区别(图四h)。以上数据表明,抑制Notch信号通路可促进胆管细胞转化为TLPC,进而增加胆管细胞向肝细胞的转分化。
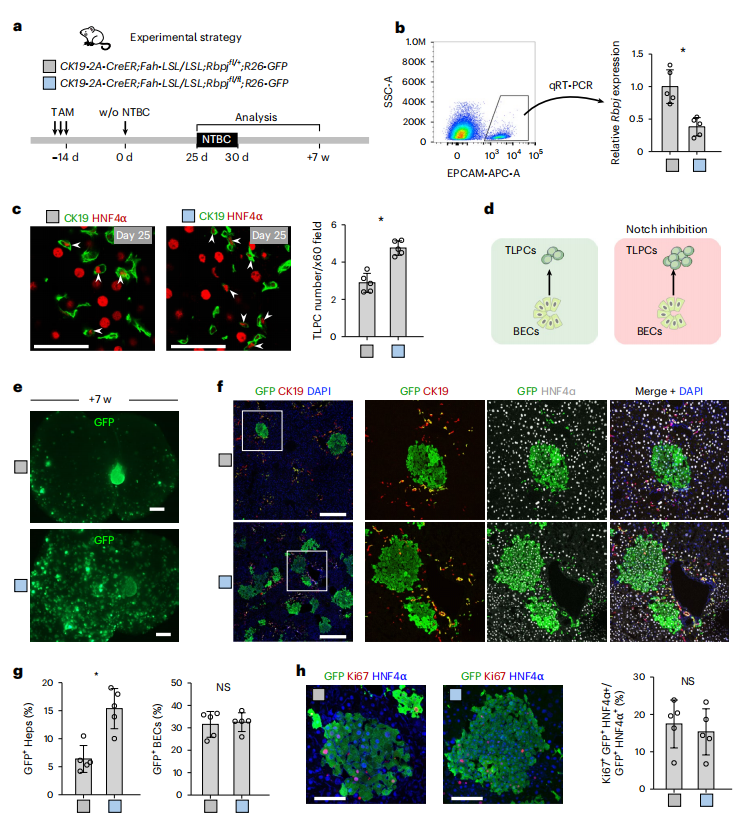
图四 抑制Notch信号通路促进TLPC的激活[5]
进一步,研究者评估激活Notch信号通路是否会抑制胆管细胞转变为TLPC。构建Notch胞内结构域过表达的CK19-2A-CreER;Fah-LSL/LSL;R26-NICD-GFP小鼠,并在撤药后25天收集肝脏进行分析(图五a)。结果显示,NICD过表达后TLPC数量显著减少,胆管细胞的密度和增殖显著增加(图五b-e)。分选EPCAM+细胞,与对照小鼠相比,代表Notch信号和指示细胞增殖的基因显著富集,而肝细胞基因的表达显著降低(图五f)。在撤药后7周,NICD过表达小鼠肝脏中未检测到GFP+肝细胞,胆管细胞的密度和增殖显著增加(图五g和h)。以上数据表明,激活Notch信号通路抑制了胆管细胞转变为TLPC,促进胆管细胞的增殖,而抑制肝细胞的生成(图五i)。
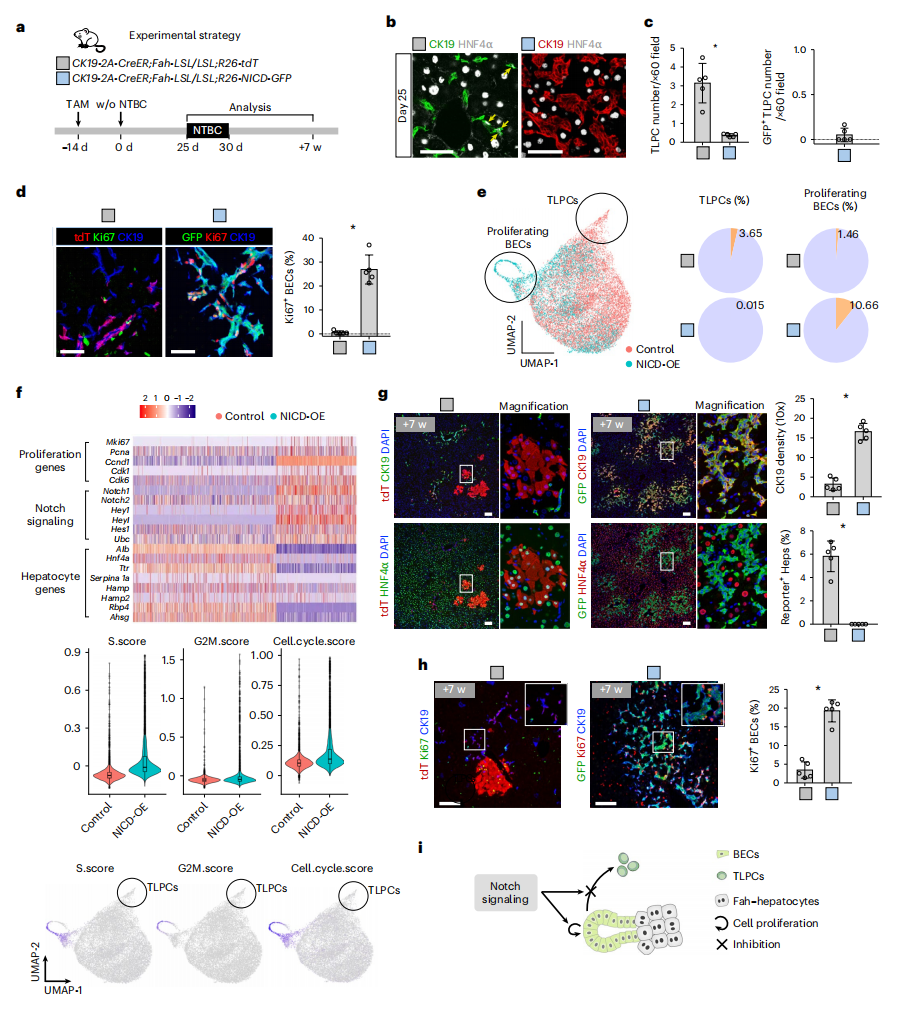
图五 Notch信号通路的激活抑制了胆管细胞转变为TLPC[5]
对撤药后28天的CK19-CreER;Fah-LSL/LSL;R26-tdT小鼠肝脏的tdT+细胞进行scRNA-seq分析,显示WNT/β-catenin信号通路靶基因Lect2、Cyp2e1和Cyp1a2,在TLPC来源的肝细胞和TLPC的亚群中高度富集(图六a-e)。于是,研究者推测WNT/β-catenin信号可能在肝脏再生过程中促进TLPC向肝细胞的分化。研究者对此进行验证,构建CK19-2A-CreER;Fah-LSL/LSL;Ctnnb1fl/fl,R26-Confetti小鼠,TAM诱导WNT/β-catenin信号传导丧失,同时在胆管细胞中表达Confetti报告基因(图六f)。在撤药后25天和7周时收集小鼠肝脏,结果显示,实验组小鼠胆管细胞中β-catenin表达缺失(图六g),和对照小鼠之间的CK19+ HNF4α+ TLPC数量没有明显区别(图六h),表明胆管细胞对TLPC的诱导不需要WNT/β-catenin信号。与对照小鼠相比,7周时实验组小鼠中胆管细胞衍生的肝细胞数量显著减少(图六i),而两组之间的CK19+细胞丰度相似(图六j)。以上数据表明,在肝脏再生过程中,WNT/β-catenin信号传导在TLPC高效分化为肝细胞过程中是不可缺少的(图六k)。
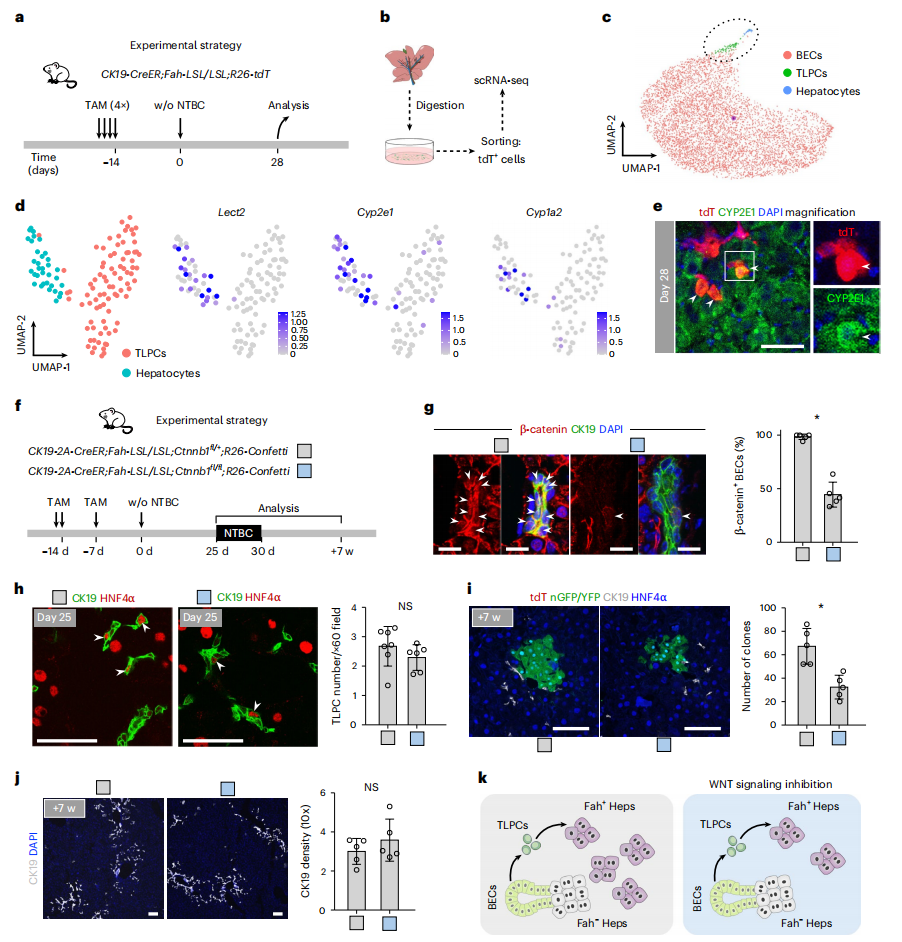
图六 WNT/β-catenin信号传导缺失抑制TLPC向肝细胞分化[5]
最后,研究者验证激活WNT/β-catenin信号传导是否促进肝脏再生过程中的肝细胞转分化。构建CK19-2A-CreER;Fah-LSL/LSL;Ctnnb1lox(ex3)/+;R26-Confetti小鼠(Ctnnb1lox(ex3)/+),TAM诱导Ctnnb1 的3号外显子缺失导致β-catenin稳定表达,同时在胆管细胞中表达Confetti报告基因(图七a)。与对照小鼠相比,实验组小鼠胆管细胞中的核内β-catenin表达显著增加(图七b);且撤药后21天,TLPC数量显著增加(图七c)。分离两组的EPCAM+细胞进行scRNA-seq分析发现,与对照小鼠相比,Ctnnb1lox(ex3)/+小鼠的TLPC显著增加(图七d)。WNT/β-catenin是一种增殖相关的信号通路[6],但在实验组小鼠的胆管细胞中,细胞周期相关基因的表达并没有增加,而代谢酶和其他肝细胞基因的表达却有显著升高(图七e)。研究者在Ctnnb1lox(ex3)/+小鼠中鉴定出两个新的细胞亚群,BEC-2和TLPC-2,两者都显著富集了代谢相关基因(图七d和f)。实验组小鼠中TLPC亚群的肝细胞功能相关基因的表达水平显著高于对照小鼠(图七g)。撤药后7周,实验组小鼠中胆管细胞来源的肝细胞数量显著增加(图七h)。以上数据表明,WNT/β-catenin信号传导的激活可促进胆管细胞向TLPC和TLPC向肝细胞的分化。
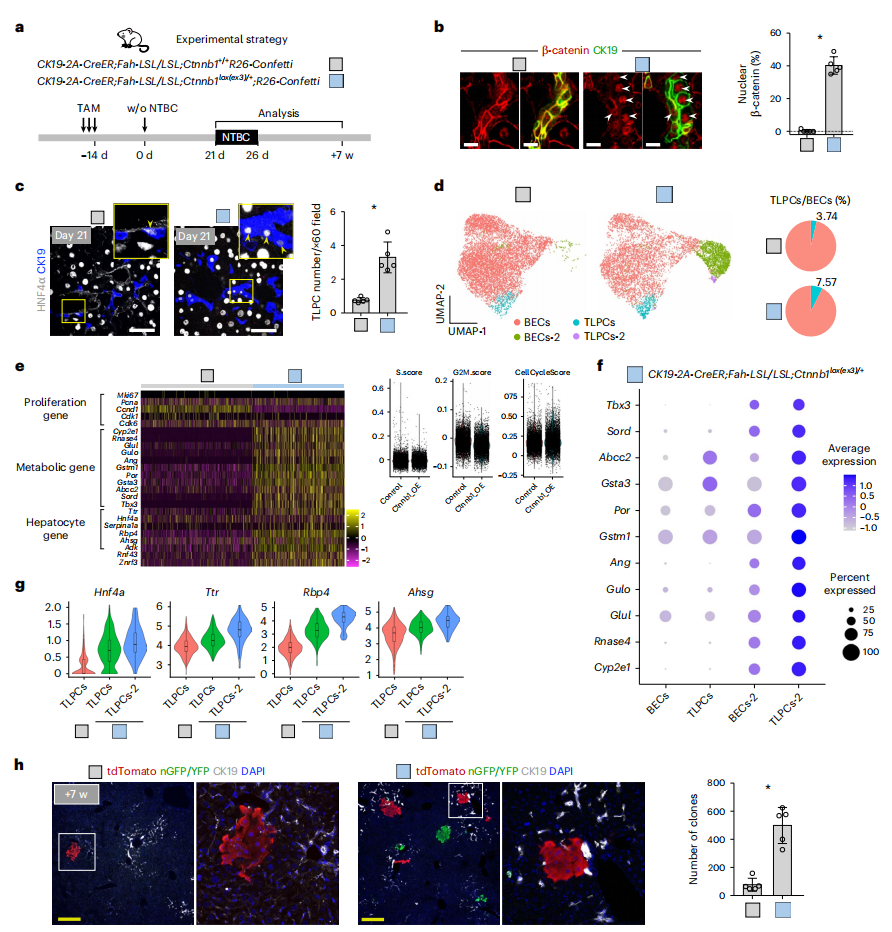
图七 WNT/β-catenin信号传导的激活促进TLPC向肝细胞的分化[5]
综上所述,研究者利用单细胞RNA测序和双同源重组酶介导的谱系示踪技术鉴定出一群起源于胆管细胞的肝脏祖细胞TLPC。TLPC同时表达胆管细胞和肝细胞标记基因,在胆管细胞转分化过程中呈过渡状态。TLPC具有双向分化潜能,在肝脏再生过程中分化为肝细胞或胆管细胞。WNT/β-catenin和Notch信号通路协调了胆管细胞-TLPC-肝细胞的逐步转化过程。Notch信号的抑制增强了胆管细胞转变为TLPC,WNT/β-catenin信号传导的激活促进了TLPC向肝细胞的分化(图八)。该研究揭示了胆管细胞转分化为肝细胞的细胞及分子调控机制,为肝脏祖细胞诱导产生肝细胞治疗肝脏疾病的临床转化应用提供新的理论基础和研究思路。
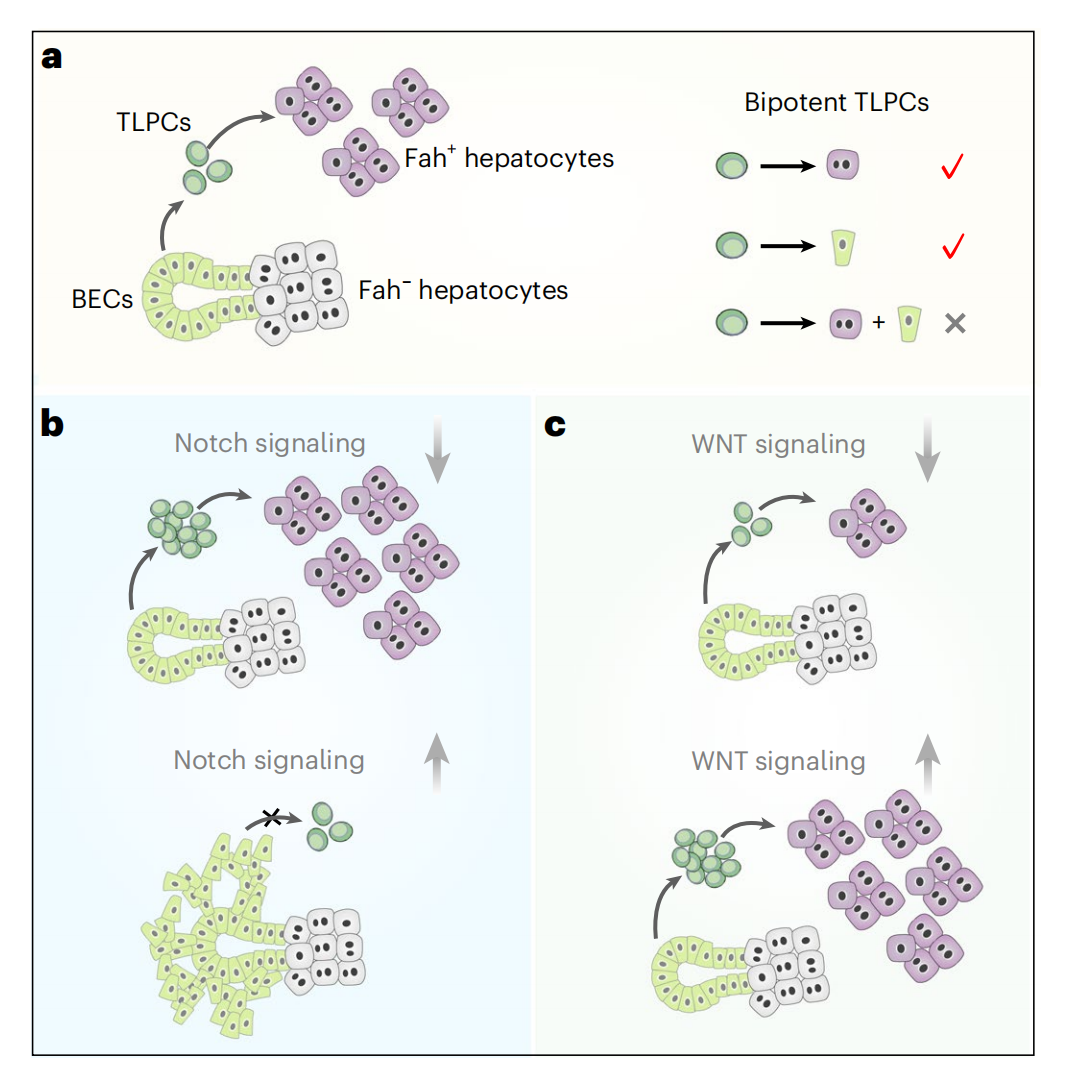
图八 双向分化潜能TLPC有助于肝脏再生[5]

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Stanger BZ: Cellular homeostasis and repair in the mammalian liver. Annual review of physiology 2015, 77:179-200.
2. Tarlow BD, Pelz C, Naugler WE, Wakefield L, Wilson EM, Finegold MJ, Grompe M: Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell stem cell 2014, 15(5):605-618.
3. Kamimoto K, Kaneko K, Kok CY, Okada H, Miyajima A, Itoh T: Heterogeneity and stochastic growth regulation of biliary epithelial cells dictate dynamic epithelial tissue remodeling. Elife 2016,5:e15034.
4. Español-Suñer R, Carpentier R, Van Hul N, Legry V, Achouri Y, Cordi S, Jacquemin P, Lemaigre F, Leclercq IA: Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice. Gastroenterology 2012, 143(6):1564-1575.e1567.
5. Pu W, Zhu H, Zhang M, Pikiolek M, Ercan C, Li J, Huang X, Han X, Zhang Z, Lv Z et al: Bipotent transitional liver progenitor cells contribute to liver regeneration. Nature genetics 2023, 55(4):651-664.
6. Russell JO, Monga SP: Wnt/β-Catenin Signaling in Liver Development, Homeostasis, and Pathobiology. Annual review of pathology 2018, 13:351-378.



