技术分享:运动通过FN1-α5β1整合素途径激活肝脏自噬及改善全身代谢
体育运动有益于改善慢性疾病,包括2型糖尿病(T2D)、心血管疾病和代谢综合征[1]。运动时肌肉收缩有助于肌肉塑形和功能协调,更重要的是可以系统性改善许多非收缩组织的功能。然而,运动引起全身代谢受益的分子机制还不清晰,这限制了开发新的代谢紊乱干预治疗措施。自噬是一种重要的溶酶体降解途径,通过自噬体囊泡与溶酶体的融合,分解并回收再利用受损的或不必要的细胞内结构[2]。在正常情况下,自噬发生在一个较低的基线水平,其活性可被禁食等多种应激源所诱导,运动也是人类和啮齿类动物激活骨骼肌自噬的有力诱导剂[3]。有趣的是,除了收缩性肌肉外,运动还能系统性激活非收缩组织的自噬,包括肝脏、胰腺和脂肪组织[4]。不同的是,在运动过程中,非收缩组织不会有着像肌肉一样的自噬应激源诱导,如能量应激、氧化应激和细胞内Ca2+增加[5, 6]。那么,在运动期间及运动后的非收缩组织中,自噬是如何被激活的,其功能和生理作用又是怎样的,尚未可知。
2023年2月,Cell Metabolism上报道了一项研究,发现FN1-α5β1整合素通路可以调节运动诱导的肌肉-肝脏通信、激活自噬和改善全身代谢。纤维连接蛋白FN1是一种由运动诱导肌肉分泌的循环因子,通过肝脏受体α5β1整合素和下游IKKα/β-JNK1-BECN1途径激活肝脏自噬,促进运动诱导的全身胰岛素敏感性增强[7]。
首先,研究者探索运动诱导自噬的组织特异性功能。通过静脉注射AAV2/8,将肝细胞特异性TBG启动子驱动mCherry-miR30-shATG7递送至野生型(WT)小鼠中,构建了自噬基因ATG7肝细胞特异性敲降(KD)小鼠ATG7Δliver(图一A)。在常规饮食(RD)下,ATG7Δliver与对照小鼠有着相似的体重、正常的糖耐量和轻微胰岛素不耐受。在同时进行高脂饮食(HFD)和每日运动后,两组小鼠的体重(图一B)、运动耐力、肝脏和肌肉组织重量相当,但ATG7Δliver小鼠未能显示出运动诱导的葡萄糖耐受(GTT)和胰岛素敏感(ITT)的改善(图一C),表明破坏肝脏特异性自噬损害了运动诱导的胰岛素敏感性。此外,通过蛋白质印迹检测胰岛素受体下游的Akt磷酸化,结果显示运动并不能增强ATG7Δliver小鼠肝脏胰岛素信号通路(图一D)。以上数据表明,肝脏自噬激活对运动诱导的代谢益处至关重要。
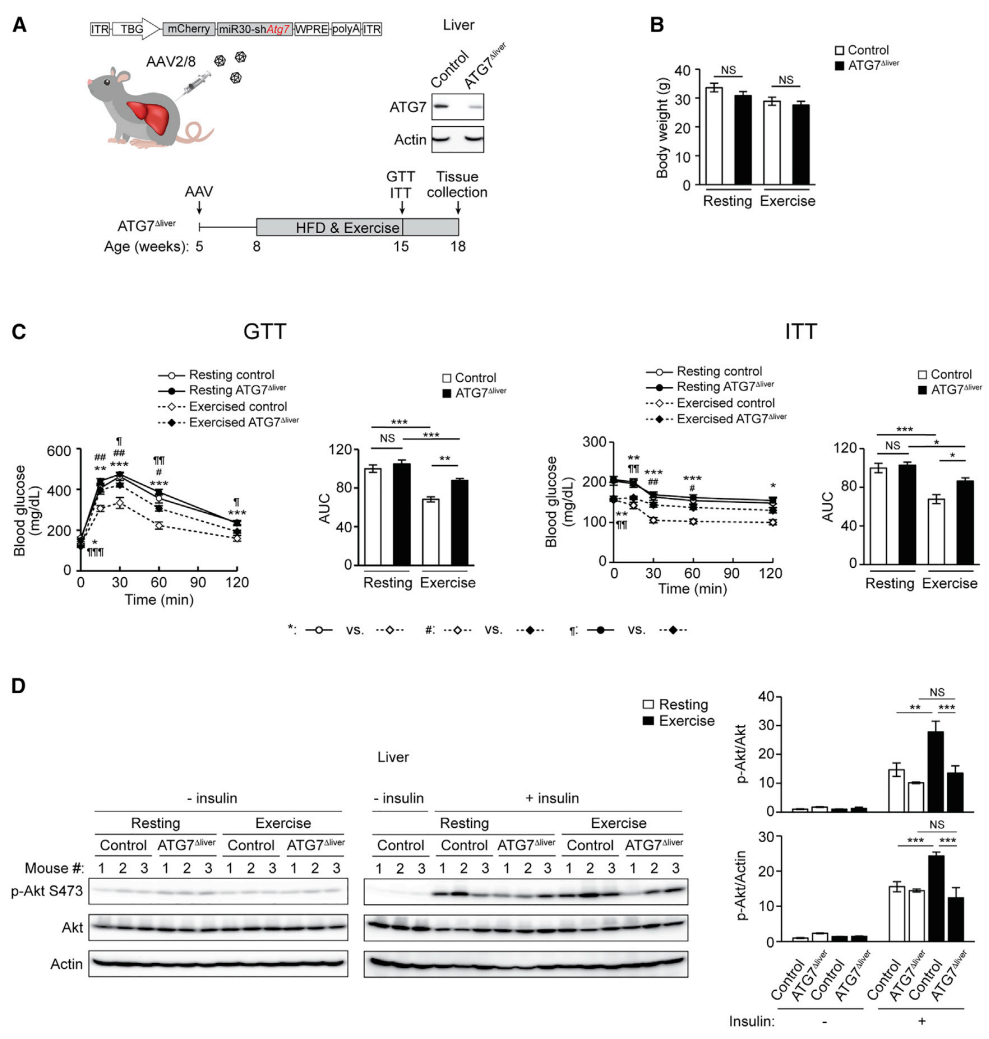
图一 肝脏自噬激活对运动诱导的胰岛素敏感性至关重要[7]
接下来,研究者探索运动如何激活肝脏中的自噬。使用表达自噬体标记物GFP-LC3的HeLa细胞作为报告细胞,氯喹(CQ)的添加可抑制自噬体与溶酶体的融合,导致自噬不能完成,LC3不能降解,表现为GFP荧光积累。实验发现细胞培养基中添加氯喹和WT小鼠运动血浆后,GFP-LC3荧光斑点积累(图二A),表明运动小鼠血浆足以激活自噬。有研究表明运动可能降低血清胰岛素水平,且胰岛素信号通路抑制自噬[8]。因此研究者测试胰岛素是否在运动血清的自噬激活中发挥作用。在表达mCherry-GFP-LC3的报告细胞中添加过量高水平的外源性胰岛素,发现运动血清仍能诱导报告细胞的自噬(图二B),表明运动诱导的全身自噬不是由循环胰岛素水平降低引起的。接下来,研究者对WT小鼠运动前后的血清进行蛋白质组学分析,最终确定了一个候选蛋白FN1(图二C)。发现运动后WT小鼠的循环FN1表达显著增加(图二D和E),且这种FN1增加是运动特异性诱导的,而不能通过禁食来诱导(图二F)。使用AMPK激活剂AICAR在细胞培养系统中模拟运动条件,发现仅在分化的肌细胞培养基中检测到诱导FN1分泌,而肝细胞或未分化的肌细胞没有(图二G)。此外,添加纯化的FN1也可以诱导自噬(图二H)。以上数据表明,运动诱导、肌肉分泌的循环因子FN1可以激活自噬。
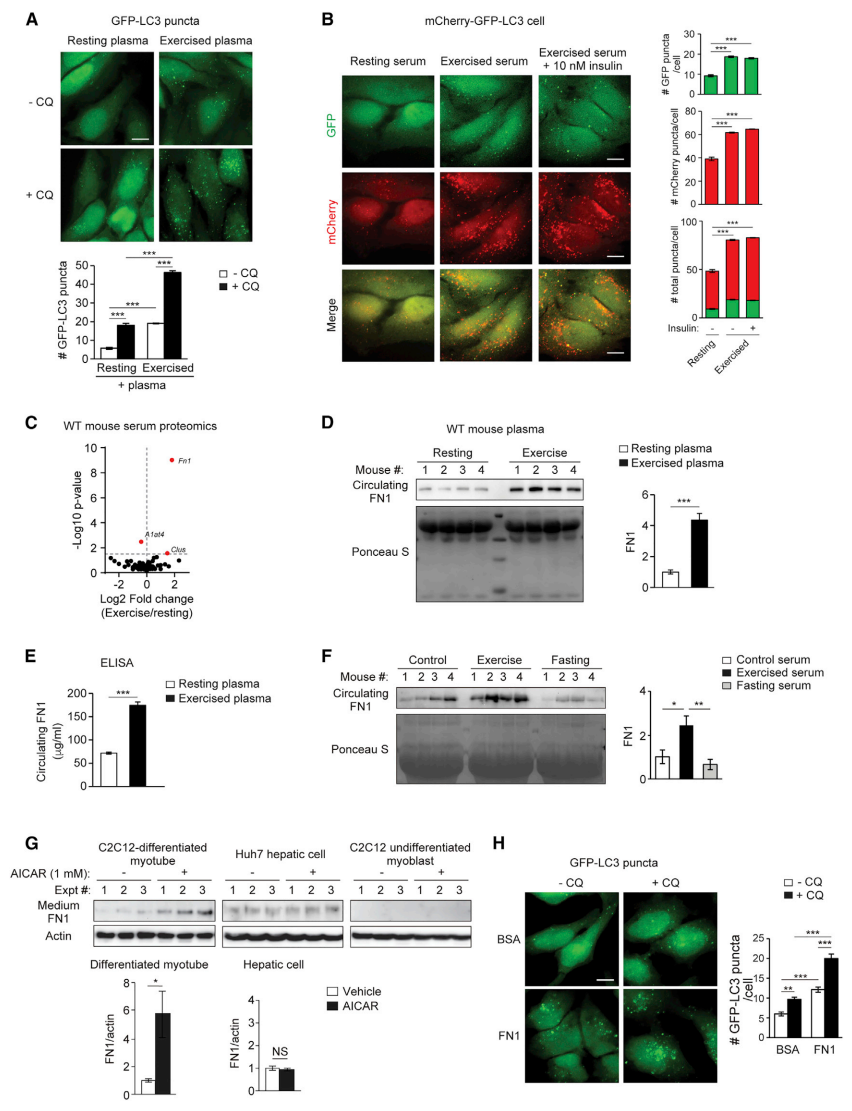
图二 FN1是一种由运动诱导的肌肉分泌循环因子,可激活自噬[7]
接下来,研究者探索肌肉来源的FN1在运动过程中的功能。通过AAV2/9将肌肉特异性MHCK7启动子驱动的shFN1递送到GFP-LC3报告小鼠中,产生肌肉特异性FN1敲降小鼠FN1Δmuscle(图三A)。FN1的肌肉特异性敲降几乎完全消除了FN1Δmuscle小鼠急性运动诱导的循环FN1(图三B),对运动诱导的肌肉自噬(图三C)和肌肉最大运动能力(图三D)没有影响,但阻止了运动诱导的肝脏自噬(图三E),表明肌肉分泌的FN1是运动过程中肌肉-肝脏通讯以及肝脏自噬激活所必需的。在RD喂养下,FN1Δmuscle和对照小鼠的体重、GTT和ITT相当。然而,在同时进行HFD喂养和运动后,两组小鼠的体重(图三F)、肝脏和肌肉组织重量相似,但相比对照组小鼠,运动没能提高FN1Δmuscle小鼠的GTT和ITT(图三G)。对照组小鼠在肌肉和肝脏中显示出运动诱导的胰岛素信号传导的改善,但FN1Δmuscle小鼠仅在肌肉中得到改善,而肝脏中没有(图三H)。以上数据表明,肌肉分泌的FN1介导了运动诱导的肝脏自噬和胰岛素敏感性。
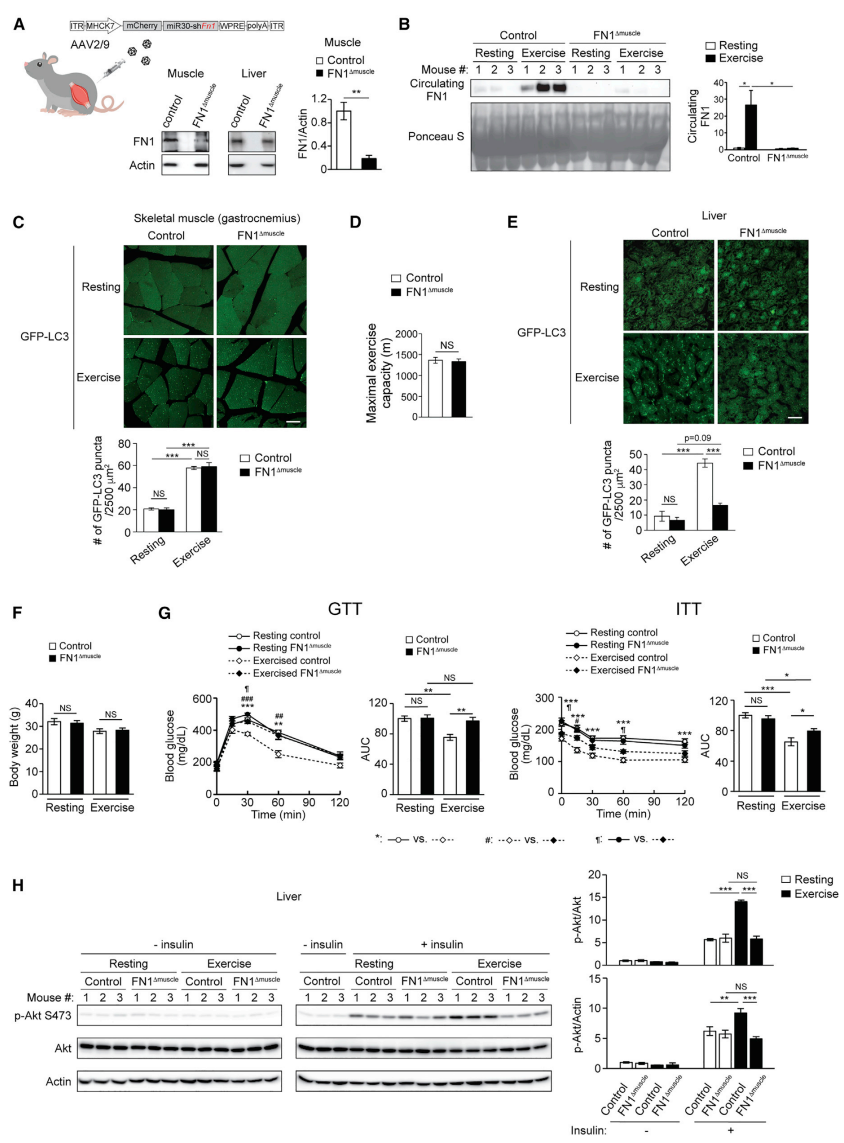
图三 肌肉分泌的FN1介导运动诱导的肝脏自噬和胰岛素敏感性[7]
整合素家族成员之一α5β1是FN1的受体[9],它们在细胞和全身代谢调节中的作用尚不清楚。研究者首先探究了整合素是否在运动诱导的自噬中发挥作用。整合素α5(ITGA5)或β1(ITGB1)亚基的敲降消除了报告细胞中运动小鼠血清激活的自噬(图四A),而不影响基础或禁食诱导的自噬(图四B)。由α亚基(IKKα)和β亚基(IKKβ)组成的IkB激酶(IKK)复合物被鉴定为整合素下游的关键信号分子。IKK激活进一步导致JNK1/2的磷酸化,并且IKK诱导自噬的能力是JNK依赖的[10]。于是研究者提出JNK可能作用于IKK的下游,将整合素的输入转导为细胞内的生化信号。实验发现,运动小鼠血清激活了报告细胞中的IKK和JNK,以及FN1整合素信号分子Src和FAK的磷酸化(图四C),且其依赖于ITGA5和ITGB1(图四D)。此外,相比对照组小鼠,运动没能激活FN1Δmuscle小鼠肝脏中的IKK、JNK、Src和FAK(图四E)。进一步研究发现,IKKα或IKKβ的敲降以及JNK1的敲降都阻止了运动血清诱导的自噬(图四F和G),表明运动诱导的自噬需要IKKα/β和JNK1。之前研究发现运动诱导骨骼肌中BECN1与BCL2分离[4]。免疫共沉淀分析发现运动诱导了BCL2在Ser70位点的磷酸化,并降低了对照小鼠肝脏中BECN1-BCL2的结合,但这些作用在FN1Δmuscle小鼠的肝脏中没有明显变化(图四H)。以上数据表明,肌肉分泌的FN1通过α5β1整合素-IKKα/β-JNK1-BECN1途径激活肝脏自噬。
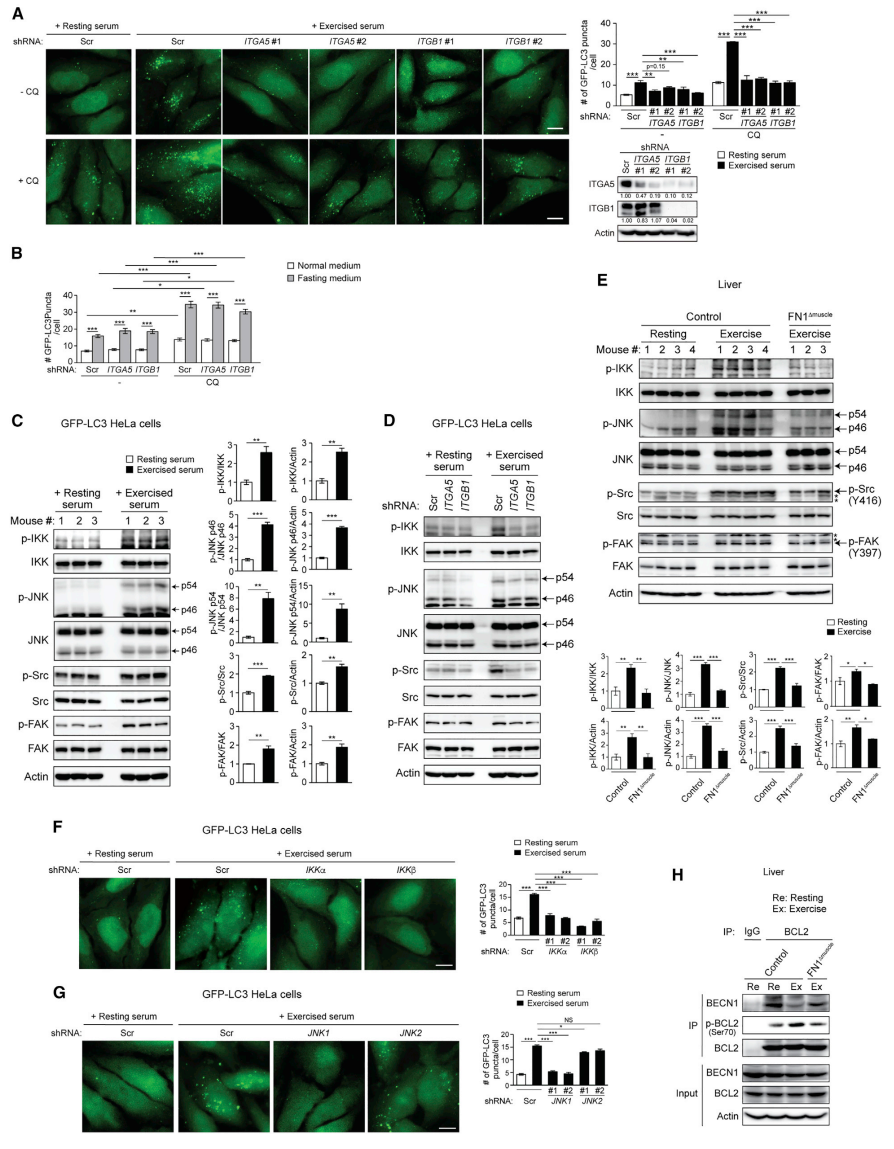
图四 肌肉分泌的FN1通过α5β1整合素-IKKα/β-JNK1-BECN1通路激活肝脏自噬[7]
最后,研究者探究α5β1整合素信号通路在运动诱导的自噬和调节非收缩组织代谢受益中的作用。使用AAV2/8递送TBG启动子驱动的shITGA5,生成肝脏特异性α5整合素亚基敲降小鼠ITGA5Δliver(图五A)。实验结果显示在ITGA5Δliver小鼠和自噬缺陷的ATG7Δliver小鼠中运动诱导的循环FN1水平均正常(图五B),对照组小鼠和ATG7Δliver小鼠肝脏中表现出运动诱导IKK、JNK、Src和FAK的激活(图五C)和BECN1-BCL2的解离(图五D),但ITGA5Δliver小鼠表现出上述指标的激活缺陷和解离缺陷。肝脏敲降ITGA5或ATG7显著逆转了运动诱导的自噬底物SQSTM1/p62水平的降低(图五C)。运动和禁食都不能诱导ATG7Δliver小鼠肝脏自噬,而ITGA5Δliver小鼠肝脏表现出运动诱导的自噬缺陷,但禁食诱导的自噬没有影响(图五E),这与ITGA5在体外自噬中的作用一致(图四A和B)。同时进行HFD喂养和运动后,对照组小鼠和ITGA5Δliver小鼠的体重(图五F)、运动耐力和组织重量相当,但运动训练仅改善了对照组小鼠的糖耐量、胰岛素耐量和激活肝脏胰岛素信号,而非ITGA5Δliver小鼠(图五G和H)。以上数据表明,肝脏α5β1整合素介导运动诱导的IKK-JNK激活、BECN1-BCL2解离、运动诱导的肝脏自噬以及代谢益处。
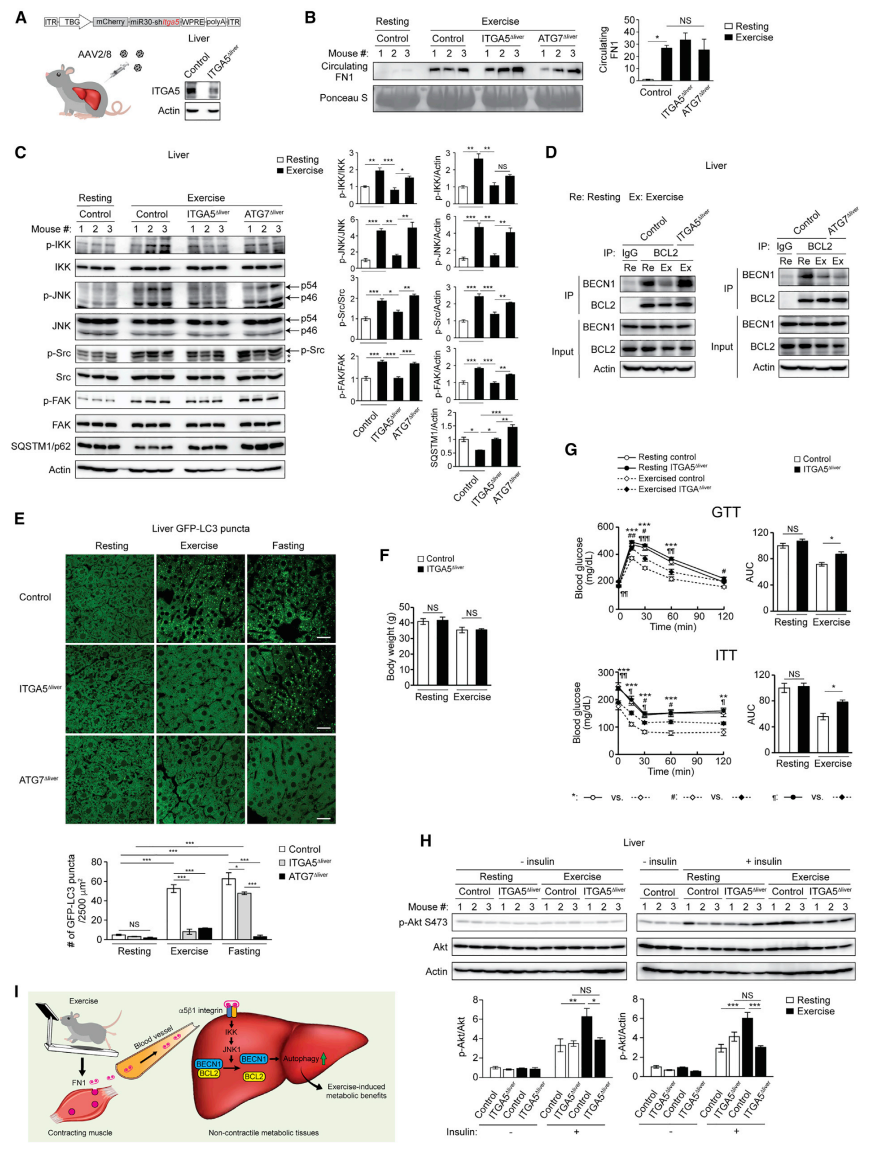
图五 肝脏α5整合素对运动诱导的IKK-JNK1-BECN1激活、肝脏自噬和全身代谢受益至关重要[7]
综上所述,研究者发现运动诱导肌肉分泌出FN1,可介导肌肉-肝脏通信,通过肝脏受体α5β1整合素和下游IKKα/β-JNK1-BECN1途径激活肝脏自噬,驱动运动诱导的代谢益处,改善全身胰岛素敏感性(图五I)。该研究揭示了运动诱导非收缩组织自噬激活的关键分子和潜在作用机制,进一步加深了人们对运动过程中全身自噬激活和代谢改善的认识,为运动疗法治疗代谢紊乱提供了新的理论基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Thyfault JP, Bergouignan A: Exercise and metabolic health: beyond skeletal muscle. Diabetologia 2020, 63(8):1464-1474.
2. Mizushima N, Komatsu M: Autophagy: renovation of cells and tissues. Cell 2011, 147(4):728-741.
3. Grumati P, Coletto L, Schiavinato A, Castagnaro S, Bertaggia E, Sandri M, Bonaldo P: Physical exercise stimulates autophagy in normal skeletal muscles but is detrimental for collagen VI-deficient muscles. Autophagy 2011, 7(12):1415-1423.
4. He C, Bassik MC, Moresi V, Sun K, Wei Y, Zou Z, An Z, Loh J, Fisher J, Sun Q et al: Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis. Nature 2012, 481(7382):511-515.
5. Drake JC, Wilson RJ, Laker RC, Guan Y, Spaulding HR, Nichenko AS, Shen W, Shang H, Dorn MV, Huang K et al: Mitochondria-localized AMPK responds to local energetics and contributes to exercise and energetic stress-induced mitophagy. Proc Natl Acad Sci U S A 2021, 118(37).
6. Lo Verso F, Carnio S, Vainshtein A, Sandri M: Autophagy is not required to sustain exercise and PRKAA1/AMPK activity but is important to prevent mitochondrial damage during physical activity. Autophagy 2014, 10(11):1883-1894.
7. Kuramoto K, Liang H, Hong JH, He C: Exercise-activated hepatic autophagy via the FN1-alpha5beta1 integrin pathway drives metabolic benefits of exercise. Cell Metab 2023, 35(4):620-632 e625.
8. He C, Klionsky DJ: Regulation mechanisms and signaling pathways of autophagy. Annu Rev Genet 2009, 43:67-93.
9. Vega ME, Schwarzbauer JE: Collaboration of fibronectin matrix with other extracellular signals in morphogenesis and differentiation. Curr Opin Cell Biol 2016, 42:1-6.
10. Criollo A, Senovilla L, Authier H, Maiuri MC, Morselli E, Vitale I, Kepp O, Tasdemir E, Galluzzi L, Shen S et al: The IKK complex contributes to the induction of autophagy. The EMBO journal 2010, 29(3):619-631.



