技术分享:BCAT1功能增益突变增强RhoC活性促进肿瘤发展
缬氨酸、亮氨酸和异亮氨酸因其结构上的支链被统称为支链氨基酸(BCAA),它们不能被人体合成,属于必需氨基酸。越来越多的研究表明BCAA与代谢紊乱及一系列疾病的关系密切。BCAA转氨酶(BCAT1和BCAT2)可将BCAA转化为支链酮酸(BCKA),同时催化α-酮戊二酸(α-KG)转化为谷氨酸[1]。而BCAT1/BCAT2的失调已报道发生在各种癌症中,包括胰腺癌、胶质瘤和白血病等[2]。例如,基质细胞中的BCAT1可上调合成BCKA,以维持胰腺导管腺癌(PDAC)的发展;而BCAT2可调控PDAC的BCAA代谢,加快PDAC进展[3]。神经胶质瘤中常见的IDH1突变,可导致催化α-KG生成R-2-羟基戊二酸((R)-2HG)[4],而后者的过量产生能有效抑制α-KG依赖的BCAT1和BCAT2,从而降低谷氨酸水平。然而,目前尚未见BCAA代谢途径功能性突变的相关报道。
2023年6月,Nature Metabolism上报道了一项BCAT1功能获得性突变促进肿瘤发展的研究,发现功能增益突变BCAT1E61A具有更高的酶活性,促进BCAA分解代谢,加速癌细胞增殖、迁移和侵袭,促进肿瘤的发展。机制上,BCAT1E61A及其催化BCAA产生的代谢产物BCKA可直接与RhoC结合,与ARHGEF1形成复合物,上调RhoC活性,促进细胞增殖和迁移。坎地沙坦是 BCAT1的有效抑制剂,可阻断BCAT1E61A的酶活性,抑制RhoC活性和癌细胞迁移,防止体内肿瘤的腹膜转移[5]。
首先,研究者使用肿瘤细胞系百科全书(CCLE)数据库分析α-KG、Glu和BCAA代谢途径中已知所有68个酶的突变,发现BCAT1E61A突变约占所有BCAT1突变的29.3%(图一a)。通过测序进一步证实了携带BCAT1E61A突变的细胞系有白血病细胞系THP-1、胃癌细胞系KATO III以及人食管癌细胞系TE1(图一b)。收集106例临床胃癌样本进行DNA测序,结果显示BCAT1E61A突变约占2.83%(3/106,图一c)。临床诊断和HE染色证实这3名患者都患有中分化或低分化的弥漫性胃癌(图一d)。以上数据表明,BCAT1E61A突变可能与癌症的发展有关。
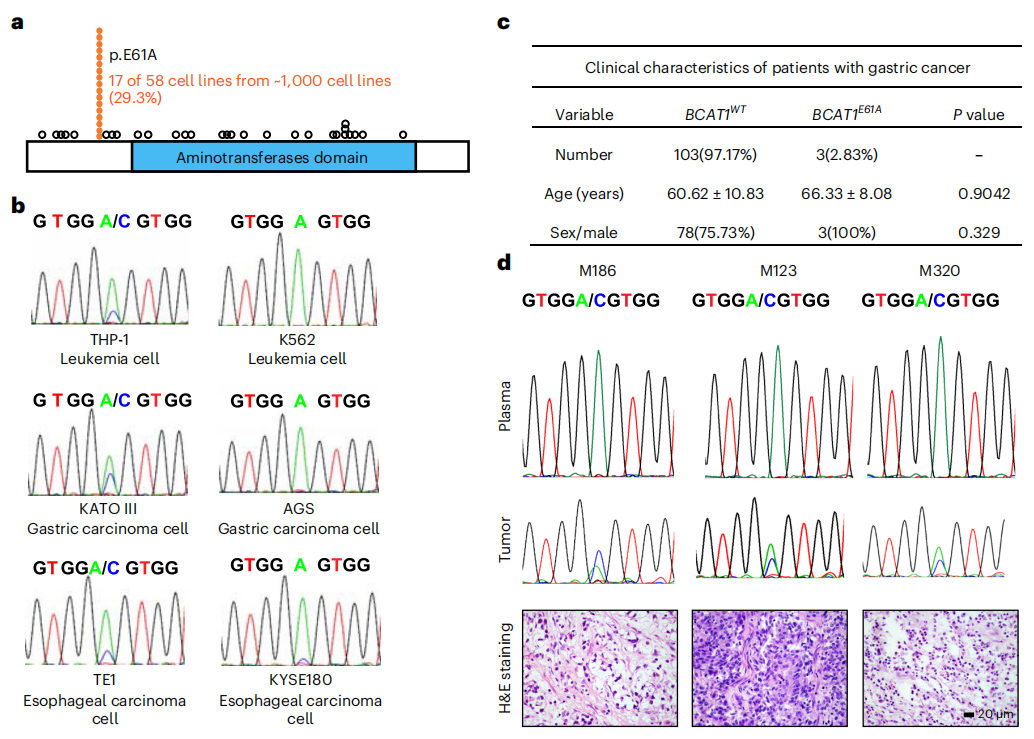
图一 在癌症细胞和临床样本中鉴定出BCAT1E61A突变[5]
接下来,研究者在体外检测BCAT1WT和BCAT1E61A的催化活性,使用Leu和α-KG、KIC和Glu分别作为正向和反向反应的底物(图二a)。结果显示,与BCAT1WT相比,BCAT1E61A突变体的酶活性在正向和反向反应中均显著增强(图二b)。研究者进而比较BCAT1E61A突变患者的血清代谢物浓度,发现BCAA的代谢产物HIB、Val、KIC、KIV和Leu发生了显著变化(图二c和d)。于是,研究者构建Bcat1E61A突变小鼠(Bcat1KI/KI),分析不同组织中BCAA的浓度变化。结果显示,与Bcat1WT小鼠相比,Bcat1KI/KI小鼠肌肉中BCAA水平显著升高,而肺、胃、肝等其他组织的BCAA水平略有下降(图二e)。分离小鼠真皮成纤维细胞(MDFs),发现相比Bcat1WT,Bcat1WT/KI和Bcat1KI/KI小鼠MDFs的BCAA和BCKA水平均升高(图二f)。研究者进一步追踪BCAA的分解代谢,用13C标记的Val和13C、15N标记的Leu培养MDFs,它们可被分解为13C标记的BCKAs或15N标记的Glu(图二g)。培养36 小时后检测结果显示,相比Bcat1WT,Bcat1KI/KI中13C标记的KIV和KIC的丰度增加了1.5-2倍,Bcat1WT/KI的增加程度少些(图二h和i)。以上结果表明,BCAT1E61A突变提高了酶活性,促进了BCAA的分解代谢。
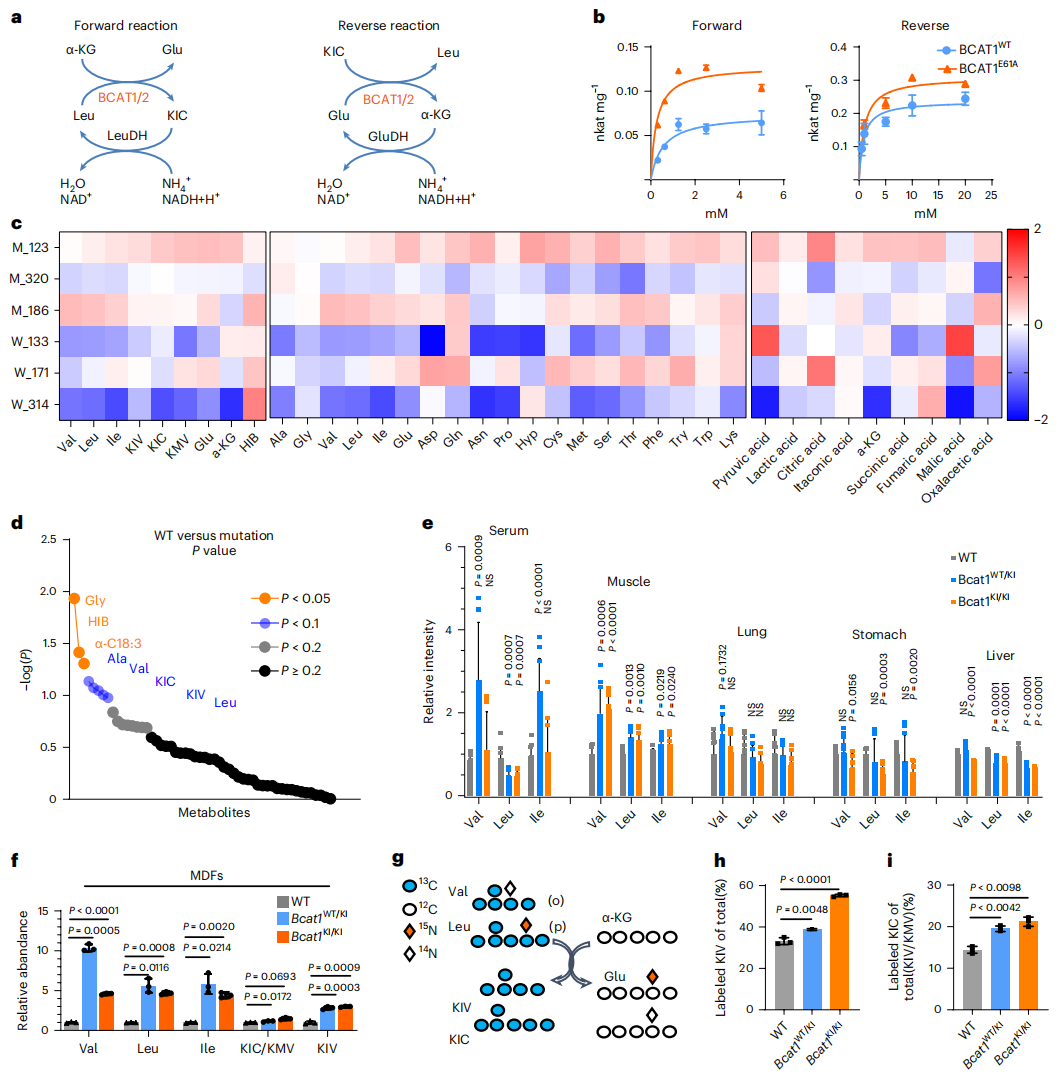
图二 Bcat1E61A促进BCAA代谢[5]
下一步,研究者探究BCAT1E61A突变的生物学功能。分别建立了BCAT1稳定敲除(KO)和外源性过表达BCAT1WT或BCAT1E61A的细胞系。发现癌细胞过表达BCAT1WT和BCAT1E61A可促进细胞增殖,BCAT1E61A的促进效果更强些(图三a)。BCAT1 KO后癌细胞增殖受到抑制(图三b)。与对照组相比,BCAT1 KO减弱了细胞的迁移和侵袭能力(图三c和e)。反之,过表达BCAT1WT和BCAT1E61A均促进了细胞的迁移和侵袭,BCAT1E61A的促进效果更强(图三d和f)。以上数据表明,BCAT1E61A突变促进癌细胞的增殖、迁移和侵袭。
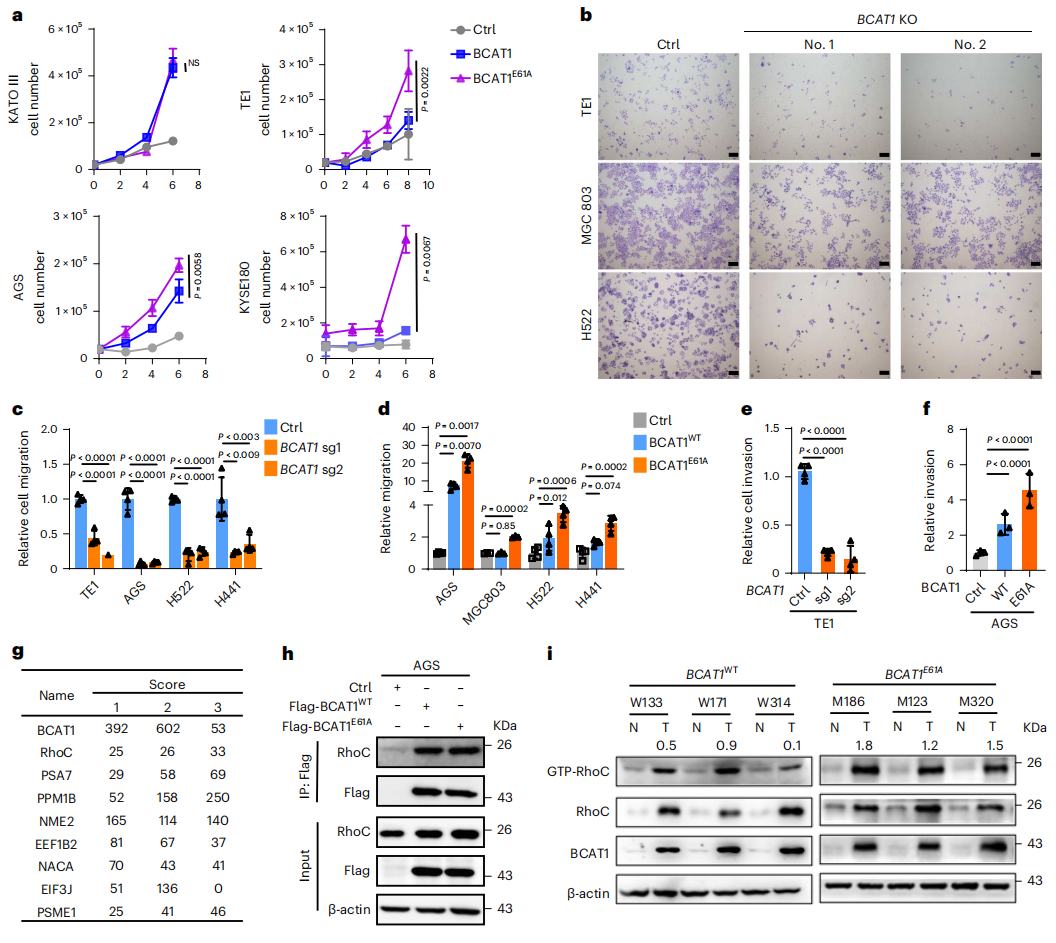
图三 BCAT1E61A通过与RhoC相互作用增强癌细胞增殖、迁移和侵袭[5]
接下来研究者探索BCAT1E61A功能的潜在分子机制。通过IP-MS分析发现Ras同源基因家族成员C(RhoC)与BCAT1存在相互作用(图三g),Co-IP证明BCAT1E61A与BCAT1WT具有相似的RhoC结合亲和力(图三h)。在临床组织样品中,检测到BCAT1E61A肿瘤样品中RhoC的GTP酶活性增加(图三i)。于是,研究者在多种胃癌(图四a)和肺癌细胞系(图四b)中敲除BCAT1,发现均能显著抑制RhoC活性。当过表达BCAT1WT或BCAT1E61A时,RhoC活性增强,BCAT1E61A的增强效果高于BCAT1WT(图四c和d)。BCAT1 KO后,RhoC活性受到抑制,BCAA和α-KG的联合处理可略微上调RhoC活性,BCKA和Glu联合处理可最大程度恢复RhoC活性,而BCAA、α-KG、BCKA或Glu的单独处理则没有影响(图四e)。此外,研究者发现BCKA和Glu联合处理还能挽救BCAT1 KO抑制的细胞迁移(图四f)。RhoC敲低后细胞迁移能力受损,此时过表达BCAT1WT或BCAT1E61A并不能挽救受损的细胞迁移能力(图四g),表明BCAT1促进细胞迁移依赖于RhoC的激活。以上数据表明,BCAT1E61A突变驱动的BCAA分解代谢和BCKA积累诱导了RhoC活性,从而赋予了癌细胞的高运动性。
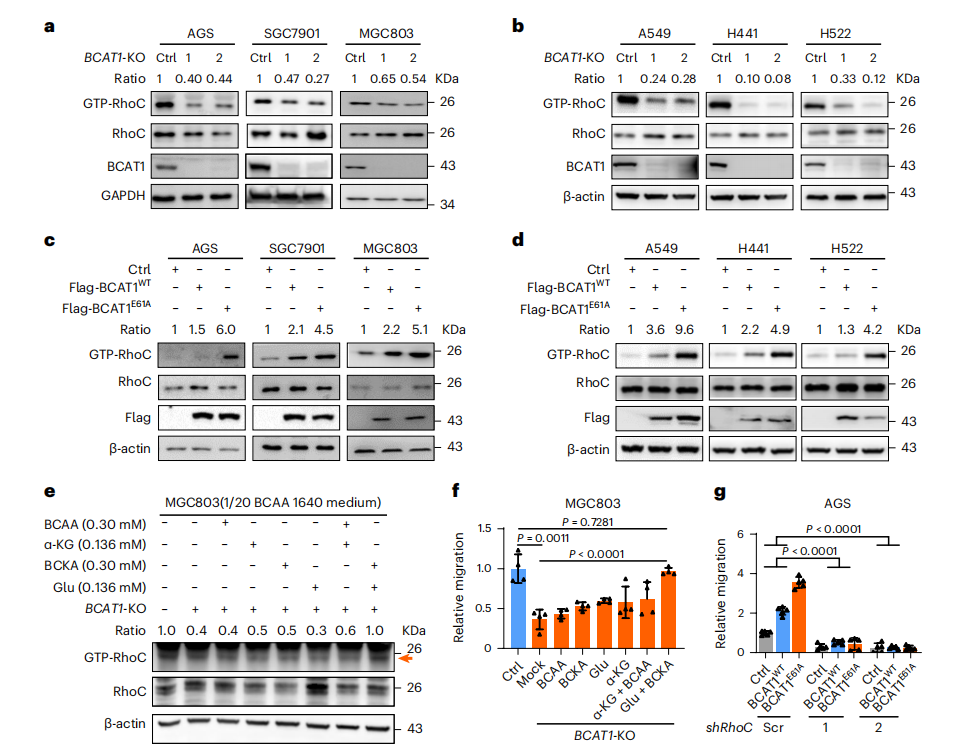
图四 BCAT1E61A诱导BCKA积累,激活RhoC促进细胞迁移[5]
进一步地,研究者探索代谢物诱导RhoC激活的机制。根据BioGRID和STRING数据库预测ARHGEF1可能与RhoC激活相关。经检测发现,ARHGEF1与BCAT1E61A的相互作用更强(图五a)。相比BCAA,补充BCKA更能增强RhoC和ARHGEF1之间的相互作用(图五b)。同时体外鸟嘌呤核苷酸交换测定显示,BCKA显著增强了ARHGEF1介导的RhoC激活(图五c和d)。等温滴定量热法(ITC)测定结果显示BCKA直接结合RhoC蛋白(图五e)。双分子荧光互补法测试BCAT1与RhoC之间的相互作用,发现RhoC-CGFP与BCAT1-NGFP形成绿色颗粒(图五f),表明两者之间存在相互作用。此外,绿色颗粒与红色F-ACTIN共定位(图五f),表明RhoC和BCAT1的复合物与细胞骨架相互作用。以上数据表明,BCAT1E61A的功能增益突变导致BCKA积累,随后BCAT1和/或BCKA与RhoC的结合增加,触发RhoC-ARHGEF1复合物的形成,进而驱动RhoC的活化。
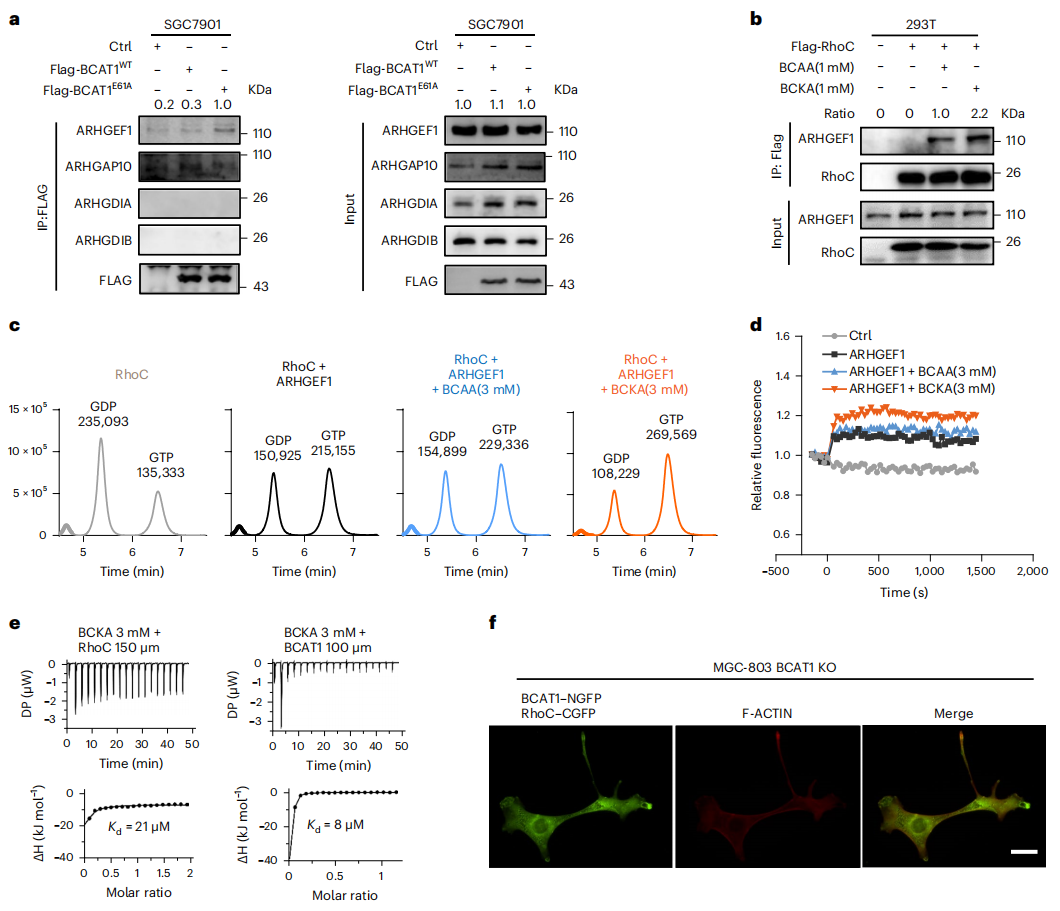
图五 BCKA积累通过ARHGEF1增强RhoC活性[5]
最后,研究者寻找具有潜在临床应用价值的BCAT1/BCAT1E61A抑制剂。酶活性测定检测多种化合物显示坎地沙坦对BCAT1活性的抑制作用最为显著(图六a)。ITC分析显示重组BCAT1E61A蛋白与坎地沙坦之间具有较高的结合亲和力(图六b)。坎地沙坦以剂量依赖的方式显著抑制了癌细胞的迁移(图六c);还可以抑制Bcat1WT/KI或Bcat1KI/KI MDFs中RhoC的活性(图六d)。将BCAA代谢物添加到坎地沙坦处理的细胞中,发现Glu和BCKA联合处理消除了坎地沙坦对RhoC活性的抑制作用(图六e)。进一步研究BCAT1E61A、RhoC、ARHGEF1和坎地沙坦在体内恶性肿瘤中的相互作用,研究者检测了腹腔注射胃癌细胞后的腹膜转移。与注射过表达BCAT1WT的胃癌细胞相比,注射过表达BCAT1E61A胃癌细胞的小鼠显示出更多的肿瘤和肿瘤重量增加,而给予坎地沙坦或低BCAA饮食显著抑制了肿瘤生长,敲低RhoC则不出现肿瘤(图六f和g)。此外,研究者还在Bcat1KI/KI小鼠中诱导胃癌,发现其肿瘤发生显著高于对照组小鼠。以上数据表明,BCAT1E61A促进癌症发生发展,坎地沙坦通过直接与BCAT1WT或BCAT1E61A结合,抑制其活性和功能,阻断BCAA向BCKA转化,导致RhoC失活,阻碍癌细胞的迁移。
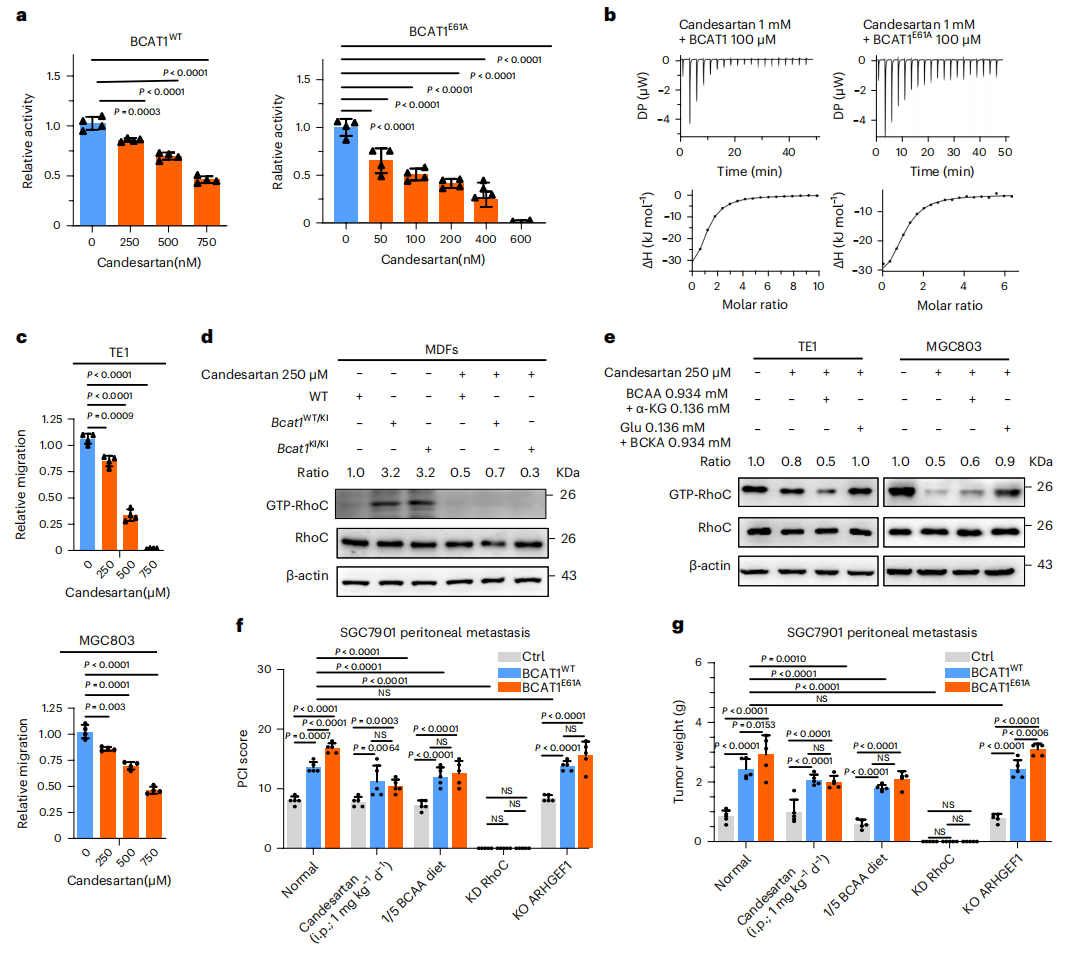
图六 坎地沙坦可抑制BCAT1E61A的活性和功能[5]
综上所述,BCAT1E61A的功能增益突变使其具有更高的酶活性,加速催化BCAA在局部细胞内区室产生高浓度的BCKA并直接与RhoC结合,后者被ARHGEF1进一步激活,增强癌细胞增殖和运动,促进肿瘤发展。坎地沙坦可以有效阻断这一过程,防止体内肿瘤腹膜转移。该研究揭示了BCAA代谢与细胞增殖和运动之间的关系,提示BCKA在RhoC激活诱导的癌细胞迁移和转移中起着非常关键的作用,对癌症治疗具有潜在意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Raffel S, Falcone M, Kneisel N, Hansson J, Wang W, Lutz C, Bullinger L, Poschet G, Nonnenmacher Y, Barnert A et al. BCAT1 restricts alphaKG levels in AML stem cells leading to IDHmut-like DNA hypermethylation. Nature 2017, 551(7680):384-388.
2. Ericksen RE, Lim SL, McDonnell E, Shuen WH, Vadiveloo M, White PJ, Ding Z, Kwok R, Lee P, Radda GK et al. Loss of BCAA Catabolism during Carcinogenesis Enhances mTORC1 Activity and Promotes Tumor Development and Progression. Cell Metab 2019, 29(5):1151-1165 e1156.
3. Li JT, Yin M, Wang D, Wang J, Lei MZ, Zhang Y, Liu Y, Zhang L, Zou SW, Hu LP et al. BCAT2-mediated BCAA catabolism is critical for development of pancreatic ductal adenocarcinoma. Nat Cell Biol 2020, 22(2):167-174.
4. Tonjes M, Barbus S, Park YJ, Wang W, Schlotter M, Lindroth AM, Pleier SV, Bai AHC, Karra D, Piro RM et al. BCAT1 promotes cell proliferation through amino acid catabolism in gliomas carrying wild-type IDH1. Nat Med 2013, 19(7):901-908.
5. Qian L, Li N, Lu XC, Xu M, Liu Y, Li K, Zhang Y, Hu K, Qi YT, Yao J et al. Enhanced BCAT1 activity and BCAA metabolism promotes RhoC activity in cancer progression. Nat Metab 2023, 5(7):1159-1173.



