技术分享:肝脏特异性CRISPR递送系统——响应CES1释放的阳离子共聚物
基因组编辑系统已成为生物医学研究、基因药物开发和基因治疗的基础[1]。其中,CRISPR/Cas9系统由于其简单、灵活,在疾病治疗策略的研究中显示出巨大优势。然而,如何将CRISPR/Cas9系统安全、有效地递送和释放到靶器官、细胞和细胞核中,仍然是该系统应用于疾病治疗的一个主要挑战。脂质体、无机纳米颗粒和聚合物在CRISPR/Cas9系统的递送中展现出优势[2]。其中,聚合物因其制备简单、工艺可控,具有多种药物递送能力,如小分子、生物大分子和蛋白质,被认为是优秀的递送载体,可递送CRISPR/Cas9系统的不同组分形式,如Cas9-mRNA/sgRNA、质粒和核糖核蛋白。随着可逆加成-断裂链转移(RAFT)聚合的出现,阳离子共聚物因其高荷载潜力以及通过静电作用的细胞摄取能力,已被成功用于siRNA递送[3]。但是,由于阳离子会干扰细胞膜完整而造成细胞毒性,至今几乎没有阳离子聚合物纳米材料被FDA批准用于临床。因此,设计合成无害的阳离子聚合物递送系统仍旧是个难题。
2023年4月,Advanced Science上报道了一种用于体内外递送Cas9-mRNA/sgRNA的新型阳离子共聚物mPEG-b-P(Met/n-PMA),简称为PEG-PMet。该阳离子共聚物是由二甲基双胍衍生物、甲基丙烯酸丙酯在预聚物上共聚制成的三元共聚物,可以响应肝脏羧酸酯酶CES1有效地释放RNA,以进行基因组编辑。研究者选择PCSK9靶点进行应用测试,成功使用PEG-PMet递送Cas9-mRNA/sgPCSK9,使其在小鼠肝脏中有效积累,抑制PCSK9表达,降低小鼠血清中20%的低密度脂蛋白胆固醇和总胆固醇水平,改善高脂血症[4]。
二甲双胍是治疗2型糖尿病的一线药物,这种阳离子药物已被证明具有治疗有效性和良好安全性[5]。胍基聚合物可通过Gu+/PO34−的静电和氢键相互作用,易于粘附到核酸上[6]。然而,这些相互作用增强了胍基和核酸之间的稳定性,通常导致细胞内释放不理想,使得递送效率低下[7]。羧酸酯酶(CES)是一种酯酶家族成员,可将羧酸酯水解为相应的醇和羧酸。CES1和CES2是参与外源代谢的两种主要羧酸酯酶,具有一定的序列同源性,但表现出不同的组织分布和底物特异性[8]。CES1在肝脏中大量表达,而CES2主要表达在小肠和结肠。因此,研究者猜测如果在阳离子共聚物中加入CES1催化的丙酯单体,可能有助于解决细胞内的释放不良,同时实现肝脏的特异性释放。
首先,研究者设计合成了mPEG-b-P(Met/n-PMA),简称为PEG-PMet(图一A和B),并对其进行表征。透射电子显微镜(TEM)显示其大小约为30-50 nm(图一C);对羧酸酯酶(CES)表现敏感,可被肝脏CES1体外降解(图一D)。
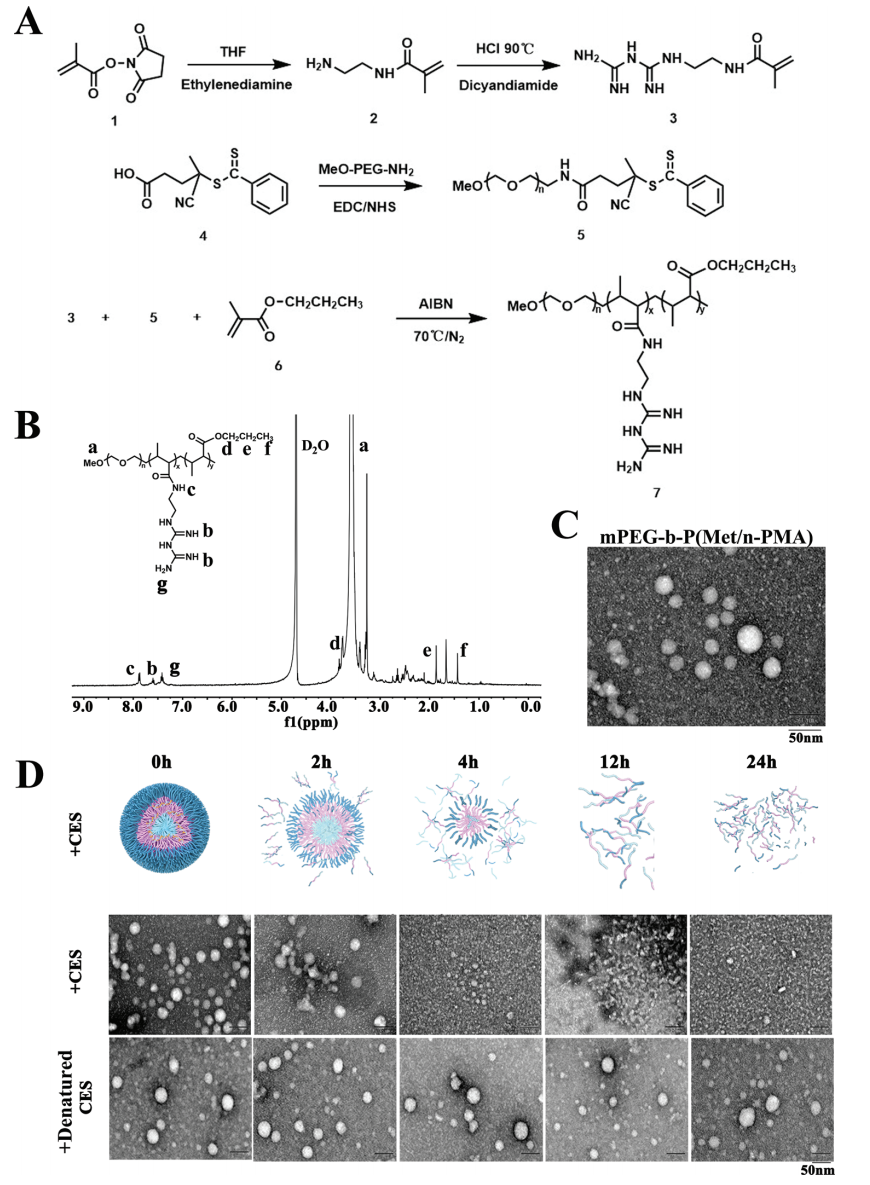
图一 PEG-PMet的合成与表征[4]
接着,研究者探究PEG-PMet和RNA的自组装情况。使用分子动力学(MD)模拟方法模拟两者的形成过程,两种分子在8:1的比例下可在100 ns后自组装成球形颗粒(图二A和B)。均方根偏差(RMSD)的变化显示,RNA分子在整个模拟过程中相对稳定; 而PEG-PMet在模拟开始时发生了显著变化,随后趋于稳定(图二C)。GROMACS能量计算显示,随着PEG-PMet和RNA的连续聚集,静电和范德华能量增强,两者之间的氢键数量增加,而RNA与水之间的氢键数目减少(图二D-F和H),表明氢键是二者聚集的主要驱动力。TEM显示PEG-PMet/RNA复合物的大小为20-30 nm(图二B),小于单一的PEG-PMet,提示稳定相互作用力的数量增加赋予了PEG-PMet较高的RNA凝聚能力。凝胶电泳和紫外光谱显示,两者在3:1的比例下可有效负载RNA(图二G),包装率高于70%(图二I)。包装在PEG-PMet中的RNA一周内仍保持稳定没有被降解,且在不同温度下均具有稳定性(图二J)。将CES1添加到PEG-PMet/RNA中,可检测到RNA的释放(图二K)。
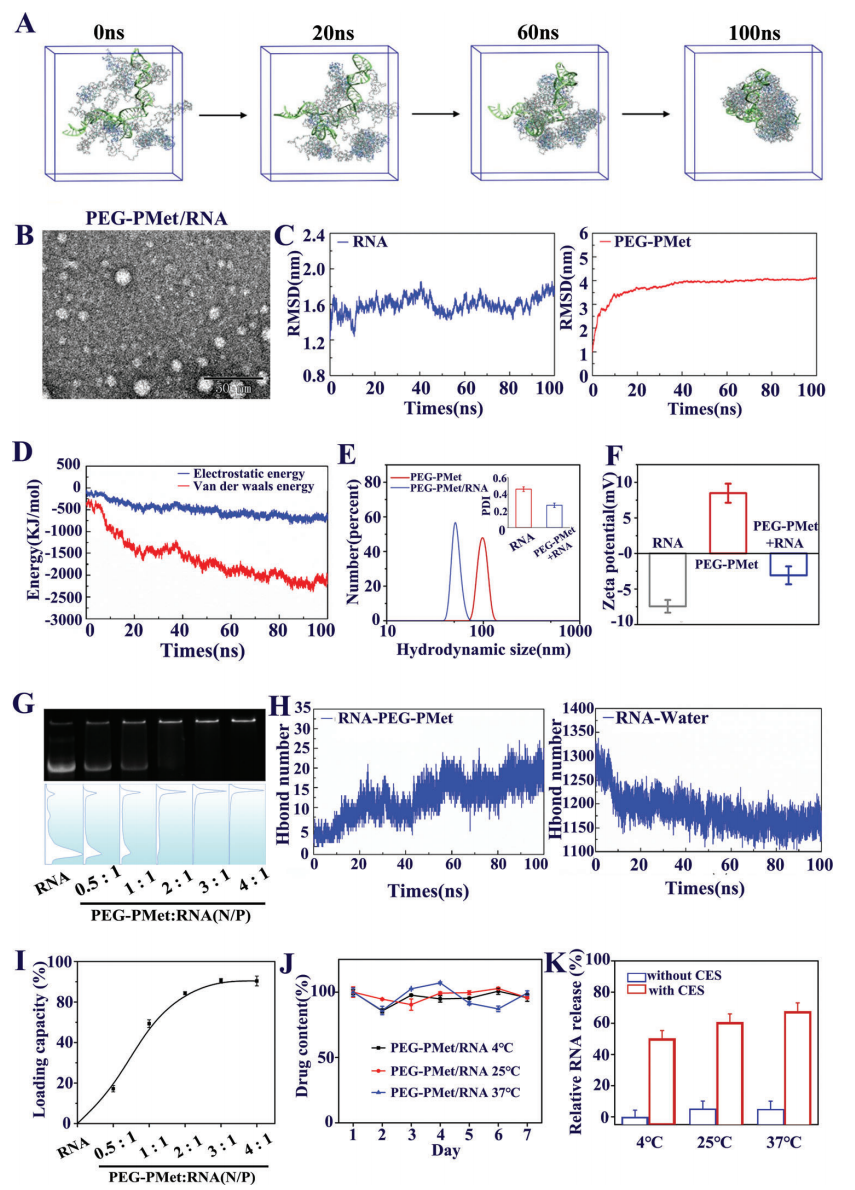
图二 表征PEG-PMet的RNA负载与释放能力[4]
接下来,研究者测试PEG-PMet的细胞递送情况,选择具有高CES1活性的HepG2细胞进行测试,同时与阳离子脂质体Lipo3000进行比较。PEG-PMet可实现GFP mRNA较高的细胞递送,效率高于Lipo3000(图三A和B)。进一步将Cy5标记的sg PCSK9(Cy5-sgPCSK9)和含有核定位信号(NLS)的Cas9 mRNA包装入PEG-PMet(图三C),可观察到有效的细胞递送,且Cas9/sgRNA分布在细胞核内及其周围(图三D)。CCK8细胞毒性测试结果显示Lipo3000具有细胞毒性,而PEG-PMet可促进细胞活力(图三E),并且这种促进作用随着PEG-PMet剂量的增加而增加,即使500 μg/ml的剂量也没显示出细胞毒性(图三F)。以上结果表明,PEG-PMet可以实现细胞内的有效递送,且无细胞毒性。
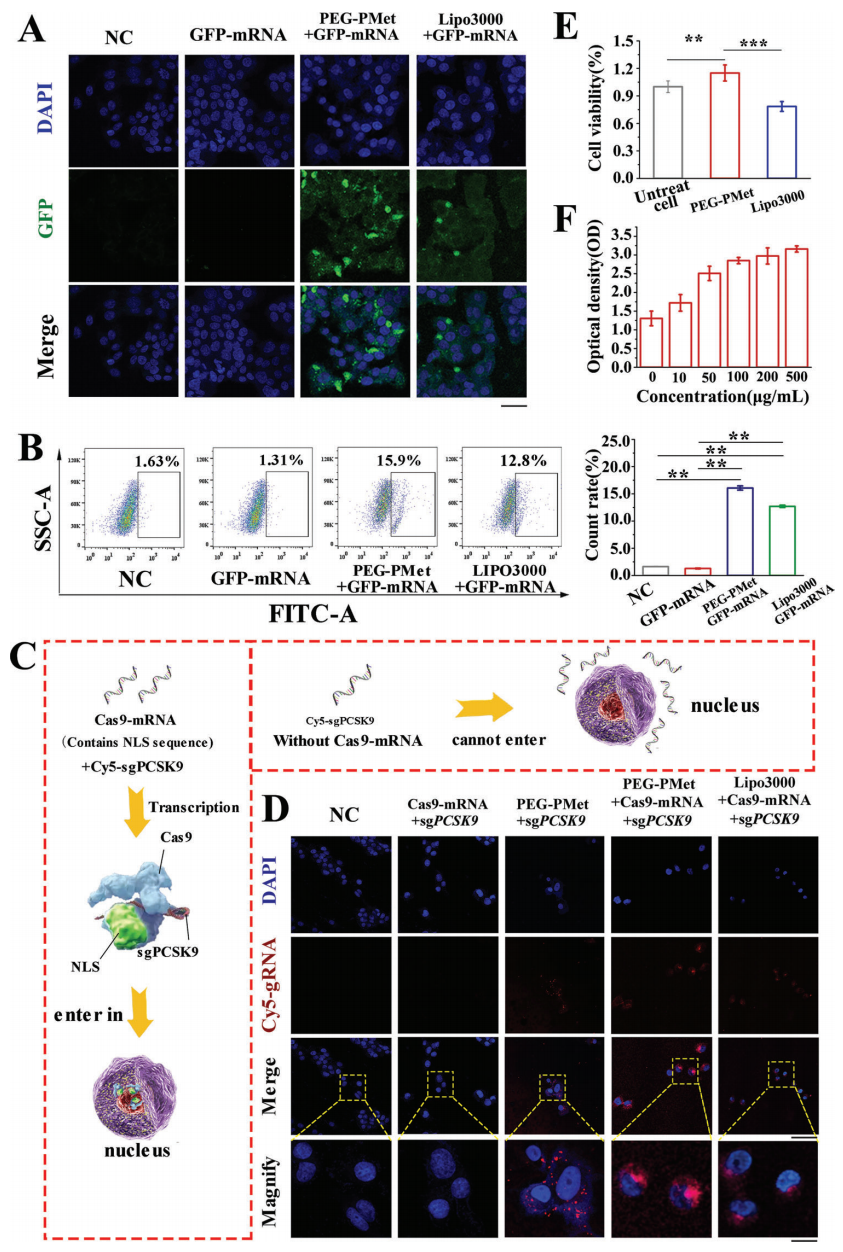
图三 PEG-PMet的细胞内递送[4]
随后,研究者进一步测试PEG-PMet细胞递送CRISPR/Cas9系统的基因编辑情况,选择敲低PCSK9靶点来改善高脂血症(图四A)。高通量测序(图四B)和T7E1测定(图四C)表明,PEG-PMet/Cas9-mRNA/sgPCSK9诱导了HepG2细胞中PCSK9基因的有效编辑;显著下调了PCSK9蛋白表达(图四D和E),上调了低密度脂蛋白受体(LDL-R)表达(图四F-K);促进细胞对外源性胆固醇的摄取,总胆固醇水平和细胞内脂滴均增多(图四L-N),表明PEG-PMet细胞递送的基因编辑成功。
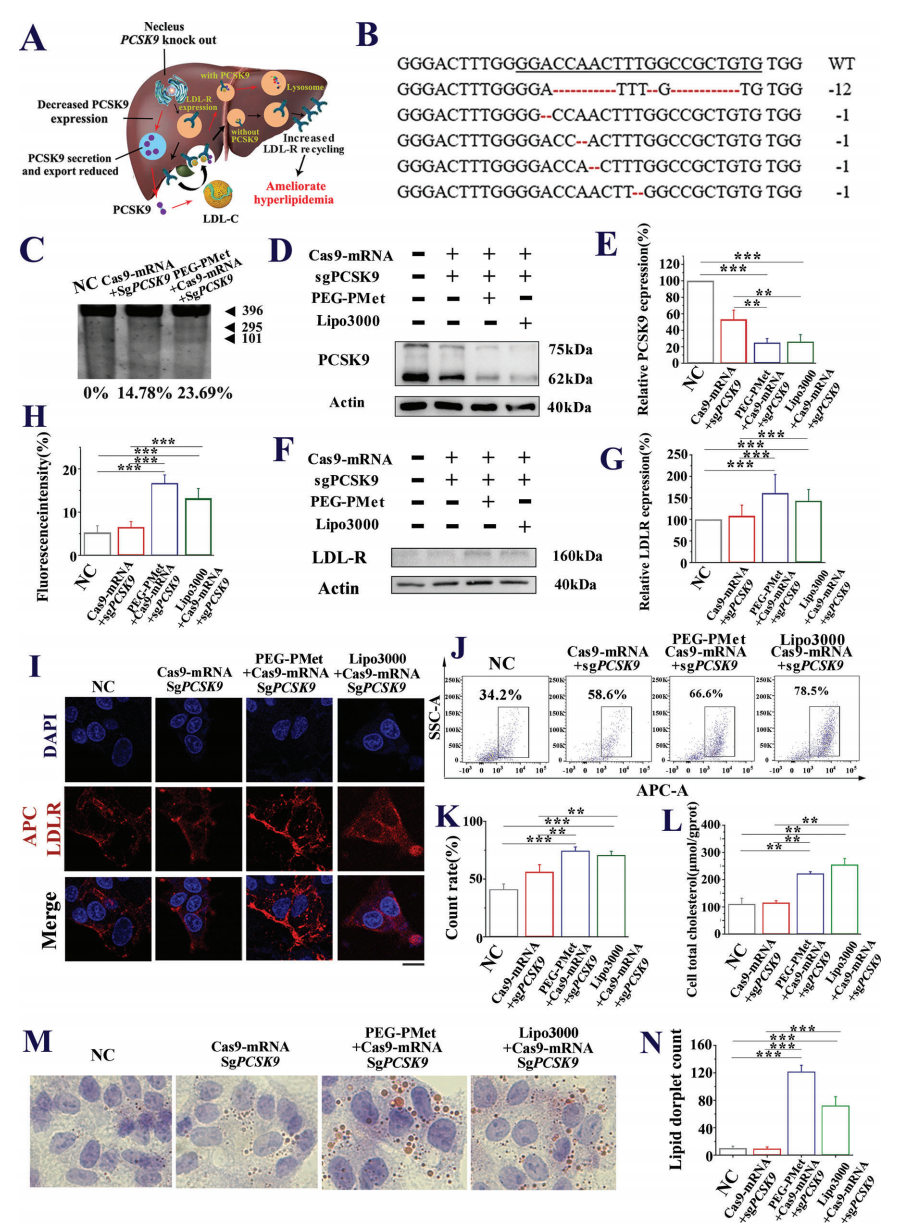
图四 PEG-PMet/Cas9-mRNA/sgPCSK9介导细胞的基因组编辑[4]
最后,研究者测试PEG-PMet体内递送CRISPR/Cas9系统的基因编辑效率,小鼠高脂饮食后接受单剂量尾静脉注射治疗(图五A)。发光成像结果显示,注射后0.5小时可在肝脏中观察到Cy5强荧光信号;相比Cy5对照组的快速代谢,两个PEG-PMet递送组的信号维持更持久且肝脏特异(图五B)。血清生化检测显示,PEG-PMet和Lipo3000递送的Cas9-mRNA/sgPCSK9实验组均能降低小鼠PCSK9水平、低密度脂蛋白胆固醇(LDL-C)和总胆固醇(TC)水平(图五C)。此外,甘油三酯(TG,图五C)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)和肌酸酐(S-Cr)水平(图五D)没有显著变化,表明这些疗法未对小鼠产生不良影响。WB结果也显示了治疗组小鼠的肝脏PCSK9水平降低,以及LDL-R水平升高(图五E)。以上结果表明PEG-PMet可实现小鼠肝脏特异性递送Cas9-mRNA/sgPCSK9,并完成有效的在体基因组编辑。有趣的是,研究者意外发现PEG-PMet相比Lipo3000的递送方式,还具有二甲双胍降低血糖的功效,显著降低了GTT和ITT水平(图五F),缓解了小鼠的胰岛素抵抗。
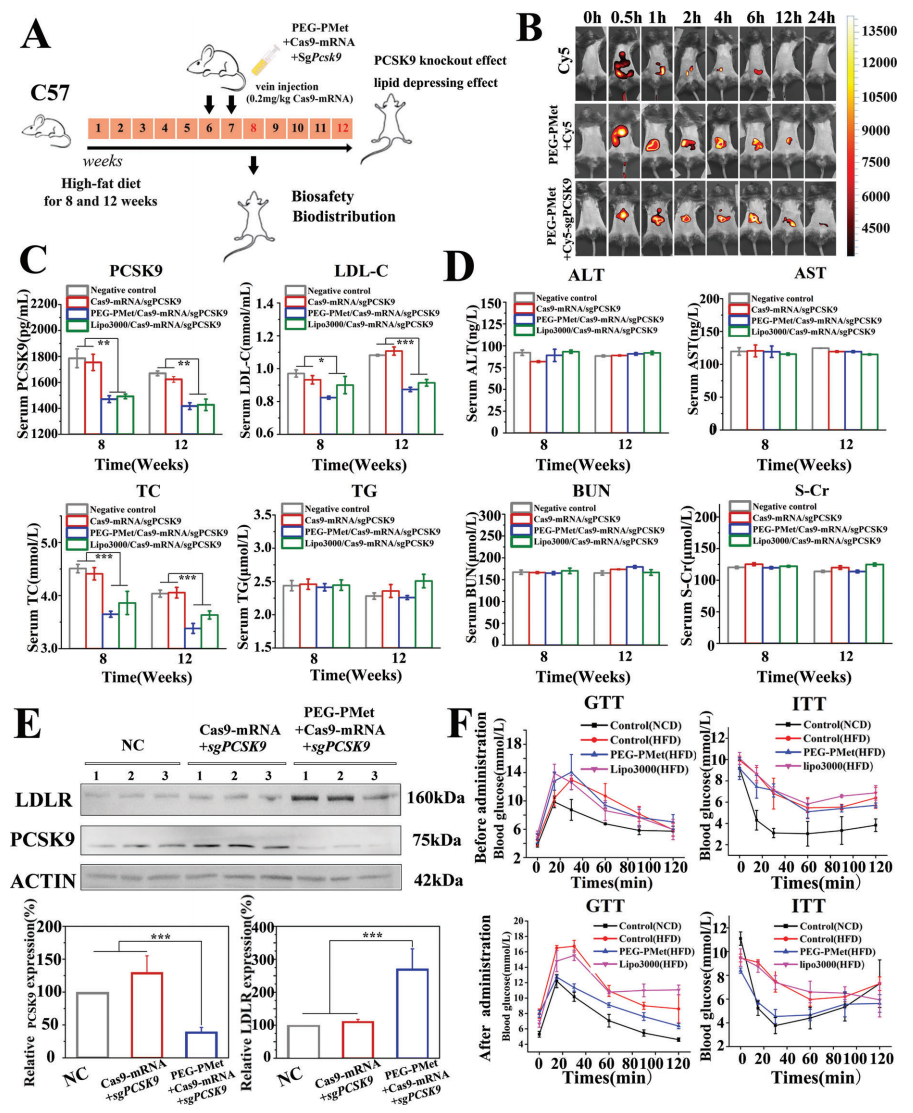
图五 PEG-PMet/Cas9-mRNA/sgPCSK9治疗可改善小鼠高脂血症[4]
综上所述,研究者设计合成的新型mPEG-b-P(Met/n-PMA)共聚物,通过静电和范德华力相互作用稳定地包裹核酸,可被肝脏CES1选择性地裂解激活,实现肝脏特异性的核酸递送。利用该共聚物,研究者实现了小鼠肝脏中PCSK9的有效基因组编辑,改善高脂血症,同时还具有降低血糖的作用。该研究建立了一种新的递送方式,实现CRISPR/Cas系统各成分的稳定负载、安全递送和定点释放,提供了一种新的设计思路,拓展了CRISPR/Cas9系统的应用。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Yin H, Kauffman KJ, Anderson DG. Delivery technologies for genome editing. Nature reviews Drug discovery 2017, 16(6):387-399.
2. Duan L, Ouyang K, Xu X, Xu L, Wen C, Zhou X, Qin Z, Xu Z, Sun W, Liang Y. Nanoparticle Delivery of CRISPR/Cas9 for Genome Editing. Frontiers in genetics 2021, 12:673286.
3. Zhou F, Wu C, Han F, Zhao Y, Yuan X. Development of cationic block copolymers for gene delivery. Journal of controlled release : official journal of the Controlled Release Society 2015, 213:e32.
4. Zhao Y, Li Y, Wang F, Gan X, Zheng T, Chen M, Wei L, Chen J, Yu C. CES1-Triggered Liver-Specific Cargo Release of CRISPR/Cas9 Elements by Cationic Triadic Copolymeric Nanoparticles Targeting Gene Editing of PCSK9 for Hyperlipidemia Amelioration. Advanced science (Weinheim, Baden-Wurttemberg, Germany) 2023, 10(19):e2300502.
5. Morales DR, Morris AD. Metformin in cancer treatment and prevention. Annual review of medicine 2015, 66:17-29.
6. Hashim PK, Okuro K, Sasaki S, Hoashi Y, Aida T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society 2015, 137(50):15608-15611.
7. Zheng M, Liu Y, Wang Y, Zhang D, Zou Y, Ruan W, Yin J, Tao W, Park JB, Shi B. ROS-Responsive Polymeric siRNA Nanomedicine Stabilized by Triple Interactions for the Robust Glioblastoma Combinational RNAi Therapy. Advanced materials (Deerfield Beach, Fla) 2019, 31(37):e1903277.
8. Hosokawa M. Structure and catalytic properties of carboxylesterase isozymes involved in metabolic activation of prodrugs. Molecules (Basel, Switzerland) 2008, 13(2):412-431.



