技术分享:Mettl3-m6A-Smpd3调控鞘脂代谢,促进出生后肝脏功能成熟
新生器官随着发育进程经历着组织的生长和功能的成熟,以适应功能需求和环境影响,而这些适应性过程由转录和表观遗传学协同调控[1]。肝脏是胚胎发育过程的主要造血部位,在成年后转化为主要代谢器官,并伴随着广泛的表观遗传修饰[2]。关于胚胎发育起始阶段的细胞来源和肝脏器官发生的相关研究已非常丰富[3],但对于出生后肝脏发育和功能成熟的调节机制知之甚少。RNA修饰被认为是表观遗传调控的新层面,其中N6-甲基腺苷(m6A)是真核生物中最普遍存在的mRNA修饰[4]。m6A沉积是由RNA甲基转移酶复合物所催化,包括有甲基转移酶样蛋白3(Mettl3)、Mettl14和Wilms肿瘤1相关蛋白(WTAP)。Mettl3在维持特定器官稳态的作用已有广泛研究[5],但Mettl3-m6A介导的表观转录调控在出生后肝脏发育过程中的确切作用仍然存在着争议。
2023年5月,Nature Metabolism期刊上发表了一篇新的Mettl3-m6A信号通路研究,揭示了其在出生后肝脏发育和功能成熟中的调控机制。胚胎期肝脏特异性的Mettl3缺失导致Smpd3在发育过程中过早的高表达,造成毒性神经酰胺的积累,导致线粒体损伤和内质网应激增强;而Smpd3抑制剂、敲低Smpd3或过表达Sgms1均可改善Mettl3缺失引起的肝脏异常。证明了Mettl3-m6A-Smpd3轴可调节肝脏鞘脂代谢稳态,保护出生后肝细胞免受过度神经酰胺积累和代谢紊乱[6]。
首先,研究者探究肝脏是如何在出生后发育和成熟为主要代谢器官。对C57BL/6J小鼠的12个时间点的转录组数据进行分析,涵盖了从胚胎晚期(E17.5)到成年(出生后第60天)的整个肝脏发育时期[7]。主成分分析(PCA)显示不同阶段的肝脏样本以时间依赖的方式分布(图一a),k-Means聚类分析进一步将转录本分为八个集群,并进行时间进程分析(图一b和c)。发现大多数已知的胎儿肝脏特异性基因,包括Afp和Igf2,富集在子集群4和5,表现为胚胎和新生儿肝脏的高度表达,并随着年龄的增长而下调(图一d)。这组基因决大多数与细胞分裂、细胞周期、DNA复制和细胞骨架结构相关,提示在胚胎肝脏的器官发生过程中,细胞增殖被转录沉默(图一b-d)。此外,这组下调基因还与DNA构象改变、组蛋白修饰和染色质结合相关,提示表观遗传学重编程与胎儿到成体肝脏成熟过程的密切相关(图一b–d)。子集群1和2的基因主要与组织形态发生、血管发育和细胞外基质结构相关,表现为在出生后特异性上调,并在2周后下降 ,这与它们在出生后肝脏发育早期阶段的作用相一致(图一b和d)。子集群7和8的基因多表现为出生后不断上调表达,主要参与了脂质、碳水化合物和小分子代谢,反映了出生后肝脏发育过程的代谢功能逐渐建立(图一b和d)。

图一 Mettl3在胚胎和新生肝脏中高表达,且在肝脏发育过程中表达下调[6]
差异表达基因的分析发现m6A甲基转移酶复合物的两个核心酶Mettl3和Mettl14都随着发育过程表达下调(图一d)。为了验证结果,研究者测量了不同年龄小鼠肝脏中Mettl3、Mettl14和其他m6A相关因子的表达水平。RT-qPCR分析显示Mettl3、Mettl14和Fto在出生后逐渐下调,而Wtap在新生儿和青春期肝脏的表达水平较高(图一e)。由于新生肝脏是造血细胞的临时器官,研究者进行免疫组织化学(IHC)分析,以确定Mettl3的表达变化是否归因于免疫细胞从肝脏的迁移。结果显示,肝细胞是胚胎和新生肝脏中表达Mettl3的主要细胞类型,而不是造血细胞;成年肝细胞的Mettl3表达远低于胚胎或新生儿(图一f)。RNA斑点印迹分析发现胚胎和新生肝脏的RNA m6A水平较高,并从第3周开始下降(图一g)。鉴于m6A对细胞命运转变至关重要,且出生后3-4周是肝脏生长和器官发生的关键时间窗口,期间伴随着肝脏功能成熟的起始,研究者推测Mettl3在出生后肝脏发育的过程中发挥着重要作用。
于是,研究者探究m6A修饰在肝脏发育中的作用。将Mettl3-floxed小鼠与albumin-Cre小鼠杂交,产生了肝脏特异性Mettl3 KO小鼠(Mettl3ΔHep)。RT-qPCR和WB证明了Mettl3的有效敲除(图二a和b);造成m6A水平显著降低(图二c);IHC结果证实了肝脏中的肝细胞特异性缺失Mettl3,而非实质细胞的表达未受影响(图二d)。Mettl3ΔHep小鼠的出生符合孟德尔遗传规律,但出生后的小鼠表现出发育迟缓(图二e和f)。经检测,Mettl3ΔHep小鼠出现肝损伤,血清丙氨酸氨基转移酶(ALT)和天冬氨酸转氨酶(AST)升高(图二g);肝脏表面粗糙苍白(图二h);出现肝细胞肥大,表现为细胞和细胞核均增大(图二i和j);肝脏的细胞凋亡显著增加(图二k);细胞凋亡基因如cl-Casp3、BAX、细胞色素 C(Cyt-C)和Hmgb1的蛋白表达均显著增加,p65(RelA)的磷酸化受到抑制(图二l和m)。作为肝损伤的补偿反应,Ki67、CK19和EpCAM的表达增加,提示出现肝细胞增殖和导管反应增强(图二l和n)。以上数据表明,胚胎期肝细胞特异性Mettl3缺失导致小鼠肝细胞肥大、肝脏损伤和生长迟缓。
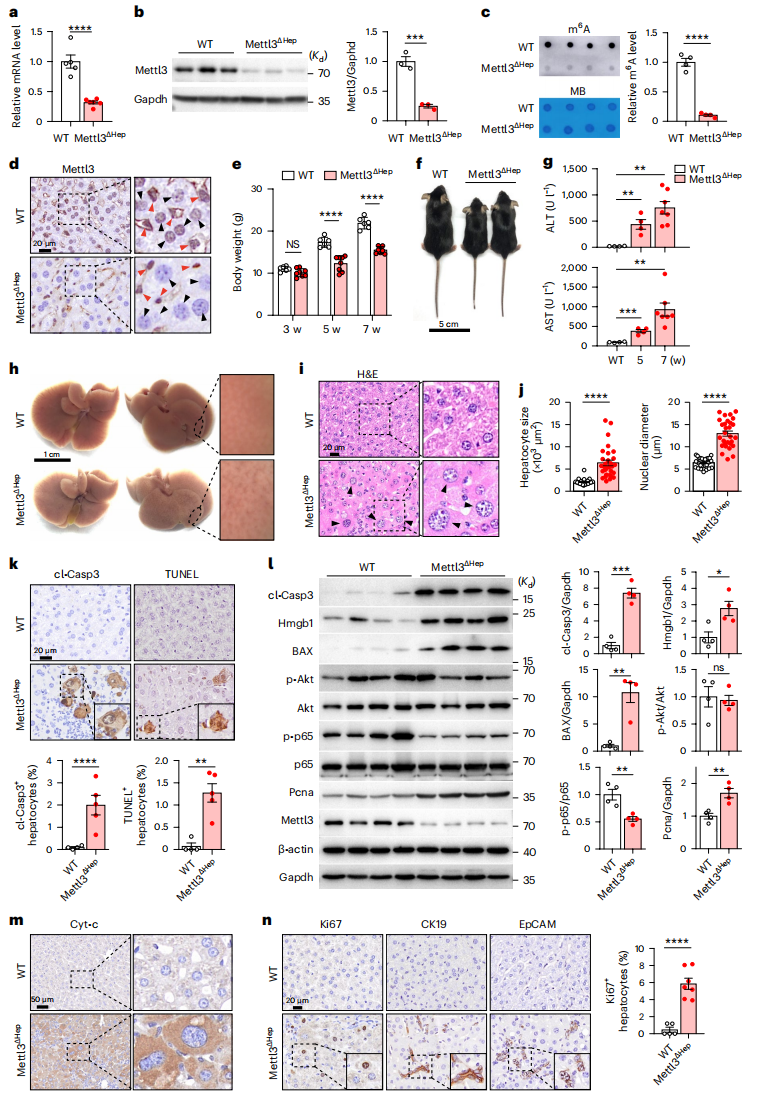
图二 胚胎期肝细胞特异性Mettl3缺失导致小鼠肝脏损伤和生长迟缓[6]
同时,研究者利用AAV8递送肝脏特异性TBG-Cre,将其注射到出生1周的Mettl3-floxed小鼠(AAV8-Cre)(图三a),发现AAV8-Cre小鼠没有表现出任何明显的肝损伤(图三b和c)。于是,研究者检测Mettl3表达情况,发现2周龄Mettl3ΔHep小鼠已出现显著的肝细胞Mettl3缺失表达,但在3周龄的AAV8-Cre小鼠中,肝细胞Mettl3仍有较高的表达水平(图三d和e),因此仍保留了相当大比例的肝脏m6A水平(图三f)。以上结果进一步支持设想:Mettl3介导的m6A修饰在出生后3-4周内的肝脏中发挥着关键作用。
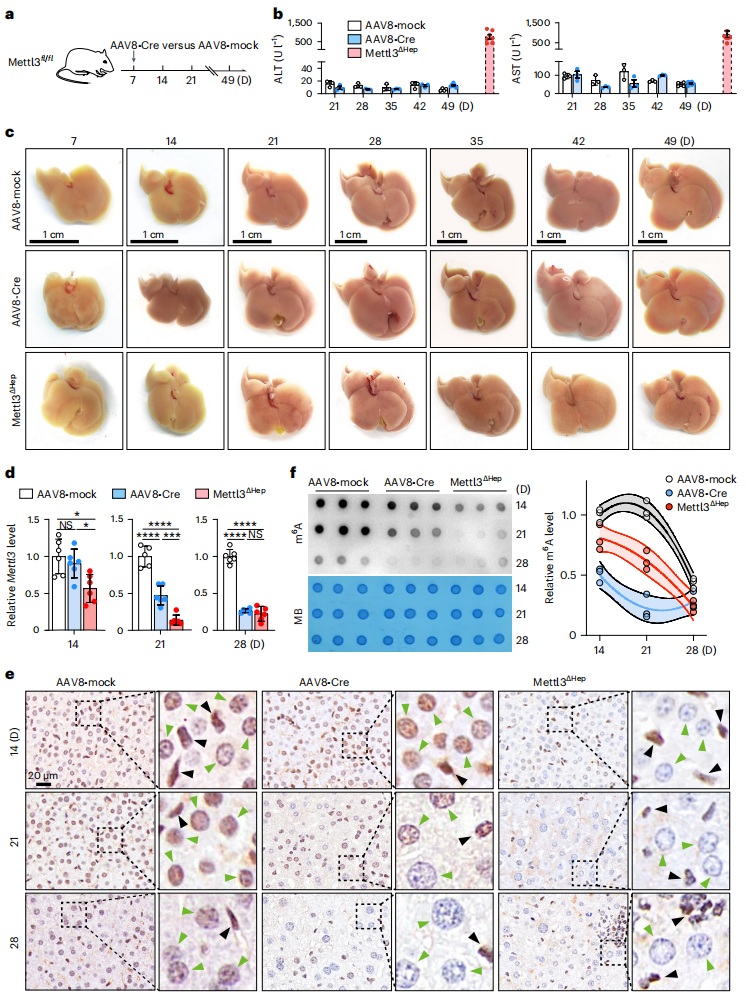
图三 出生后3周的肝细胞Mettl3缺失未能引起肝脏损伤[6]
接下来,研究者为寻找与发育缺陷密切相关的潜在靶基因,比较了Mettl3ΔHep与野生型(WT)小鼠肝脏的转录组。差异表达分析确定了833 个上调基因和654 个下调基因(图四a)。GO分析揭示Mettl3ΔHep肝脏的上调基因主要富集在染色质分离和细胞核分裂相关功能(图四b);下调基因主要富集在代谢途径,特别是脂肪酸和外源性代谢(图四c),提示Mettl3ΔHep肝脏的功能成熟尚未正确建立。KEGG分析也显示了Mettl3ΔHep小鼠广泛的肝脏代谢重编程,其中鞘脂代谢途径的上调最为显著(图四d和e)。经检测,鞘脂代谢相关基因在Mettl3ΔHep肝脏中大多转录上调(图四f和g);WB(图四h)和IHC(图四i和k)进一步证实催化鞘磷脂(SM)水解产生神经酰胺的Smpd1和Smpd3,以及神经酰胺从头合成限速酶Sptlc2的表达上调,其中Smpd3上调最为显著。以上结果表明,肝脏Mettl3缺乏导致肝脏代谢的重编程,表现为鞘脂生物合成失衡。
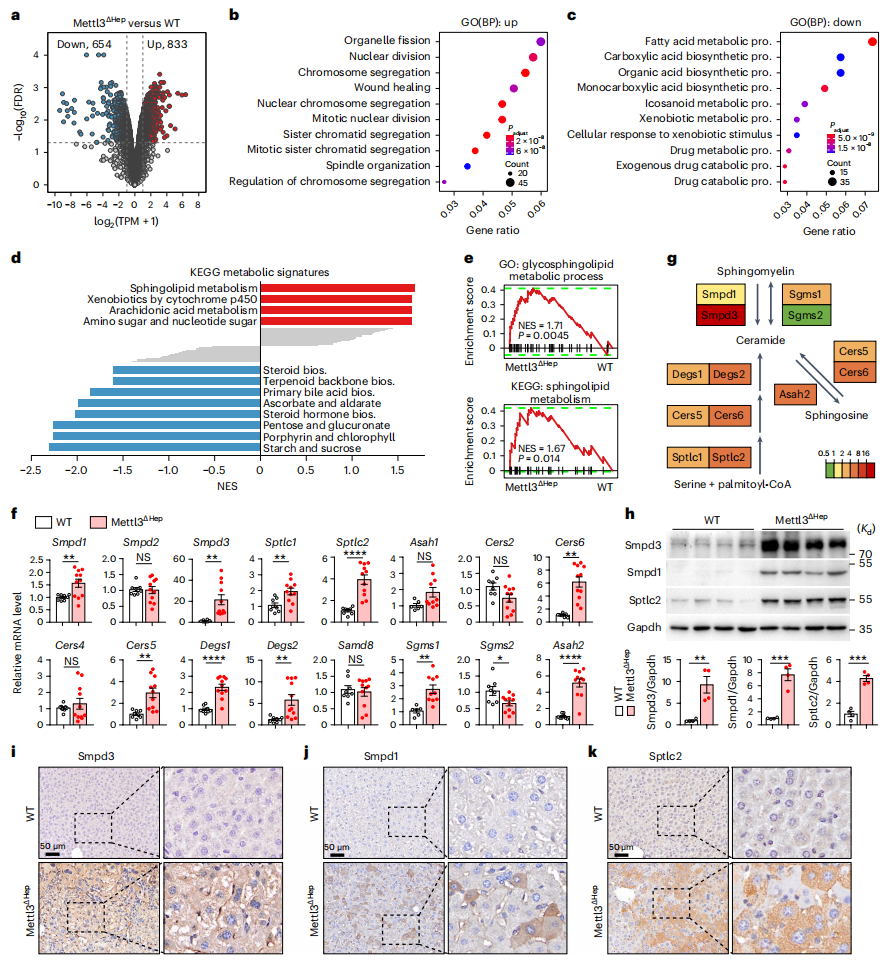
图四 胚胎期肝细胞特异性Mettl3缺失导致鞘脂代谢重编程[6]
接着,研究者鉴定m6A甲基化调控的下游基因,对Mettl3ΔHep和WT小鼠肝脏进行甲基化RNA免疫共沉淀和高通量测序(m6A-seq)。m6A-writer复合物优先在GGAC共有基序上进行m6A沉积,并且m6A修饰通常富集在终止密码子周围。正如预期,Mettl3 KO后,共有基序上的m6A富集减少(图五a);编码基因mRNA 3′ 端的m6A水平显著降低,导致m6A在转录本上的分布发生改变(图五b和c);m6A标记的mRNA相比非m6A标记的mRNA显著增多(图五d)。将m6A peak数据与RNA-seq数据对比显示,RNA-seq上调基因与m6A低甲基化基因的交集共714个(图五e),经KEGG分析同样富集出鞘脂代谢通路(图五f)。研究者用放线菌素D处理WT和Mettl3缺失的原代肝细胞进行RNA稳定性分析,测量16种鞘脂代谢相关转录本随时间的丰度变化,发现仅有在接近终止密码子区域含有m6A基序的Smpd3 mRNA在Mettl3 KO后更加稳定,而共有基序远离终止密码子的Smpd1和不含有共有基序的Sptlc2则变化不大(图五h)。m6A-RNA免疫沉淀(Me-RIP)结合RT-qPCR证实了Mettl3ΔHep肝脏中Smpd3 mRNA的m6A水平显著降低(图五g和i)。Mettl3-m6A-Ythdf2轴已被证明会破坏m6A修饰转录本的稳定性[8]。采用siRNA敲低Ythdf2后,发现Smpd3 mRNA的降解延缓,而对Smpd1和Sptlc2同样影响不大(图五j)。研究者进一步探索在出生后发育过程中,Mettl3介导的m6A修饰对Smpd3的调控作用。结果发现,Smpd3转录水平从出生后4周开始增加,这与出生后m6A水平相反;而Mettl3ΔHep小鼠由于胚胎期肝脏Mettl3缺失导致了Smpd3的过早表达;AAV8-Cre小鼠由于出生后3周仍有大量的m6A沉积,未出现过多的Smpd3上调(图五k和l)。以上数据表明,Mettl3通过m6A修饰调控Smpd3的表达。
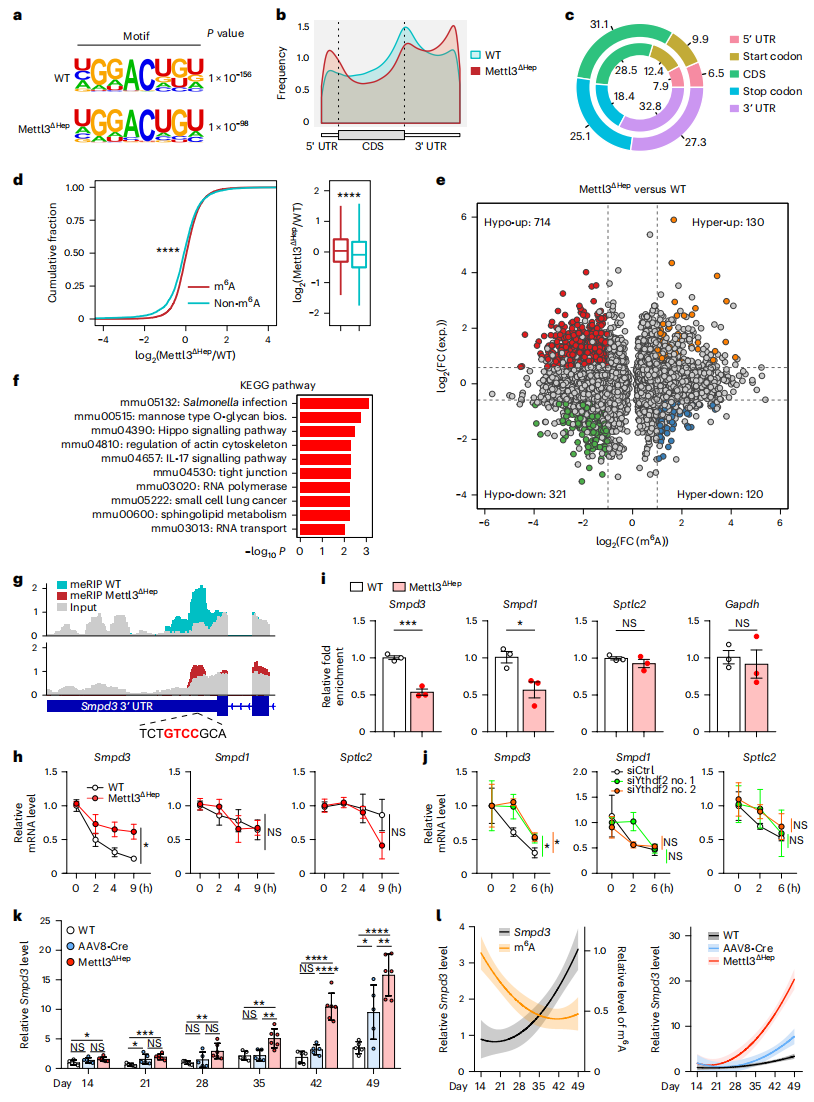
图五 Mettl3通过m6A修饰调控Smpd3 mRNA的降解[6]
鞘磷脂酶被应激激活后,可急性释放神经酰胺,引起组织功能障碍[9]。于是,研究者进行脂质代谢组分析,发现4种神经酰胺在Mettl3ΔHep肝脏中显著增多(图六a),导致线粒体结构异常(图六b)和内质网应激特征明显(图六c)。与WT小鼠相比,从Mettl3ΔHep小鼠分离的原代肝细胞线粒体膜电位降低(图六d和e),这些结构和功能变化伴随着线粒体细胞活性氧和应激反应标记物Ppargc1a和Dele1的显著升高(图六f和g)。对内质网未折叠蛋白反应(UPR)的三个分支通路分析显示,蛋白激酶R样内质网激酶途径被特异性激活,表现为Atf3、CHOP和磷酸化eIF2α蛋白表达上调,而Ire1α、Xbp1和Atf6的变化不明显(图六h和i)。此外,Atf3的下游靶点Eif2ak、Trib3和Bcl2,也在Mettl3ΔHep肝脏中表达增加(图六i)。IHC进一步证实Mettl3缺失肝细胞的内质网应激增强(图六j和k)。以上结果表明,胚胎期肝细胞特异性Mettl3缺失导致神经酰胺积累,造成线粒体损伤和内质网应激。
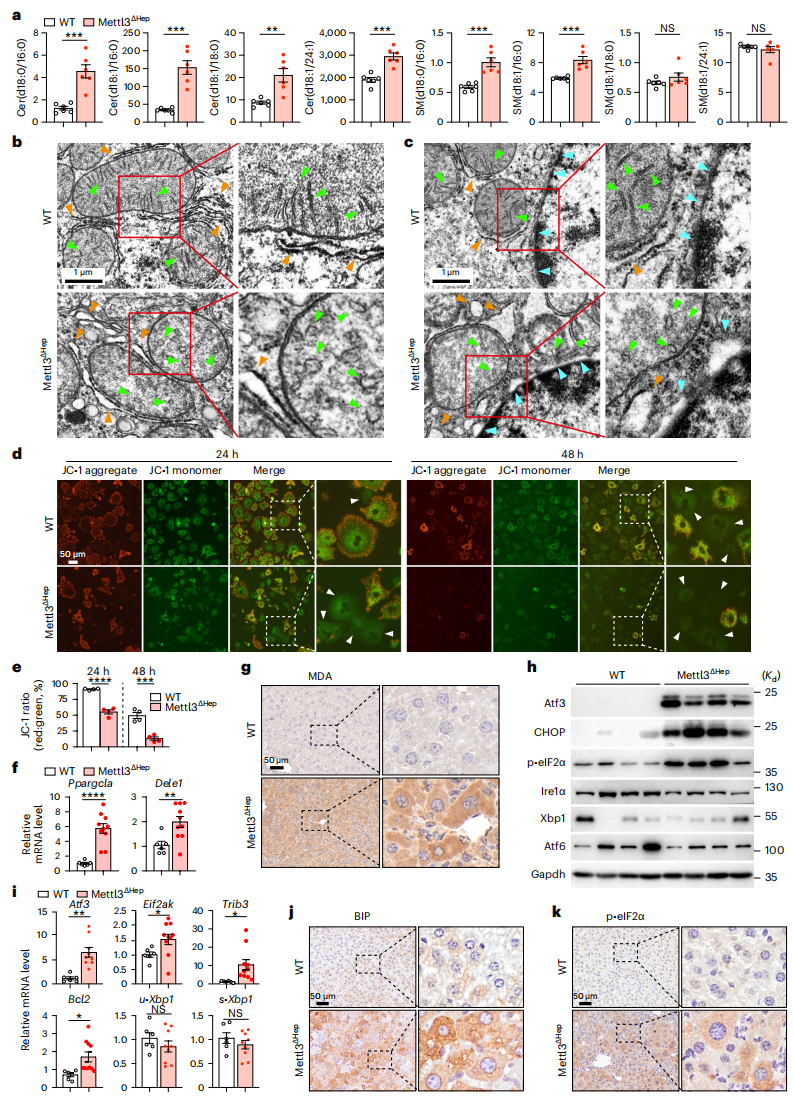
图六 Mettl3ΔHep肝脏出现神经酰胺积累、线粒体损伤和内质网应激[6]
最后,研究者使用Smpd3拮抗剂GW4869或者敲低Smpd3,都可以改善Mettl3ΔHep小鼠肝脏的线粒体损伤、内质网应激和功能损伤。此外,研究者还发现鞘磷脂合成酶Sgms1的过表达也可以挽救Mettl3ΔHep小鼠表型,改善肝脏损伤。以上证明了Mettl3-m6A-Smpd3轴调节肝脏鞘脂代谢稳态的作用。
综上所述,研究者发现胚胎期肝脏特异性的Mettl3缺失致使下游靶标Smpd3转录本的降解不足,造成毒性神经酰胺积累、鞘脂代谢紊乱,引发线粒体损伤和内质网应激,最终导致肝脏损伤和机体生长迟缓。降低Smpd3或过表达Sgms1均可改善Mettl3缺失引起的肝脏异常。该研究证明了Mettl3-m6A-Smpd3轴调节肝脏鞘脂代谢稳态的作用,突出了表观转录调控机制在出生后肝脏发育过程中协调器官生长和功能成熟的关键作用,为理解新生儿健康和肝脏发育提供了重要线索。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Zamboulis DE, Thorpe CT, Ashraf Kharaz Y, Birch HL, Screen HR, Clegg PD: Postnatal mechanical loading drives adaptation of tissues primarily through modulation of the non-collagenous matrix. eLife 2020, 9.
2. Lotto J, Drissler S, Cullum R, Wei W, Setty M, Bell EM, Boutet SC, Nowotschin S, Kuo YY, Garg V et al: Single-Cell Transcriptomics Reveals Early Emergence of Liver Parenchymal and Non-parenchymal Cell Lineages. Cell 2020, 183(3):702-716 e714.
3. Mu T, Xu L, Zhong Y, Liu X, Zhao Z, Huang C, Lan X, Lufei C, Zhou Y, Su Y et al: Embryonic liver developmental trajectory revealed by single-cell RNA sequencing in the Foxa2(eGFP) mouse. Communications biology 2020, 3(1):642.
4. Frye M, Harada BT, Behm M, He C: RNA modifications modulate gene expression during development. Science 2018, 361(6409):1346-1349.
5. Karagianni P, Moulos P, Schmidt D, Odom DT, Talianidis I: Bookmarking by Non-pioneer Transcription Factors during Liver Development Establishes Competence for Future Gene Activation. Cell Rep 2020, 30(5):1319-1328 e1316.
6. Wang S, Chen S, Sun J, Han P, Xu B, Li X, Zhong Y, Xu Z, Zhang P, Mi P et al: m(6)A modification-tuned sphingolipid metabolism regulates postnatal liver development in male mice. Nature metabolism 2023, 5(5):842-860.
7. Gunewardena SS, Yoo B, Peng L, Lu H, Zhong X, Klaassen CD, Cui JY: Deciphering the Developmental Dynamics of the Mouse Liver Transcriptome. Plos One 2015, 10(10):e0141220.
8. Wang X, Lu Z, Gomez A, Hon GC, Yue Y, Han D, Fu Y, Parisien M, Dai Q, Jia G et al: N6-methyladenosine-dependent regulation of messenger RNA stability. Nature 2014, 505(7481):117-120.
9. Moylan JS, Smith JD, Wolf Horrell EM, McLean JB, Deevska GM, Bonnell MR, Nikolova-Karakashian MN, Reid MB: Neutral sphingomyelinase-3 mediates TNF-stimulated oxidant activity in skeletal muscle. Redox biology 2014, 2:910-920.



