技术分享:生酮饮食促进肿瘤铁死亡,但造成皮质酮缺乏加速恶病质
癌症是一种代谢性疾病,癌细胞通过调整自身新陈代谢水平以适应营养需求,维持其生长和增殖。利用含有高脂肪和低碳水化合物的生酮饮食(ketogenic diet,KD)可抑制癌细胞对葡萄糖的依赖,起到抗炎和抑制肿瘤生长的作用[1, 2]。癌细胞还可通过诱导饮食摄入的变化来改变宿主代谢,最终导致恶病质[3]。癌症恶病质是一种严重的消耗综合征,在癌症患者的发生率高达80%,其特征是食物摄入量的减少和体重减轻,加剧了发病率和死亡率[4]。然而,在分泌IL-6的癌症小鼠模型中,肝脏的生酮作用受到抑制,并最终导致癌症恶病质[5],提示此时的宿主机体无法将富含脂质 生酮饮食代谢为维持生存的能量分子。那么,生酮饮食对肿瘤和宿主机体的影响及其作用机制又是怎样的呢?
2023年6月,Cell Metabolism上报道了一项研究,发现生酮饮食减缓了小鼠肿瘤的生长,但却加速恶病质的发作反而缩短了生存期[6]。具体而言,生酮饮食导致肿瘤脂质过氧化物的增加以及谷胱甘肽(GSH)系统的饱和,促进癌症细胞发生铁死亡,从而抑制肿瘤的生长。然而此时的生酮饮食损害了皮质酮的生物合成,导致荷瘤小鼠出现肾上腺功能不全和代谢适应性不良,加速恶病质的发作。生酮饮食配合地塞米松(Dex)治疗处理可改善荷瘤小鼠的食物摄入和代谢平衡,在维持抗肿瘤能力的同时,延缓癌症恶病质发作,进而延长生存期[6]。
首先,研究者探索了生酮饮食对分泌IL-6恶病质癌症和宿主的影响。采用的是BALB/c小鼠皮下移植14天C26的结直肠癌小鼠模型和KPC胰腺癌 (KrasG12D/+;Trp53R172H/+;Pdx-1-Cre) 小鼠模型,待瘤子大于3-5毫米时分别进行生酮饮食(KD)或正常饮食喂养(NF)。在两种模型中,生酮饮食荷瘤小鼠的肿瘤生长均显著减慢(图一A和B),但是小鼠生存期显著缩短(图一C和D),提前出现癌症恶病质(大于15%体重减轻)。实验终点时,荷瘤小鼠表现出皮下和性腺脂肪组织的损失、股四头肌质量的减少和脾肿大等恶病质体征。血糖监测显示,正常饮食荷瘤小鼠的血糖水平虽然低于无瘤小鼠,但仍能维持血糖平衡;而生酮饮食荷瘤小鼠不能维持血糖平衡,表现为血糖的持续性降低(图一E和F)。生酮饮食出现循环酮的显著增加,但生酮饮食荷瘤小鼠的循环酮水平相比无瘤小鼠增加得更慢些(图一G和H)。以上数据表明,在两种癌症恶病质模型中,生酮饮食削弱了荷瘤小鼠维持葡萄糖水平的代谢反应,但并没有打破肿瘤介导的生酮抑制,最终表现为虽延缓了肿瘤生长,但缩短了生存期。
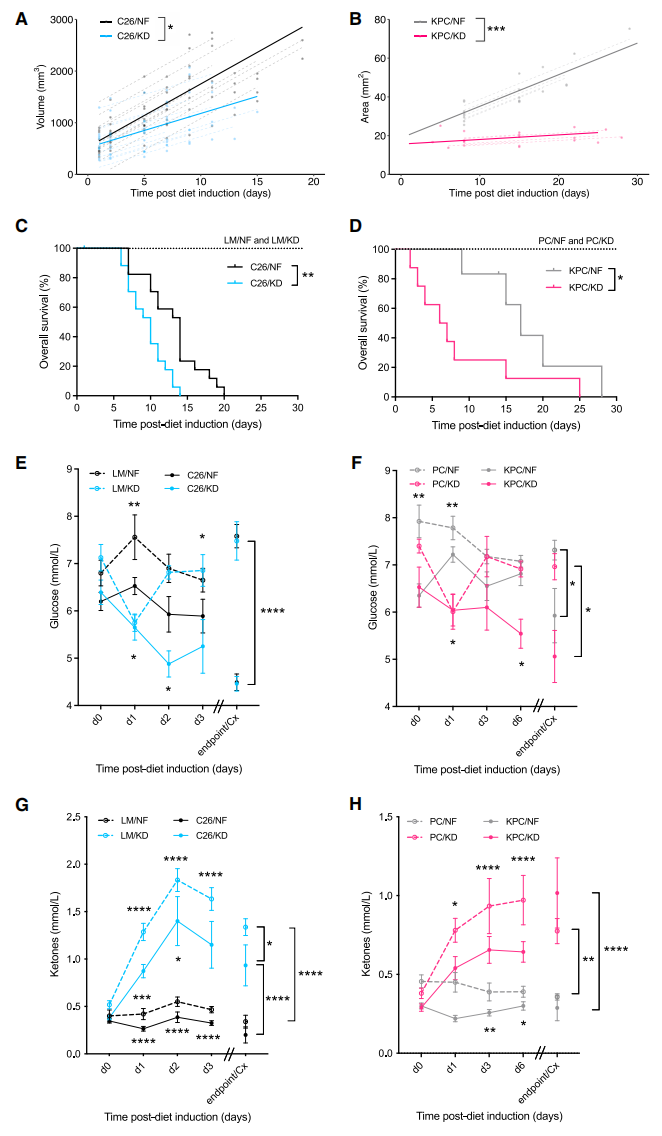
图一 生酮饮食延缓小鼠肿瘤生长,但加速恶病质并缩短生存期[6]
生酮饮食为脂质过氧化反应和脂质自由基的形成增加了底物,这可能影响了肿瘤和宿主的氧化还原状态。在生理条件下,脂质过氧化率低且无毒。因为细胞内抗氧化防御系统如NADPH依赖的谷胱甘肽(GSH)系统可迅速去除脂质氢过氧化物(LOOHs)。当这种解毒失败时,脂质过氧化产物(LPPs)如4-HNE、4-HHE和MDA的积累,会导致铁死亡[7]。于是,研究者对各组小鼠的肝脏和肿瘤组织进行了代谢组学分析。结果发现,4-HNE在生酮饮食荷瘤小鼠的肝脏中显著积累(图二A),肝脏和肿瘤的GSH/GSSG比值显著降低(图二B和C),肿瘤GSH生物合成的底物半胱氨酸也减少(图二D),肿瘤4-HNE也在生酮饮食后显著增加(图二E和F),并在用抗氧化剂N-乙酰半胱氨酸(NAC)处理促进GSH合成后被抑制生成(图二E),表明生酮饮食荷瘤小鼠的肝脏解毒功能下降,GSH系统出现饱和,导致有毒的LPPs增加。研究者进一步检测Fe2+和Fe3+的水平,发现铁死亡的间接标志物Fe2+在生酮饮食肿瘤中增加,并在NAC处理后减少(图二G和H)。H&E染色也观察到生酮饮食小鼠肿瘤中出现一个死亡肿瘤核心(图二I)。肝组织IHC染色显示, 4-HNE在生酮饮食荷瘤小鼠的肝细胞质和细胞核中均显著增加(图二J和K),NAC处理后肿瘤明显增大(图二L)。另外,铁死亡抑制剂Liprogstatin-1的处理加速了生酮饮食荷瘤小鼠的肿瘤生长,但对正常饮食小鼠没有影响(图二M)。以上数据表明,生酮饮食造成脂质过氧化物的增加,进而诱导了铁死亡,这是生酮饮食抑制肿瘤生长的主要原因。
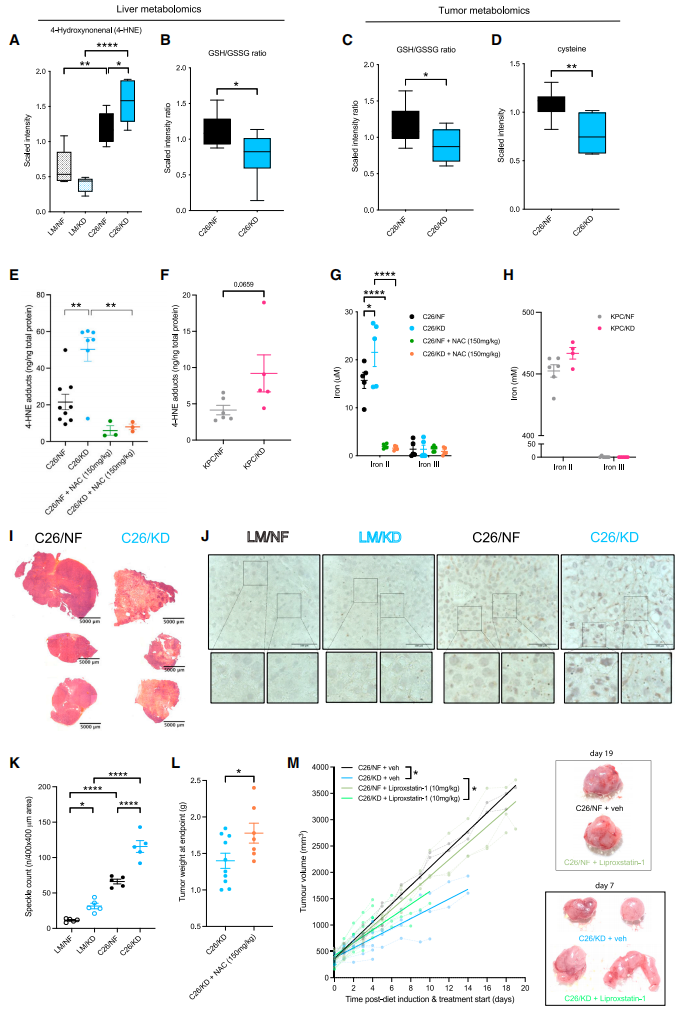
图二 生酮饮食诱导的癌细胞铁死亡可被抗氧化剂NAC处理所抑制[6]
在人类和小鼠癌症恶病质模型中,持续的代谢应激可增加糖皮质激素水平。皮质酮作为代谢压力的标志物,研究者进一步量化肾上腺皮质酮生物合成和底物胆固醇的循环水平。发现当恶病质发生时,正常饮食荷瘤小鼠的皮质酮浓度急剧增加,而生酮饮食组却没有明显升高(图三A和B)。两组荷瘤小鼠的胆固醇水平相似(图三C和D),但生酮饮食荷瘤小鼠的血浆孕烯醇酮水平显著增加(图三E),提示皮质酮的合成路径受阻。醛固酮是一种源自皮质酮下游加工的盐皮质激素,其主要作用之一是钠滞留。研究者注意到生酮饮食荷瘤小鼠出现了低钠血症(图三F)。促肾上腺皮质激素(ACTH)是一种由垂体产生的激素,驱动肾上腺合成皮质酮。研究者发现荷瘤小鼠的ATCH水平下调,但在生酮饮食后有小幅增加(图三G)。研究者选取了两个时间点来评估ACTH刺激肾上腺的反应性:第一个在饮食改变第4天给予ACTH刺激,此时荷瘤小鼠的皮质酮基线水平较高,而生酮饮食荷瘤小鼠对ACTH刺激的皮质酮上调不敏感(图三H);第二个在恶病质发作时给予ACTH刺激,生酮饮食荷瘤小鼠的皮质酮同样变化不大 (图三I)。以上数据表明,生酮饮食荷瘤小鼠的内源性肾上腺对激素的刺激反应和释放皮质酮存在困难,肾上腺功能不全造成皮质酮缺乏。
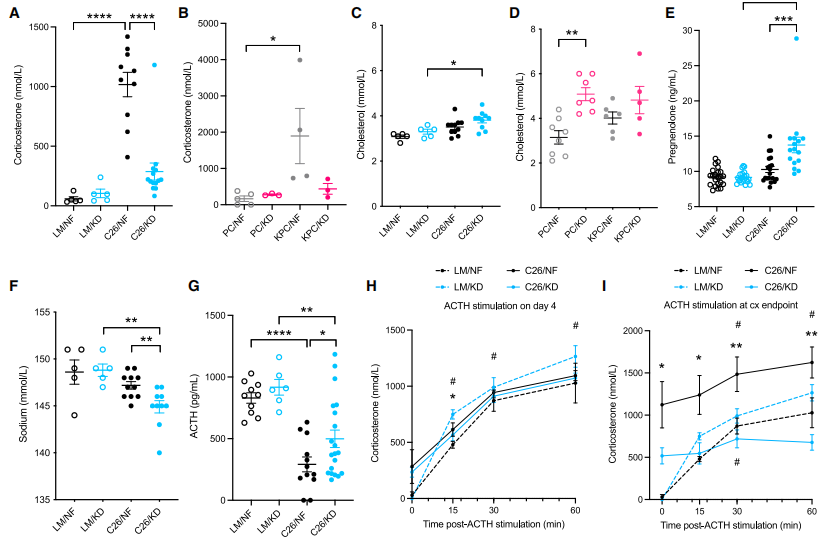
图三 生酮饮食造成荷瘤小鼠的皮质酮缺乏[6]
最后,研究者探究生酮饮食荷瘤小鼠的生存期短是否由皮质酮缺乏所导致。地塞米松(Dex)是一种合成的长效型糖皮质激素类似物。给予Dex处理可显著延长生酮饮食荷瘤小鼠的生存期(图四A);然而Dex促进肿瘤生长,使得正常饮食荷瘤小鼠的无进展生存期缩短(图四B)以及肿瘤体积增大(图四C);Dex处理后,生酮饮食荷瘤小鼠的肿瘤体积不变(图四C),4-HNE增加(图四D)。仅4天的处理,Dex即可挽救生酮饮食造成荷瘤小鼠的脂肪组织耗竭(图四E)、循环葡萄糖水平(图四F)、肝脏糖异生(图四G)和TCA循环活性(图四H)。研究者检测了小鼠的呼吸交换率(RER),发现生酮饮食小鼠的RER水平低且变化少,表明多采用脂肪酸作为能量来源;生酮饮食荷瘤小鼠的RER水平更低,但在Dex处理后可得到恢复(图四I)。Dex处理也增加了生酮饮食荷瘤小鼠的食物摄入量(图四J)和总能量消耗(图四K和L)。以上数据表明,地塞米松治疗处理可显著延长生酮饮食荷瘤小鼠的生存期,改善其代谢适应性,减轻癌症恶病质。
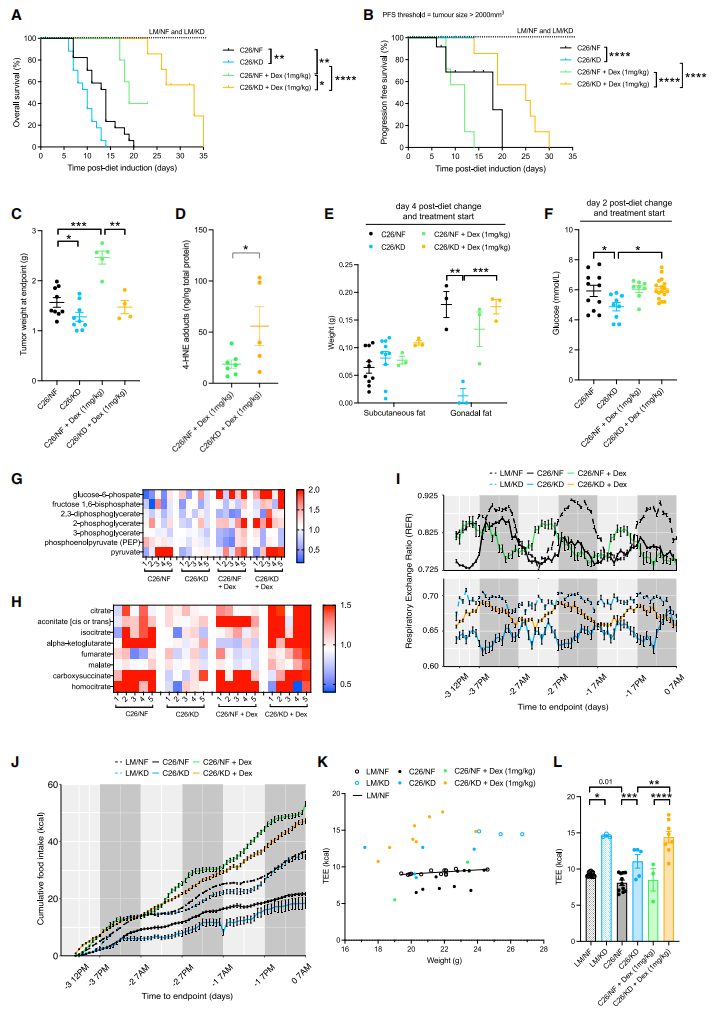
图四 地塞米松可增加生酮饮食荷瘤小鼠的生存期和减轻癌症恶病质[6]
综上所述,该研究发现生酮饮食虽然在分泌IL-6的肿瘤小鼠模型中减缓了肿瘤生长,但却加速恶病质的发作缩短了生存期。生酮饮食配合地塞米松治疗处理可改善荷瘤小鼠的食物摄入和代谢平衡,在维持抗肿瘤能力的同时,延缓癌症恶病质发作,延长生存期。该研究对癌症患者的营养干预与癌症恶病质的治疗改善具有重要的参考价值,提示生酮饮食配合糖皮质激素药物的联合治疗对于肿瘤治疗有较大的临床应用潜力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Nakamura K, Tonouchi H, Sasayama A, Ashida K: A Ketogenic Formula Prevents Tumor Progression and Cancer Cachexia by Attenuating Systemic Inflammation in Colon 26 Tumor-Bearing Mice. Nutrients 2018, 10(2).
2. Schwartz K, Chang HT, Nikolai M, Pernicone J, Rhee S, Olson K, Kurniali PC, Hord NG, Noel M: Treatment of glioma patients with ketogenic diets: report of two cases treated with an IRB-approved energy-restricted ketogenic diet protocol and review of the literature. Cancer & metabolism 2015, 3:3.
3. von Haehling S, Anker SD: Prevalence, incidence and clinical impact of cachexia: facts and numbers-update 2014. J Cachexia Sarcopenia Muscle 2014, 5(4):261-263.
4. Ferrer M, Anthony TG, Ayres JS, Biffi G, Brown JC, Caan BJ, Cespedes Feliciano EM, Coll AP, Dunne RF, Goncalves MD et al: Cachexia: A systemic consequence of progressive, unresolved disease. Cell 2023, 186(9):1824-1845.
5. Flint TR, Janowitz T, Connell CM, Roberts EW, Denton AE, Coll AP, Jodrell DI, Fearon DT: Tumor-Induced IL-6 Reprograms Host Metabolism to Suppress Anti-tumor Immunity. Cell Metab 2016, 24(5):672-684.
6. Ferrer M, Mourikis N, Davidson EE, Kleeman SO, Zaccaria M, Habel J, Rubino R, Gao Q, Flint TR, Young L et al: Ketogenic diet promotes tumor ferroptosis but induces relative corticosterone deficiency that accelerates cachexia. Cell Metab 2023.
7. Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, Patel DN, Bauer AJ, Cantley AM, Yang WS et al: Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell 2012, 149(5):1060-1072.



