技术分享:肿瘤细胞外囊泡和颗粒导致肝脏代谢功能障碍
癌症是一种系统性疾病,可由其释放的可溶性因子如细胞外囊泡和颗粒(EVP)介导,改变其他无转移器官的功能[1, 2]。原发性肿瘤来源的EVP可在多个无转移器官中建立转移前微环境(PMNs),并且重塑细胞功能[3]。肝脏作为肿瘤EVP靶向的主要器官之一[4],无肿瘤转移的肝脏功能重塑领域还未得到广泛研究,以及EVP如何改变肝脏功能及其作用机制还有待阐明。
2023年5月,Nature期刊上报道了一项肿瘤细胞外囊泡和颗粒(EVP)引起肝脏代谢功能障碍的研究,揭示了肿瘤来源EVP是癌症诱导肝脏功能重塑的关键介质,证明了包裹在肿瘤EVP里的饱和脂肪酸会诱导肝脏Kupffer细胞分泌肿瘤坏死因子(TNF),产生促炎性肝脏微环境,抑制脂肪酸代谢和氧化磷酸化,从而促进脂肪肝形成和肝脏代谢功能障碍,降低化疗耐受性。通过消除Kupffer细胞或阻断TNF可显著性抑制肿瘤诱导的脂肪肝形成,可能具有增强化疗疗效的作用[5]。
首先,研究者探索癌症是如何影响肝脏的。将容易发生肺部转移的B16F10黑色素瘤细胞和K7M2骨肉瘤细胞分别原位植入小鼠,3-4周后,两种模型均未观察到肿瘤肝转移,且仅有K7M2模型检测到肺转移。对无癌症转移的肝脏进行RNA测序分析,发现这两种肿瘤移植模型中有469个上调基因和317个下调基因的表达变化相一致(图一a)。基因集富集分析(GSEA)发现免疫稳态和代谢的失调,包括炎症反应和TNF激活NF-κB通路的上调,以及氧化磷酸化和脂肪酸代谢的下调(图一b),表明尽管没有发生肿瘤肝转移,不同类型肿瘤仍系统地、一致地重塑了小鼠肝脏功能。脂质组学质谱分析显示,两种荷瘤小鼠肝脏的多种脂质类别,如磷脂、鞘脂、中性脂质、胆固醇酯和甘油三酸酯显著升高(图一c和d);BODIPY染色发现肝脏脂滴积聚增加,表现出脂肪肝特性(图一e和f)。研究者进一步确定该结果的临床相关性,对发生肝外转移的胰腺导管腺癌(PDAC)患者的肝活检进行RNA-seq分析,发现了类似的免疫稳态和代谢功能紊乱(图一g),以及在相近的体脂率下,表现出脂肪肝疾病(图一h)。以上数据表明,在没有肿瘤肝转移的情况下,远端肿瘤可以破坏肝脏代谢,并诱导癌症小鼠以及患者形成脂肪肝。
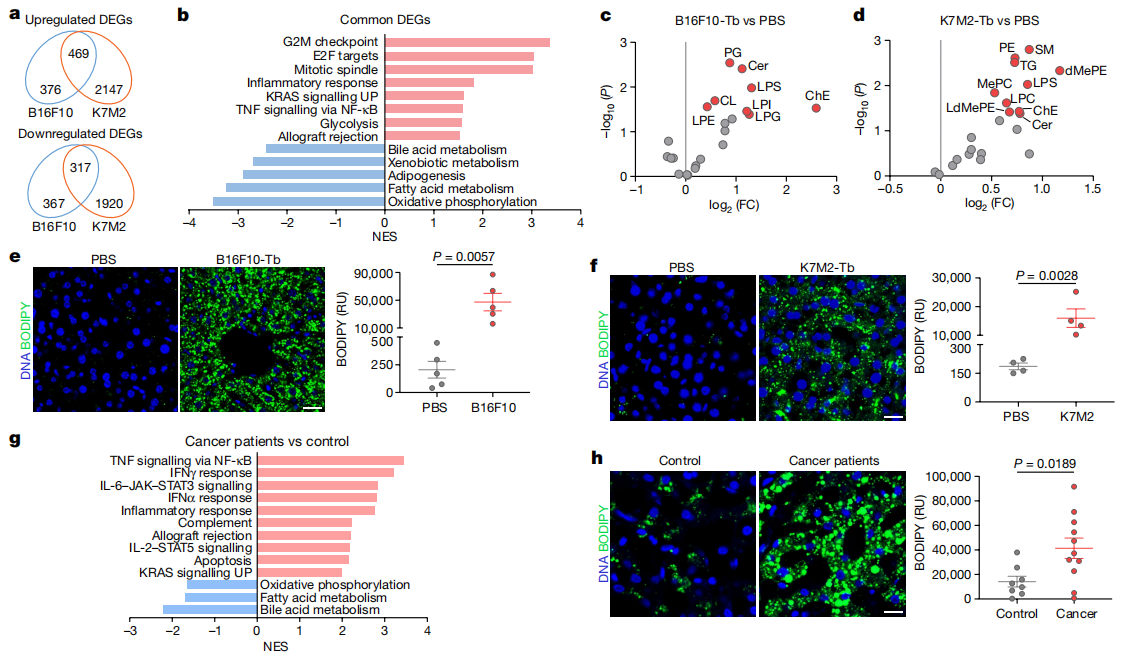
图一 远端原发性肿瘤诱发肝脏的代谢功能障碍[5]
肝脏是肿瘤EVP的主要靶标器官[4]。于是,研究者探索是否是肿瘤EVP靶向肝脏引起代谢功能障碍和脂肪肝的形成。从B16F10和K7M2肿瘤外植体中分离出EVP(TE-EVP),经近红外染料标记,尾静脉注射至小鼠体内24小时,全器官成像证实肝脏摄取了TE-EVP(图二a和b)。为了更好地模拟肿瘤EVP的作用,研究者将TE-EVP两天一次尾静脉注射入小鼠体内,连续EVP培养4周后进行肝脏分析。在TE-EVP培养的肝脏中,转录组分析显示炎症反应增加和代谢降低(图二c和d);代谢组学发现脂质代谢相关途径、氨基酸和碳水化合物的富集(图二e和f);脂质组学发现神经酰胺、胆固醇酯、甘油三酯的丰度上调(图二g和h);以及脂滴积聚增加(图二i和j)。将EVP进一步分成大外泌体、小外泌体和外泌颗粒三种亚群,同样注射培养4周,BODIPY染色发现它们均可诱导肝脏脂滴积聚的增加(图二k和l)。以上数据表明,肿瘤EVP是癌症诱导肝脏功能重塑的关键介质,可系统性地破坏肝脏代谢,诱导脂肪肝的形成。
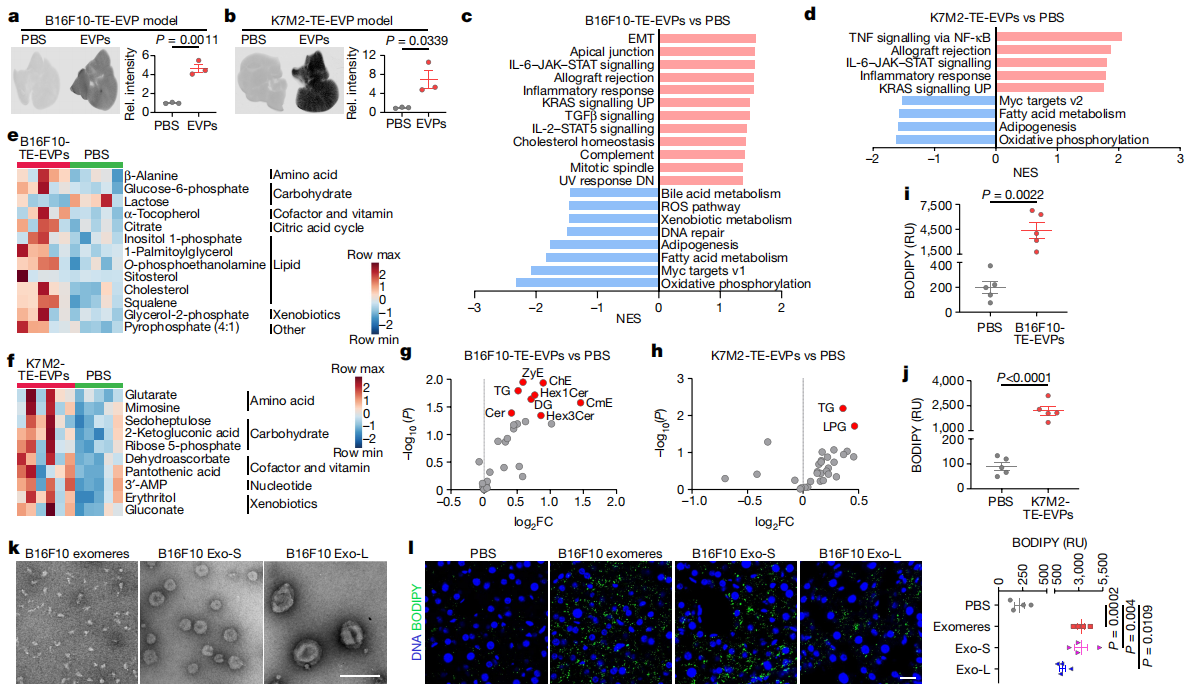
图二 肿瘤来源的EVP诱导肝脏代谢功能障碍[5]
为明确肿瘤EVP靶向的肝脏细胞类型,研究者从B16F10和K7M2细胞中分离出EVP(CL-EVP)荧光标记后注射到小鼠,24h后肝脏流式分析发现,CL-EVP主要被CD45+免疫细胞和CD31+血管内皮细胞吸收,其中超过90%吸收EVP的CD45+免疫细胞是Cd11b+F4/80+的Kupffer细胞(图三a和b)。于是,研究者在两种肿瘤植入后第12或15天时,静脉注射氯膦酸盐脂质体去除荷瘤小鼠的Kupffer细胞(图三c),发现两种肿瘤移植模型小鼠的肝脏脂滴积聚显著减少,且不影响原发肿瘤的生长(图三d)。研究者利用Kupffer细胞清除小鼠的精密肝切片(PCLS)进行体外EVP处理,两种肿瘤模型的CL-EVP和TE-EVP都不能诱导脂滴形成(图三e和f)。以上数据表明,Kupffer细胞对于肿瘤EVP诱导的脂肪肝形成是必要的。
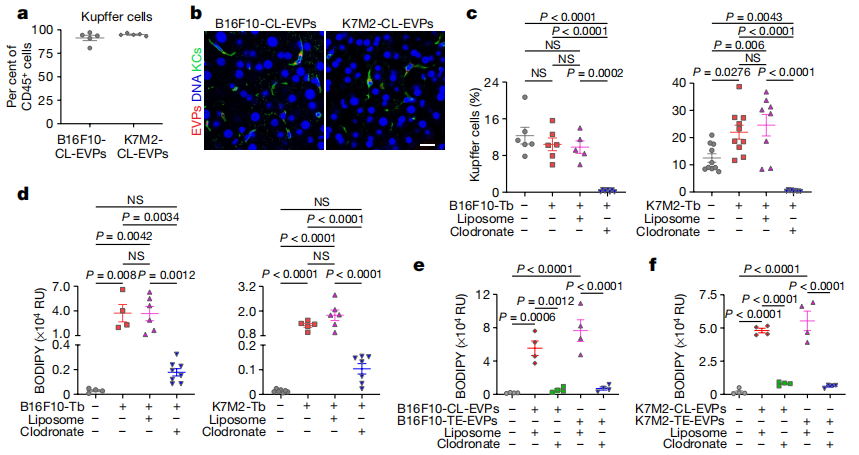
图三 Kupffer细胞摄取肿瘤EVP可诱导脂肪肝的形成[5]
研究者在两种肿瘤移植模型小鼠分离的Kupffer细胞中发现多种细胞因子的富集,提示存在着炎症性肝脏微环境。酶联免疫吸附试验(ELISA)证实,荷瘤小鼠以及CL-EVP或TE-EVP培养小鼠的血浆TNF水平显著高于对照组(图四a和b)。用重组TNF处理原代肝细胞,发现显著诱导脂滴的形成(图四c)。于是,研究者给荷瘤小鼠腹腔注射TNF阻断抗体,观察到在不影响肿瘤生长的情况下,肝脏脂滴积累的减少(图四d),TNF抗体处理CL-EVP培养小鼠也获得了类似的结果(图四e)。为了研究EVP包裹的哪些物质导致了Kupffer细胞的激活,研究者采用代谢物质谱分析发现长链饱和脂肪酸在B16F10-TE-EVP中富集。经游离脂肪酸的定量质谱证实,CL-EVP中存在着多种饱和脂肪酸(棕榈酸浓度最高)和不饱和脂肪酸的富集(图四f和g)。脂肪酸合成酶抑制剂C75的处理显著减少了游离脂肪酸含量,进而降低了EVP诱导Kupffer细胞的Tnf表达(图四h)。据报道,饱和脂肪酸可促进TLR4依赖的信号转导[6]。于是,研究者用TLR4抑制剂TAK预处理Kupffer细胞1小时,再用CL-EVP培养处理4小时,发现抑制TLR4可显著性降低CL-EVP诱导的Tnf表达(图四i)。以上数据表明,肿瘤EVP包裹的棕榈酸等脂肪酸可诱导Kupffer细胞分泌TNF,而特异性阻断TNF可显著降低肿瘤诱导的脂肪肝生成。
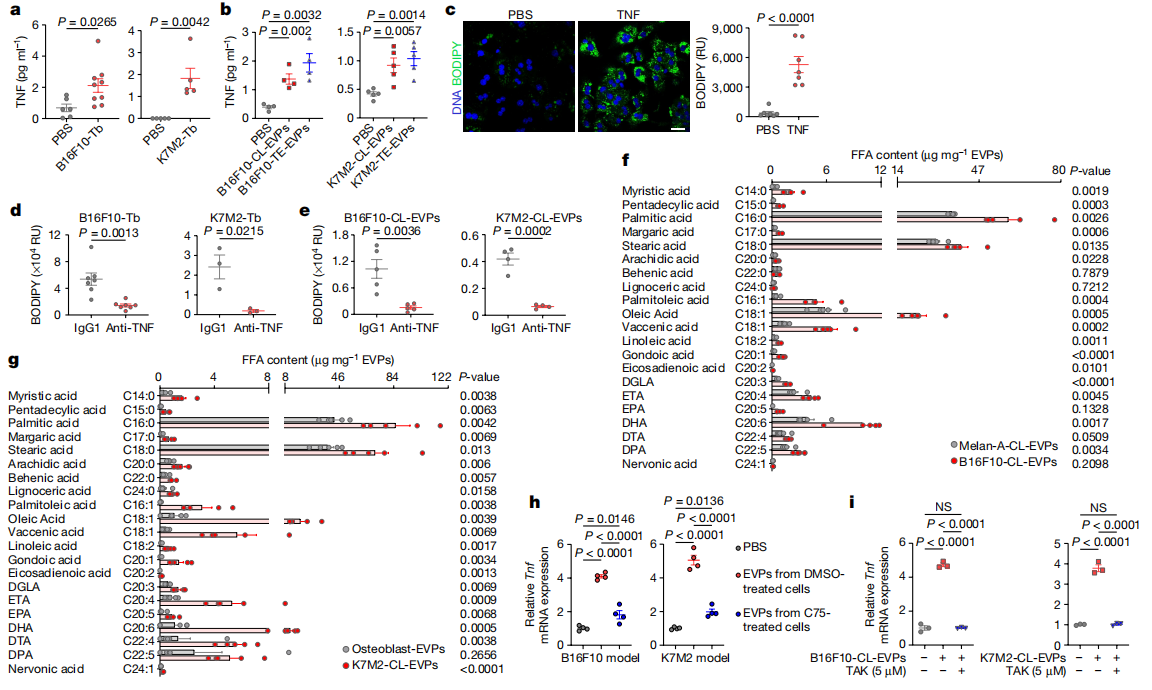
图四 肿瘤EVP包裹的棕榈酸可诱导Kupffer细胞分泌TNF并促进脂肪肝生成[5]
据报道,晚期癌症患者对标准化疗的耐受性较低,可能是由于肝脏的解毒功能受损[7]。研究者猜测肿瘤EVP诱导的脂肪肝和炎症可能会抑制肝脏的药物代谢,经实验发现重组TNF下调了小鼠肝细胞中与人细胞色素P450同源的多个Cyp核心基因的表达(图五a),这些基因在荷瘤小鼠或CL-EVP培养小鼠的肝细胞中也被下调表达,并在特异性阻断TNF后重新挽救表达(图五b和c)。GSEA显示,在TNF处理的原代肝细胞、荷瘤小鼠以及肝外转移的胰腺癌患者的肝脏中,药物代谢细胞色素P450信号通路均被下调(图五d)。由于肿瘤EVP诱导的药物代谢受损可能引起化疗毒性,因此研究者评估了达卡巴嗪和阿霉素的毒性。采用B16F10-CL-EVP预培养小鼠一周后,腹腔注射达卡巴嗪或0.9%氯化钠,发现EVP培养小鼠的红细胞、网织红细胞和血红蛋白均显著性下降(图五e)。另外,采用K7M2-CL-EVP预培养小鼠25天后,腹腔注射阿霉素或DMSO,超声心动图显示,阿霉素降低了EVP培养小鼠的左心室射血分数和缩短分数(图五f),出现心力衰竭症状。以上数据表明,肿瘤EVP通过损害肝脏药物代谢来增强化疗毒性,进而降低了癌症患者的化疗耐受性。
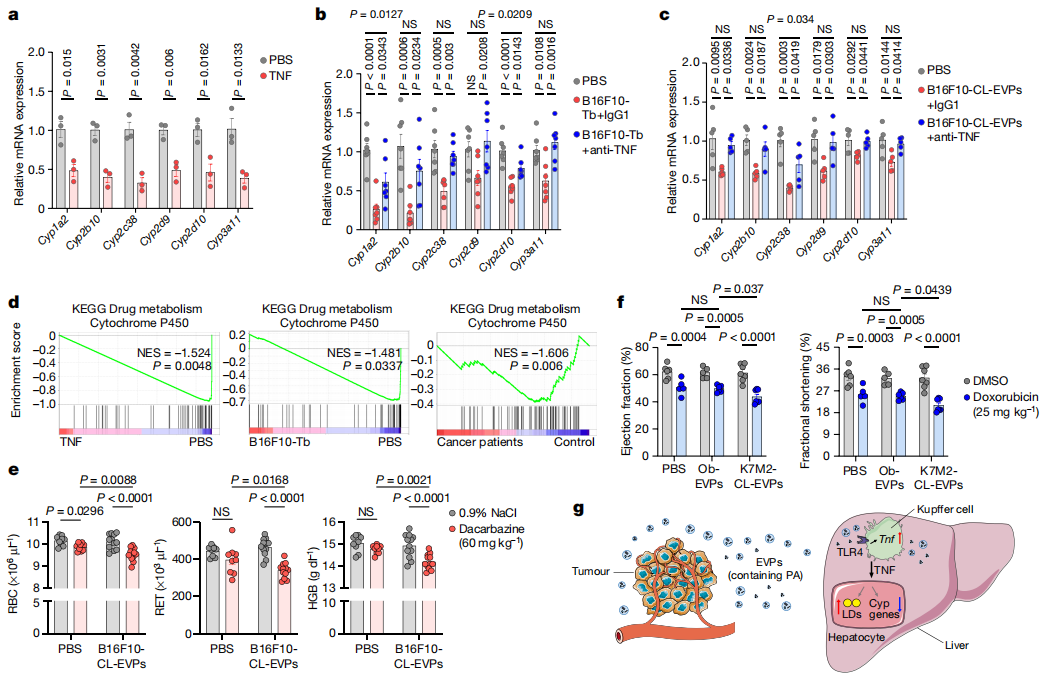
图五 肿瘤EVP可抑制肝脏药物代谢,增强化疗毒性[5]
综上所述,研究者证明了远端肿瘤分泌的EVP可在无转移肝脏中诱导炎症并下调脂质分解代谢,实现对小鼠和癌症患者的肝脏功能重塑(图五g)。通过在多种小鼠肿瘤模型和肿瘤患者的肝组织中进行多组学分析,证明了肿瘤EVP诱导的TNF分泌增加,可下调肝脏Cyp基因的表达,进而损害药物代谢功能。提示将TNF抑制剂与化疗相结合,可能恢复化疗癌症患者的肝功能,突出了癌症治疗中需考虑全身性、系统性影响的重要性。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. McAllister SS, Weinberg RA: The tumour-induced systemic environment as a critical regulator of cancer progression and metastasis. Nat Cell Biol 2014, 16(8):717-727.
2. Wang G, Biswas AK, Ma W, Kandpal M, Coker C, Grandgenett PM, Hollingsworth MA, Jain R, Tanji K, Lomicronpez-Pintado S et al: Metastatic cancers promote cachexia through ZIP14 upregulation in skeletal muscle. Nat Med 2018, 24(6):770-781.
3. Lucotti S, Kenific CM, Zhang H, Lyden D: Extracellular vesicles and particles impact the systemic landscape of cancer. EMBO J 2022, 41(18):e109288.
4. Costa-Silva B, Aiello NM, Ocean AJ, Singh S, Zhang H, Thakur BK, Becker A, Hoshino A, Mark MT, Molina H et al: Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver. Nat Cell Biol 2015, 17(6):816-826.
5. Wang G, Li J, Bojmar L, Chen H, Li Z, Tobias GC, Hu M, Homan EA, Lucotti S, Zhao F et al: Tumour extracellular vesicles and particles induce liver metabolic dysfunction. Nature 2023, 618(7964):374-382.
6. Rocha DM, Caldas AP, Oliveira LL, Bressan J, Hermsdorff HH: Saturated fatty acids trigger TLR4-mediated inflammatory response. Atherosclerosis 2016, 244:211-215.
7. Vasilogianni AM, Al-Majdoub ZM, Achour B, Peters SA, Rostami-Hodjegan A, Barber J: Proteomics of colorectal cancer liver metastasis: A quantitative focus on drug elimination and pharmacodynamics effects. Br J Clin Pharmacol 2022, 88(4):1811-1823.



