技术分享:Kupffer细胞分泌IL-6诱导成熟肝细胞去分化
肝脏是人体重要的代谢和解毒器官,具有强大的再生能力。肝脏损伤后,成熟肝细胞的去分化是肝细胞再生的重要来源之一。成熟肝细胞在发生门静脉肝脏损伤后,可以重新激活重编程相关基因(reprogramming related gene,RRG)表达,进而去分化为类肝前体细胞(liver progenitor-like cell, LPLC)来修复肝脏。例如,在3,5-二乙氧羰基-1,4-二氢吡啶(DDC)诱导的门静脉肝脏损伤中,成熟肝细胞重编程为LPLC,后者产生了约25%的新生肝细胞和一定的胆管细胞,促进了肝脏的损伤修复再生[1]。然而,LPLC的产生具有特定的区域性,主要发生在距离损伤胆管1-5层的区域[2]。因此,是否存在一个损伤特异性的信号驱动LPLC的形成?该信号又是如何诱导成熟肝细胞的重编程?这些肝细胞重编程的相关机制研究,对于肝脏相关疾病治疗和药物开发,具有重要意义。
2023年3月,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组与中国科学院上海营养与健康研究所李虹研究组和李亦学研究组等团队合作,在Cell Stem Cell期刊发表了一项肝脏驻留Kupffer细胞分泌的炎症信号IL-6诱导了肝细胞去分化的机制研究[3]。具体而言,Kupffer细胞分泌炎症信号IL-6与肝细胞表达受体IL-6RA/gp130复合物相结合,激活肝细胞Stat3的表达,进而STAT3结合到Arid1a预先开放的成熟肝细胞中RRG增强子区域,诱导肝祖细胞基 因的表达,从而促进肝脏的损伤修复再生。
首先,研究者对门静脉肝脏损伤期间特异性形成的LPLC的分子特征和激活信号通路进行表征,发现LPLC定位于门静脉区周围,既显示出肝细胞形态,又同时表达肝细胞标志物HNF4α和肝脏祖细胞标志物SOX9(图一A和B)。小鼠经DDC损伤处理1周后,收集肝细胞进行单细胞测序。通过表达谱分析将细胞划分为25个细胞亚群,伪时间分析模拟出正常肝细胞-受损肝细胞-PreLPLC-LPLC-PostLPLC的轨迹排序(图一C和D)。在正常肝细胞受损转变为LPLC的过程中,肝功能相关基因的表达显著减少,肝脏祖细胞增殖相关基因的表达显著增加(图一E)。研究者共筛选出232个LPLC特异性富集的RRG(图一F),它们也在E12.5胚胎的成肝细胞中富集表达(图一G),表明肝细胞的去分化重新激活了胚胎发育时期的基因。此外,已报道的Notch、Wnt、TGF-β和Hippo/Yap信号通路确实在肝细胞去分化过程中被激活;重要的是,发现了免疫相关的信号通路被特异性激活(图一H和I)。以上数据表明,在肝细胞损伤重编程的过程中,免疫相关信号通路与LPLC的形成具有显著的相关性。
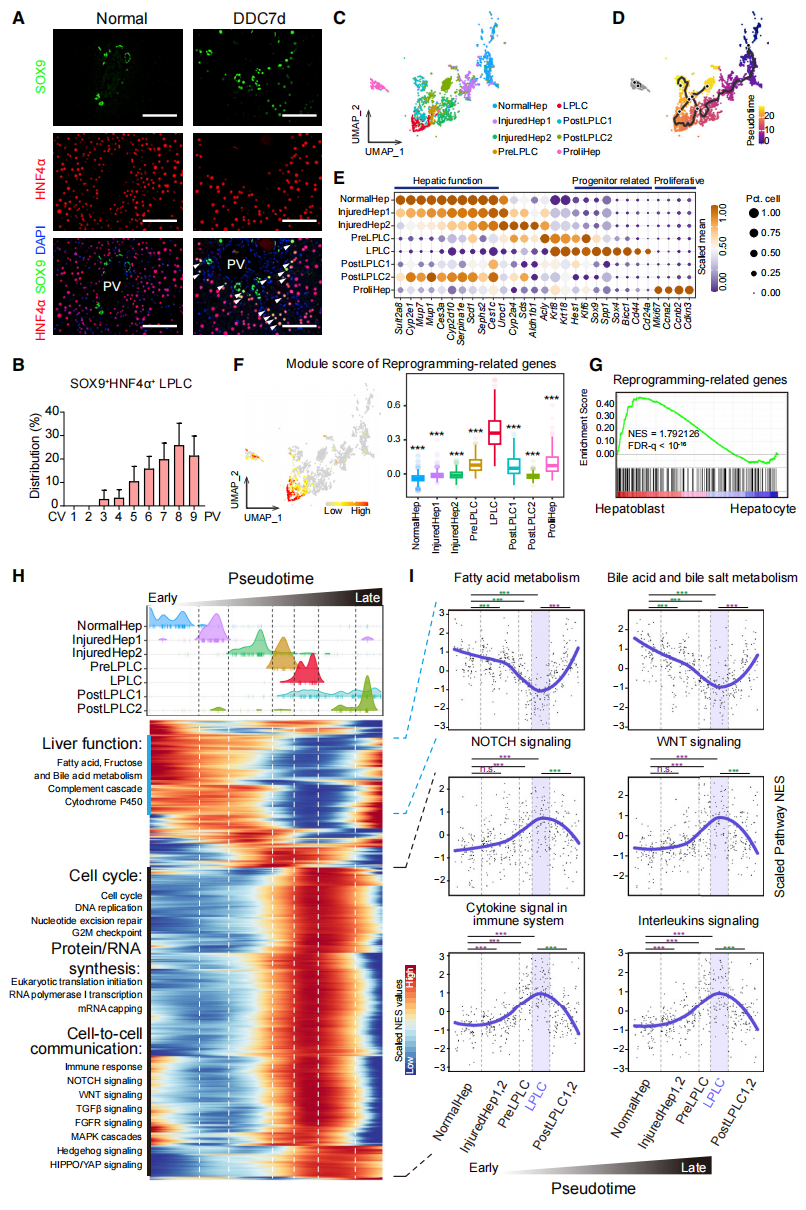
图一 肝细胞损伤重编程的单细胞分析[3]
然后,研究者验证免疫细胞是否参与肝细胞损伤重编程。免疫细胞定量分析结果显示,受损肝脏中T细胞、B细胞、NK细胞、中性粒细胞、单核细胞和巨噬细胞的数量都显著增加(图二A)。在T细胞、B细胞和NK细胞缺失小鼠(图二B和C)和中性粒细胞缺失小鼠(图二D和E)中,肝脏损伤后,SOX9+ HNF4a+的LPLC形成与野生型WT小鼠没有明显不同,但在巨噬细胞缺失小鼠中LPLC形成显著减少(图二F和G)。进一步分析发现,巨噬细胞主要在门静脉区周围显著富集,且细胞体积显著大于中央静脉区周围的巨噬细胞(图二H和I)。DDC诱导巨噬细胞缺失小鼠的肝脏损伤后,血清碱性磷酸酶(ALP)、总胆汁酸(TBA)和Ki67+水平显著升高(图二J和K),表明巨噬细胞缺失后LPLC形成减少,导致肝损伤后的修复功能受损。
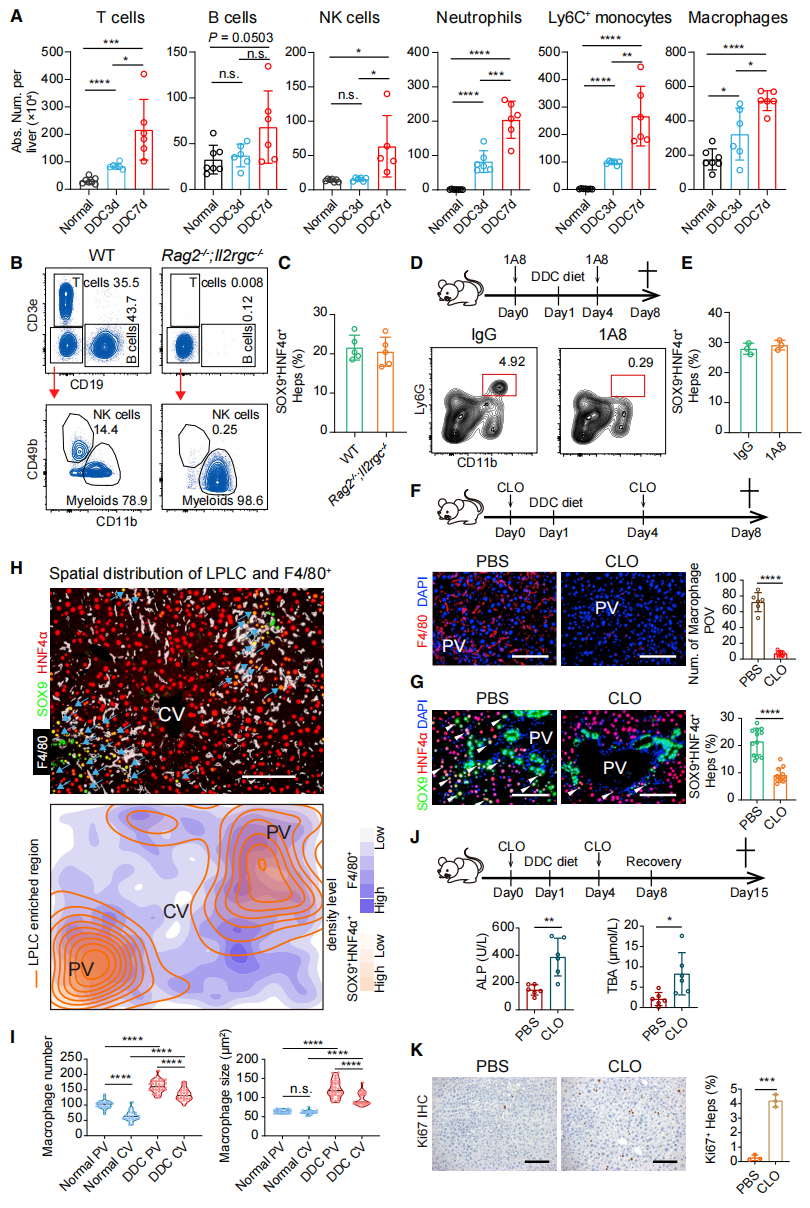
图二 巨噬细胞调控肝细胞损伤重编程[3]
巨噬细胞存在异质性,在损伤的肝脏中包含两种巨噬细胞亚型:一种是肝脏驻留Kupffer细胞(KC),另一种是肝脏损伤后招募的单核来源的巨噬细胞 (MoMF)。于是,研究者进行巨噬细胞的单细胞测序(图三A和B)。细胞定量结果显示,DDC诱导肝损伤后Kupffer细胞和MoMF的数量显著升高(图三C)。经Kupffer细胞标记物CLEC4F、MoMF标记物CX3CR1、巨噬细胞标记物MS4A3定位结果显示,Kupffer细胞定位于损伤肝脏的肝小叶内,MoMF被招募到门静脉区附近(图三D和E)。MoMFs缺失小鼠在肝损伤后LPLC的形成没有明显变化(图三F和G),但Kupffer细胞缺失小鼠的LPLC形成受到显著的抑制作用(图三H和I)。以上数据表明,Kupffer细胞在肝细胞损伤重编程的过程中发挥了关键作用。
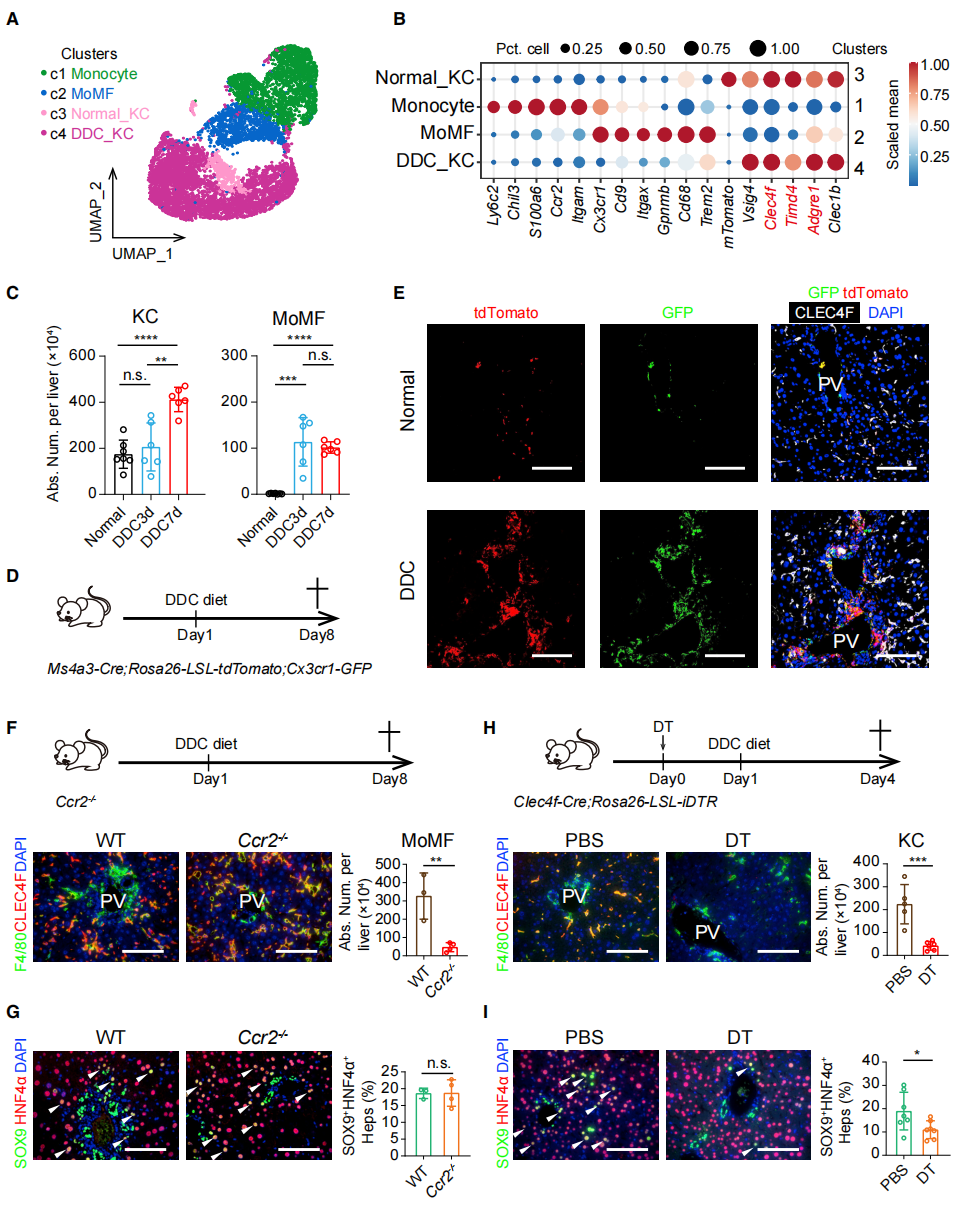
图三 肝脏驻留Kupffer细胞是LPLC形成所需的巨噬细胞亚型[3]
接着,研究者分析Kupffer细胞是如何诱导肝细胞去分化。结合巨噬细胞的单细胞测序结果,选择了6个Kupffer细胞分泌特异的炎症因子、7个其他炎症因子和3个Wnt配体进行过表达测试验证(图四A)。WT小鼠的质粒尾静脉高压注射结果显示,IL-6是唯一能稳定诱导SOX9+ HNF4a+的LPLC产生的炎症因子(图四B)。在这些过表达IL-6的细胞中,确实发现RRG高表达以及肝功能相关基因的低表达(图四C),证明了IL-6诱导了肝细胞重编程。在Kupffer细胞特异性敲除Il6(图四D和E),发现IL-6缺失导致DDC诱导的LPLC形成明显减少(图四F)。Kupffer细胞和LPLC的共染色结果显示,LPLC附近的Kupffer细胞体积显著增大(图四G和H),提示这些Kupffer细胞可能被激活。利用scRNA-seq数据将DDC-KC分为两个亚群(图四I),其中Cluster 1的炎症细胞因子Il6、Tnf和Il1a表达显著上调(图四J)。信号通路分析也证实了IL-6诱导该亚群的吞噬作用及TLR通路相关基因表达显著上调(图四K)。IL-6阳性Kupffer细胞相比IL-6阴性细胞,其细胞体积更大(图四L)。以上数据表明,肝脏损伤后,部分Kupffer细胞被激活,分泌的IL-6诱导了门静脉周围LPLC的形成(图四M)。
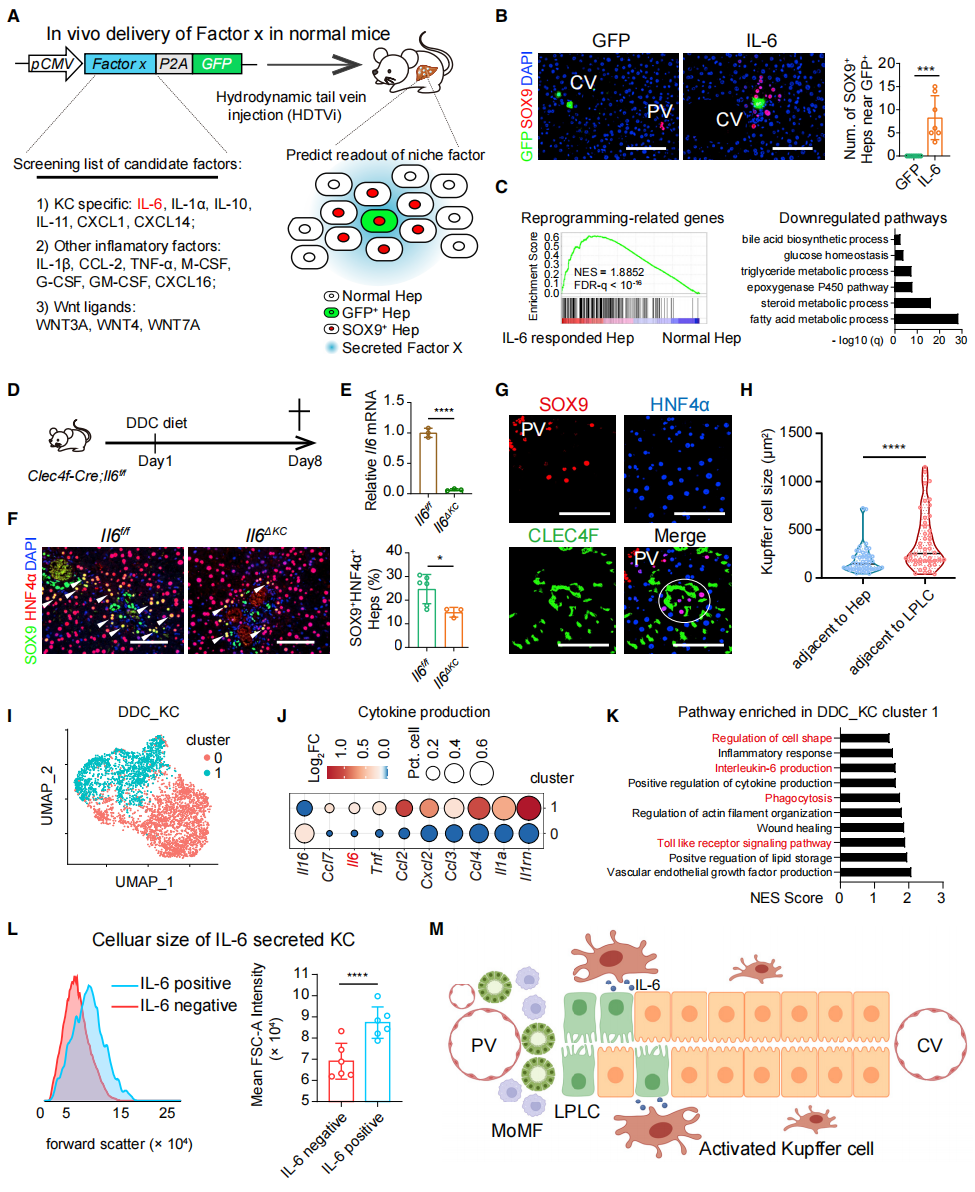
图四 Kupffer细胞激活表达的IL-6触发了肝细胞重编程[3]
研究者进一步验证IL-6与肝细胞是否有直接的相互作用(图五A)。已知IL-6信号转导需要与受体IL-6RA和共同受体gp130相结合[4],进而分别在小鼠肝细胞中特异性敲除Il6ra(Il6raΔli)和gp130(gp130Δli),发现IL-6RA或gp130的缺失都显著抑制了DDC诱导的LPLC形成(图五B和C)。另外,IL-6与IL-6RA/gp130受体结合后,可激活JAK/STAT3信号通路的表达[4]。经验证,STAT3的缺失(Stat3Δli)也显著抑制了LPLC的形成(图五D)。随后,观察小鼠DDC诱导肝损伤后修复1周的恢复情况(图五E和I),发现gp130Δli和Stat3Δli小鼠的导管反应和纤维化仍然明显(图五F和J),血清ALP和TBA仍处于较高水平(图五G和K),肝细胞增殖也处于较高的活性状态(图五H和L)。以上数据表明,IL-6/STAT3信号通路在肝损伤修复中具有关键作用。
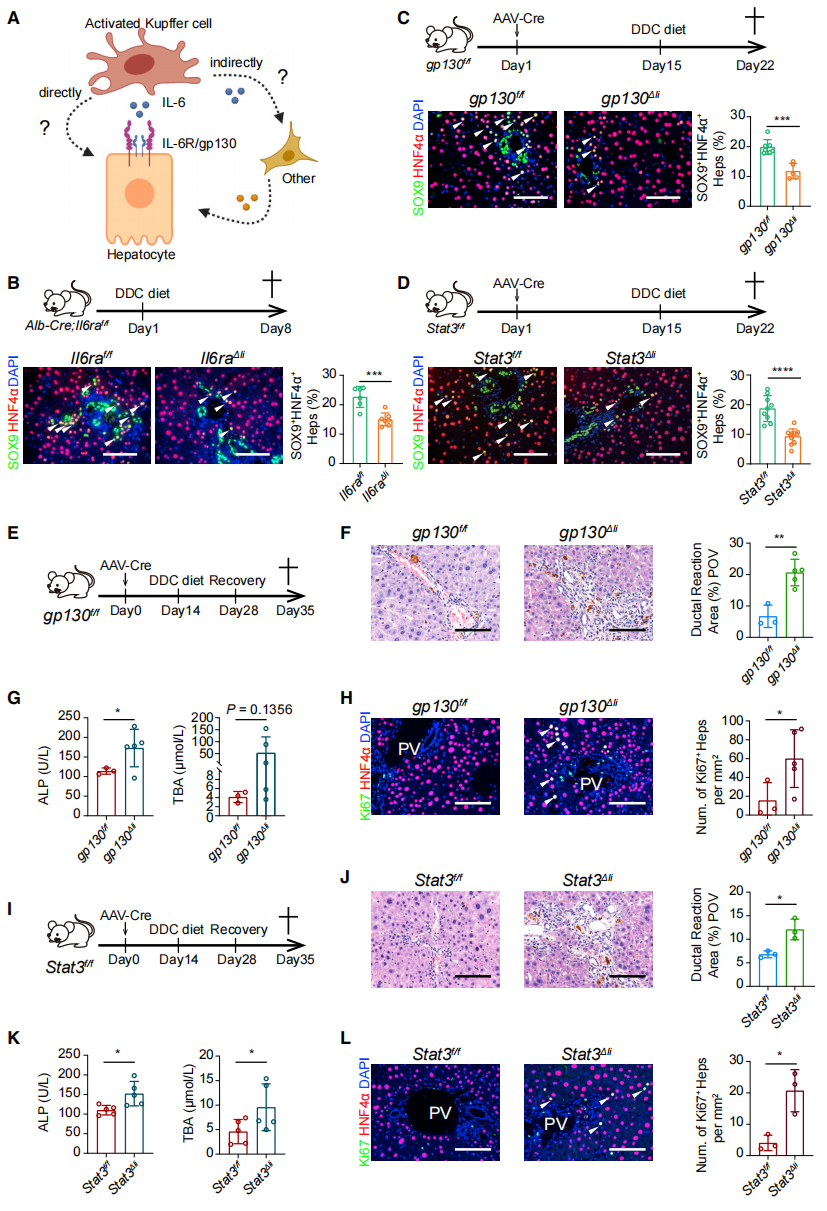
图五 IL-6/STAT3信号通路调控肝细胞重编程和肝脏修复[3]
最后,为了明确转录因子STAT3在重编程中的作用,研究者重点研究了STAT3对RRG的表达调控。在质粒尾静脉高压注射的IL-6过表达小鼠模型中,分离LPLC进行pSTAT3的ChIP-seq分析。结果显示,在232个RRG中共测定出186个基因有STAT3结合位点(图六A),STAT3与RRG的结合具有高偏好性(图六B),并展示了STAT3在Sox9和Spp1基因组上游区域的结合(图六C)。转录因子介导的基因表达与染色质的活化相关,研究者前期研究已证明Arid1a通过预先开放成熟肝细胞中RRG的染色质,激活RRG的表达,进而促进肝细胞去分化的发生[5]。于是,将STAT3和Arid1a的数据相比较,发现二者在RRG上的结合位点高度重合(图六D和E)。此外,Arid1a的缺失也显著降低了LPLC的形成(图六F),提示这些重合位点是受Arid1a调控并预先开放的染色质区域。STAT3在Sox9和Spp1基因组上游区域的结合位点具有增强子H3K27ac修饰(图六G)。将这两个结合区域构建到报告系统并进行体内过表达检测,发现正常在IL-6的介导下,STAT3能结合到该增强子区域,驱动下游报告基因表达,但在STAT3缺失(Stat3Δli)小鼠则不行(图六H)。研究者通过比较LPLC和胚胎成肝细胞的RRG H3K27ac修饰图谱,发现STAT3与RRG的结合在重编程和发育过程中受到不同的调节(图六I)。这些H3K27ac染色质位点可分为两组,第一组为H3K27ac图谱在LPLC和成肝细胞中相似的,主要位于RRG的近端区域;第二组表现为H3K27ac在LPLC中显著增加、但在成肝细胞为低信号的,它们大多数位于RRG的远端区域(图六J和K)。以上数据表明,IL-6/STAT3信号通路是一种损伤特异性机制,而非发育相关的转录调控机制。
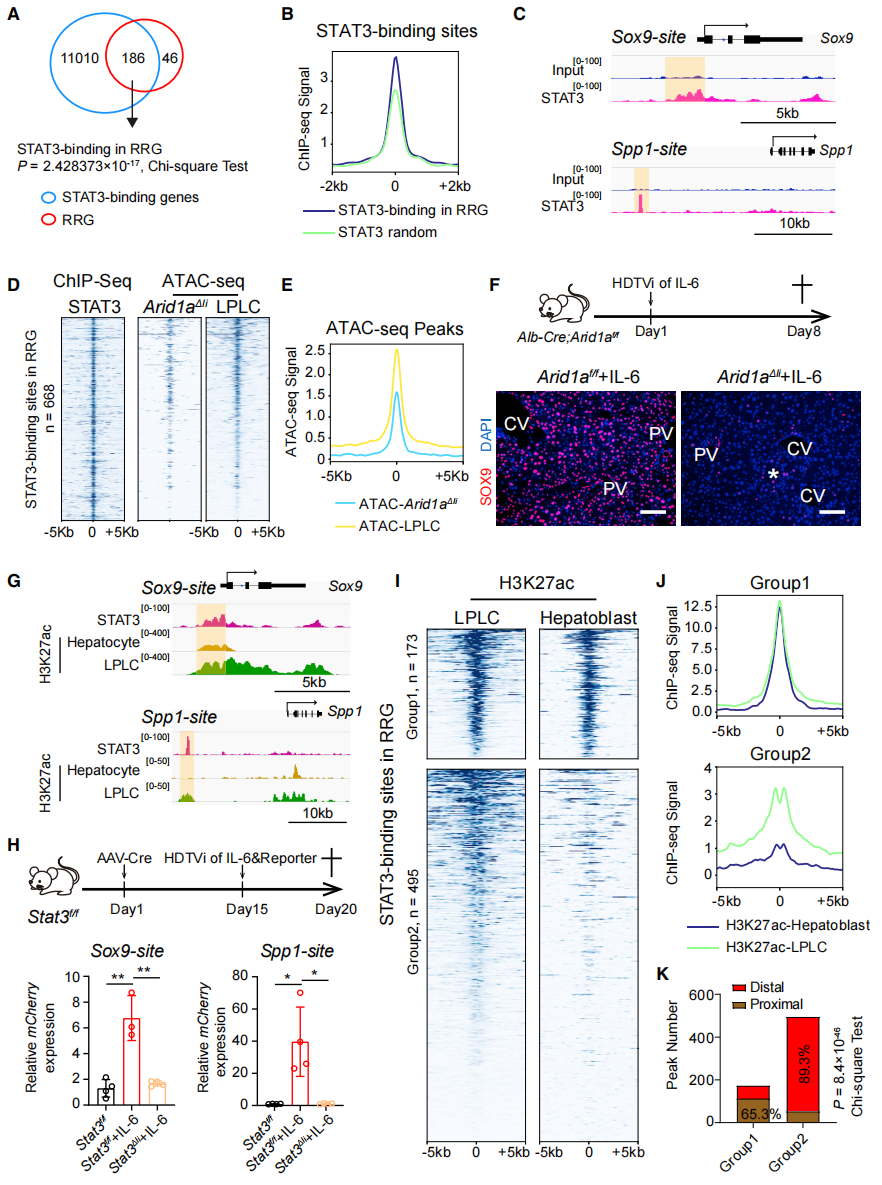
图六 STAT3在肝脏损伤时特异性重新激活RRG表达[3]
综上所述,肝脏损伤后,驻留Kupffer细胞通过分泌IL-6作为损伤特异性信号直接诱导门静脉周围LPLC的形成,揭示了免疫信号通路在成熟肝细胞响应损伤信号、发生重编程中的重要作用,为探索肝脏相关疾病治疗和药物开发,奠定了重要的理论基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Tarlow BD, Pelz C, Naugler WE, Wakefield L, Wilson EM, Finegold MJ, Grompe M: Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell stem cell 2014, 15(5):605-618.
2. Merrell AJ, Stanger BZ: Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nature reviews Molecular cell biology 2016, 17(7):413-425.
3. Li L, Cui L, Lin P, Liu Z, Bao S, Ma X, Nan H, Zhu W, Cen J, Mao Y et al: Kupffer-cell-derived IL-6 is repurposed for hepatocyte dedifferentiation via activating progenitor genes from injury-specific enhancers. Cell stem cell 2023, 30(3):283-299 e289.
4. Murakami M, Kamimura D, Hirano T: Pleiotropy and Specificity: Insights from the Interleukin 6 Family of Cytokines. Immunity 2019, 50(4):812-831.
5. Li W, Yang L, He Q, Hu C, Zhu L, Ma X, Ma X, Bao S, Li L, Chen Y et al: A Homeostatic Arid1a-Dependent Permissive Chromatin State Licenses Hepatocyte Responsiveness to Liver-Injury-Associated YAP Signaling. Cell stem cell 2019, 25(1):54-68 e55.



