技术分享:小鼠运动训练诱导的全机体细胞类型特异性分泌蛋白质图谱构建
体力活动是一种强大的生理刺激,可为许多器官系统带来益处,降低疾病风险[1]。反之,缺乏体力活动是导致心血管疾病和死亡率的主要原因之一[2]。近年来,人们对于运动诱导的可溶性血源因子的鉴定与表征产生了极大的兴趣,因为这些“运动因子”发挥着体力活动效应分子的功能[3]。已有许多代谢物、脂质、多肽和蛋白质被认定为运动因子[4]。然而,这些研究往往集中于单一因子(如IL-6)或者单一细胞类型/组织(如肌肉),很少系统性地绘制出整个生物体的运动调节分泌蛋白质组图谱。
2022年5月,Cell Metabolism期刊报道了一个小鼠运动训练诱导的全机体、细胞类型特异性分泌蛋白质组图谱,包含有21种细胞类型、10个组织的小鼠运动训练调节分泌蛋白质组图谱[5]。共鉴定出200个以上的细胞类型-分泌蛋白质对,发现Pdgfra-cre标记的分泌蛋白质组对运动训练反应最为敏感,证明了细胞内的羧酸酯酶在运动训练刺激下被肝脏分泌到血浆中,具有抗肥胖、抗糖尿病和增强运动能力的功能[5]。
基于先前自主开发的一项高时空分辨率的分泌蛋白质组标记及分析技术[6],研究者将其拓展应用到描绘小鼠运动训练诱导的全机体、细胞类型特异性的分泌蛋白质组图谱。首先,研究者构建了一个条件性内质网表达TurboID的AAV9(AAV9-FLEx-ER-TurboID),可在细胞特异性Cre的介导下,激活ER-TurboID的表达(图一A)。其次,从Jackson Laboratories购买了21个品系的组织特异性Cre工具鼠,将AAV9-FLEx-ER-TurboID静脉注射到21个品系的Cre雄鼠进行造模(图一A)。然后,造模成功后,分成不运动对照组和跑步运动组(每天跑步机运动1小时,速度20 米/分钟,为期1周,每组3只小鼠),并在最后3天喂食小鼠生物素(图一A)。最后,在运动组第7轮跑步后2小时,收集小鼠血浆,使用链霉亲和素磁珠分离纯化生物素化的分泌蛋白质,并进行LC-MS/MS分析(图一A)。结果显示,在所有21种不同细胞类型的样品中,共检测到1272个细胞类型-分泌蛋白质对,其中运动后显著变化1.5倍以上的有256个,共包含181个分泌蛋白质 (图一B)。研究者验证了其中的几对,例如两种羧酸酯酶CES2A和CES2C,确实在运动组的Albumin-cre标记的分泌蛋白质组中增加了约3倍(图一C和D);还有已知的脂肪细胞类型-分泌蛋白质对Adipoq-ADIPOQ(图一E);以及运动后显著变化的Pdgfra-TIMP3(图一F)。以上数据表明,一周的跑步训练会导致小鼠机体分泌蛋白质组的细胞类型-分泌蛋白质对发生变化。
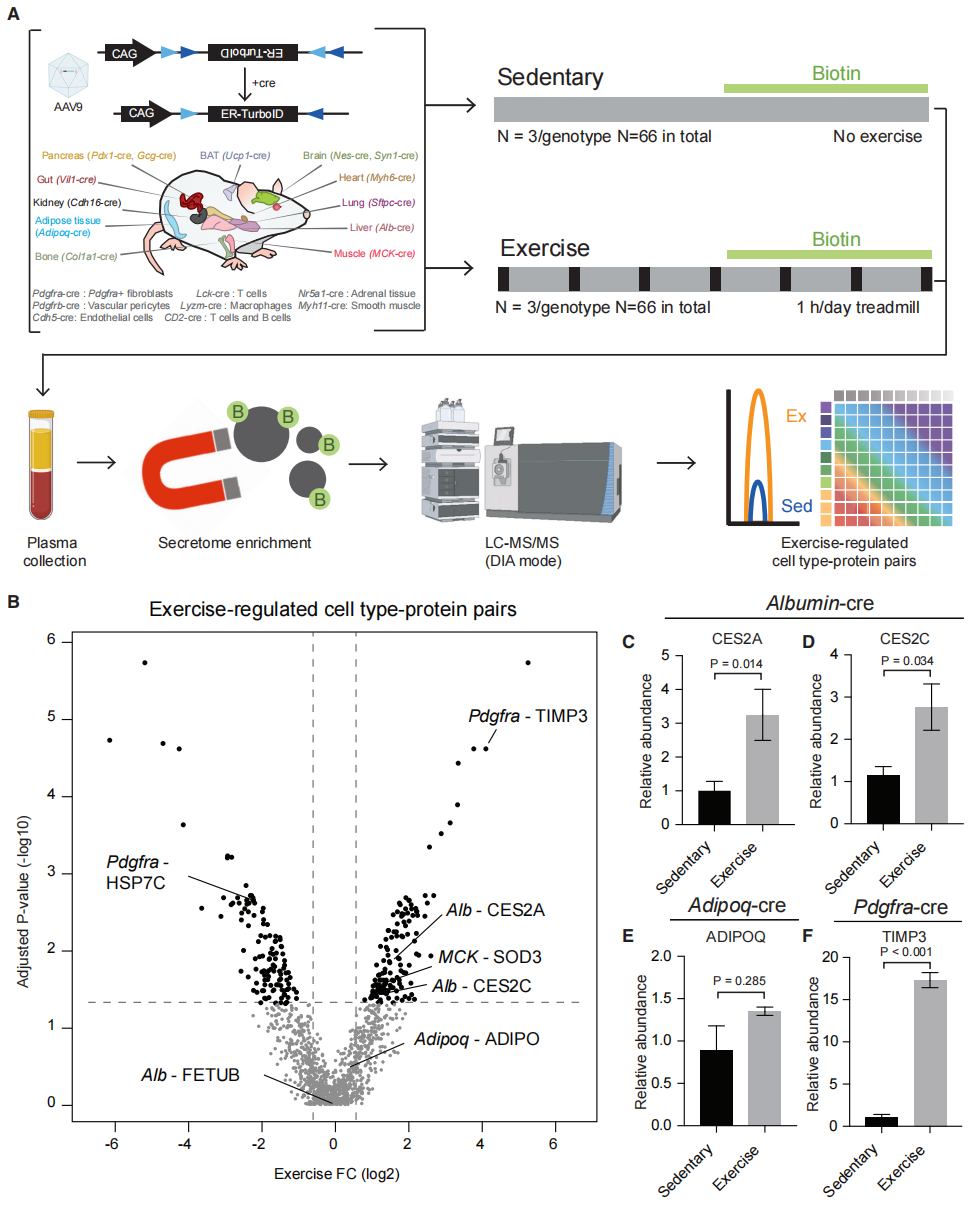
图一 小鼠运动调节的21种细胞类型特异性分泌蛋白质组图谱概述[5]
接着,研究者系统性分析这些运动调节的细胞类型-分泌蛋白质对。气泡图展示了运动后大于1种细胞类型显著性变化的分泌蛋白质,提供了大于200个新的运动调节的细胞类型-分泌蛋白质对(图二A)。例如已知的运动因子SOD3在运动后的肌肉细胞(MCK-cre)和Pdgfra+成纤维细胞中分泌上调,却在胰腺细胞(Pdx1-cre)中分泌下调(图二A),其中仅有肌肉的表达变化已被报道[7]。研究者进一步分析细胞类型,发现Pdgfra-cre分泌组对运动训练的调节变化最为敏感(图二B)。其中,TIMP3、SOD3、S10AB、VIGLN和TCO2分泌上调最为显著,而ER驻留蛋白PDIA4、AT2A3、PEDF和PAFA分泌下调(图二C)。GO分析这些显著性变化的分泌蛋白质主要富集在刺激响应、应激响应等生物功能(图二D)。用特异性抗体进行验证实验,并将小鼠分为四组:不运动组以及1、3、7天运动组(图二E)。结果显示,F13A、C4BPA和ITIH2三种运动调节分泌蛋白确实在7天运动组都显著升高(图二F)。其中C4BPA在1天和3天运动组中分泌下调,在7天运动组分泌上调(图二F),表明它在急性运动后被抑制,但在长期训练后增加。以上数据表明,Pdgfra-cre分泌组中的运动训练调节蛋白质数据在多个队列均是稳健的,且依赖于运动训练的频率。
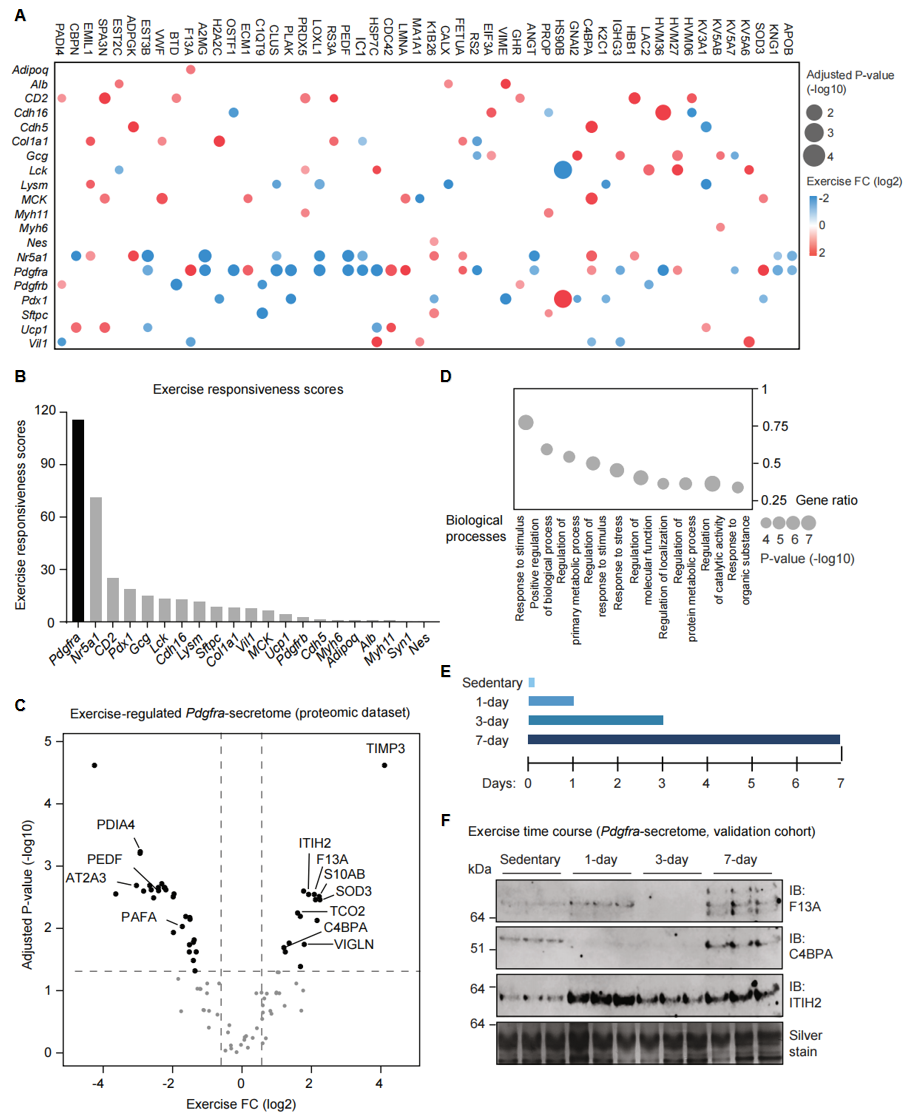
图二 Pdgfra-cre标记细胞的运动训练分泌组特征[5]
鉴于肝在机体代谢中的重要作用,研究者发现Albumin-cre分泌组中两个显著性上调的分泌蛋白CES2A和CES2C属于同一个羧酸酯酶家族(图三A)。使用CES2抗体检测小鼠血浆进行验证,发现运动训练后,Albumin-cre分泌组的CES2水平确实增加(图三B)。猜测乳酸可能作为运动训练诱导的细胞外信号,刺激肝细胞分泌CES2。于是,研究者分离雄性C57BL/6J小鼠的原代肝细胞,体外培养添加运动调节代谢物,发现乳酸处理后可显著提高细胞外CES2水平,丙酮酸也有增加效果(图三C)。当乳酸浓度大于1mM时,CES2的分泌增加达到平台期(图三D)。用囊泡运输抑制剂brefeldin A(BFA)和乳酸一起处理肝细胞时,CES2的分泌减少(图三E)。采用单羧酸转运体MCT1/2抑制剂AR-C155585来抑制细胞的乳酸吸收,也能剂量依赖性抑制乳酸诱导的CES2分泌(图三F)。以上数据表明,运动训练后细胞外的乳酸升高,进而诱导肝细胞分泌CES2(图三G)。
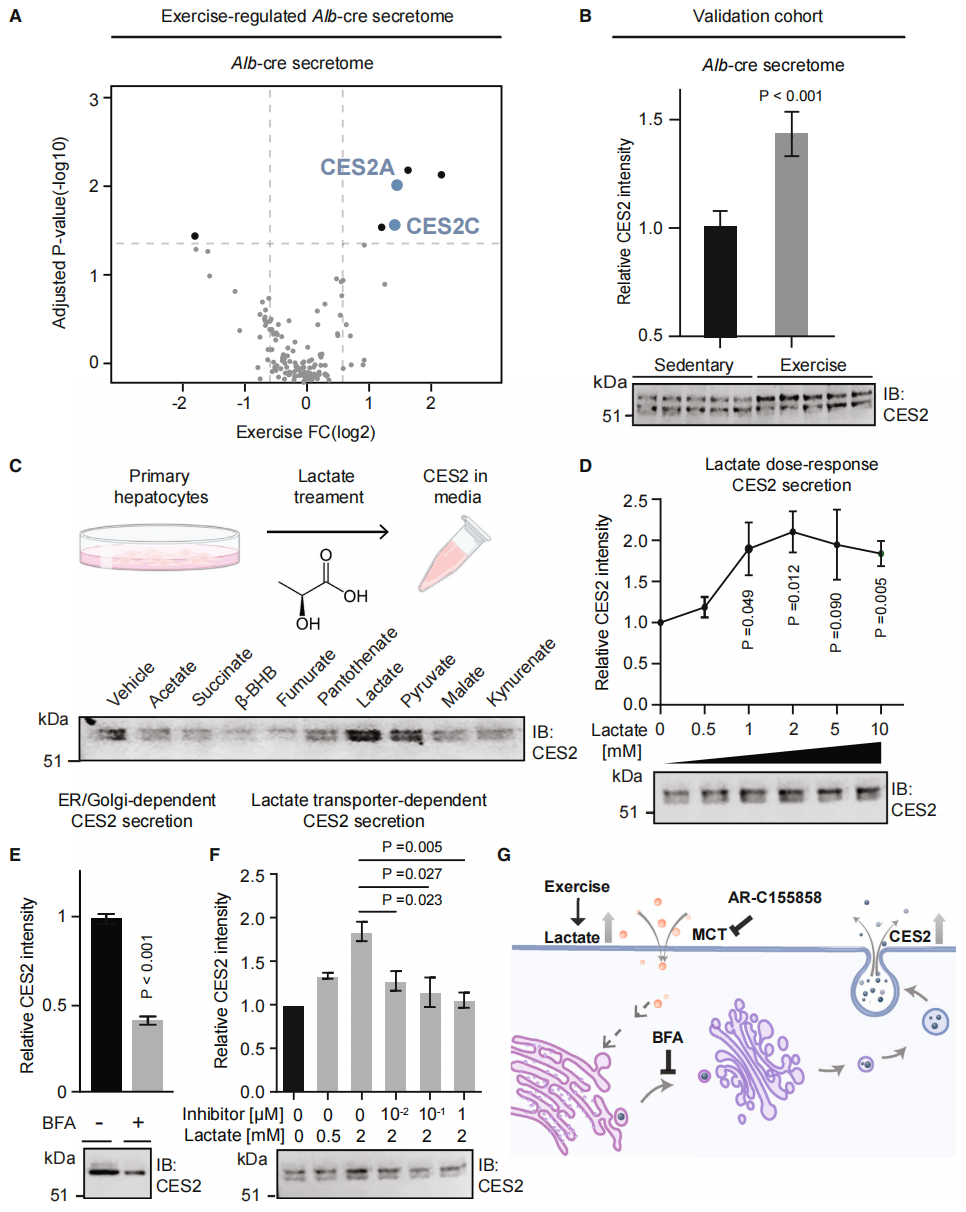
图三 乳酸诱导小鼠原代肝细胞分泌CES2[5]
最后,研究者探究了CES2A和CES2C分泌到血浆中的功能。据报道,小鼠CES2A和CES2C蛋白C末端的HXEL基序对于其内质网腔的定位必不可少,去除后可使其分泌到细胞外[8]。于是,研究者构建了C末端去除HXEL的CES2A/C(CES2-ΔC),并在N端信号肽序列后插入FLAG标签 (图四A)。利用AAV8递送两个肝脏特异性过表达分泌型CES2A-ΔC和CES2C-ΔC,通过静脉注射AAV转导入小鼠(图四B),发现血浆中循环的CES2A-ΔC和CES2C-ΔC水平升高(图四C)。AAV注射1周后,小鼠喂养7周高脂饮食(HFD)。结果发现,在食物摄入量不变的情况下,过表达分泌型CES2A-ΔC和CES2C-ΔC的小鼠体重均显著低于对照组小鼠(图四D和E);葡萄糖清除率和胰岛素敏感性也有所改善(图四F和G);腹股沟白色脂肪组织(iWAT)和附睾白色脂肪组织(eWAT)的重量显著减少(图四H和I);过表达分泌型CES2A-ΔC的小鼠跑步速度、时间和总距离也有所增加(图四J-L)。以上数据表明,分泌型CES2蛋白在小鼠中具有抗肥胖、抗糖尿病和增强耐力的作用。
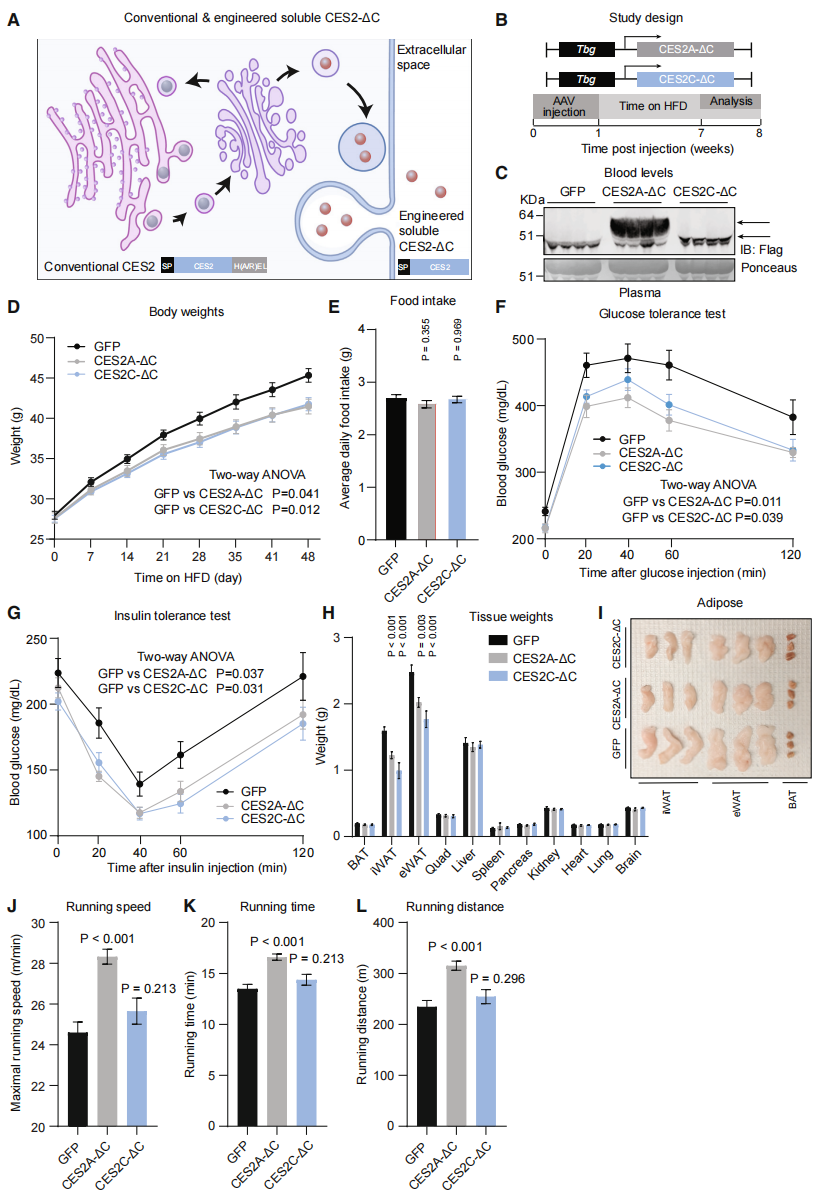
图四 分泌型CES2蛋白在小鼠中具有抗肥胖、抗糖尿病和增强耐力的作用[5]
综上所述,本研究利用蛋白质组学来描绘全机体范围内运动训练诱导的细胞分泌组变化,获得的细胞类型-分泌蛋白质对数据表现出复杂的、双向的、以及运动训练介导的细胞类型特异性调节特征,为探究分泌蛋白质在不同器官及其细胞的分子效应器功能提供了一个系统性基础。此外,在肝脏组织中鉴定出两种运动诱导的分泌蛋白质CES2A和CES2C,可提高小鼠跑步性能和改善代谢健康,为治疗肥胖和糖尿病提供了新的理论基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Warburton DER, Bredin SSD: Health benefits of physical activity: a systematic review of current systematic reviews. Curr Opin Cardiol 2017, 32(5):541-556.
2. Booth FW, Roberts CK, Thyfault JP, Ruegsegger GN, Toedebusch RG: Role of Inactivity in Chronic Diseases: Evolutionary Insight and Pathophysiological Mechanisms. Physiol Rev 2017, 97(4):1351-1402.
3. Safdar A, Saleem A, Tarnopolsky MA: The potential of endurance exercise-derived exosomes to treat metabolic diseases. Nat Rev Endocrinol 2016, 12(9):504-517.
4. Steensberg A, van Hall G, Osada T, Sacchetti M, Saltin B, Klarlund Pedersen B: Production of interleukin-6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma interleukin-6. J Physiol 2000, 529 Pt 1(Pt 1):237-242.
5. Wei W, Riley NM, Lyu X, Shen X, Guo J, Raun SH, Zhao M, Moya-Garzon MD, Basu H, Sheng-Hwa Tung A et al: Organism-wide, cell-type-specific secretome mapping of exercise training in mice. Cell Metab 2023.
6. Wei W, Riley NM, Yang AC, Kim JT, Terrell SM, Li VL, Garcia-Contreras M, Bertozzi CR, Long JZ: Cell type-selective secretome profiling in vivo. Nature chemical biology 2021, 17(3):326-334.
7. Hitomi Y, Watanabe S, Kizaki T, Sakurai T, Takemasa T, Haga S, Ookawara T, Suzuki K, Ohno H: Acute exercise increases expression of extracellular superoxide dismutase in skeletal muscle and the aorta. Redox report : communications in free radical research 2008, 13(5):213-216.
8. Hsieh YT, Lin HP, Chen BM, Huang PT, Roffler SR: Effect of Cellular Location of Human Carboxylesterase 2 on CPT-11 Hydrolysis and Anticancer Activity. PLoS One 2015, 10(10):e0141088.



