技术分享:简便高效低毒的原代细胞基因编辑系统PAGE
CRISPR-Cas基因组编辑工具促使生物学和医学领域发展了许多新的研究应用方向,包括疾病的遗传基础研究,基因治疗的精准基因改变,以及细胞疗法的工程化改造[1]。其中,基因治疗和细胞治疗的核心问题是将CRISPR-Cas编辑器递送至特定的原代细胞内,目前将其高效递送至原代细胞的策略主要依赖于病毒感染和电穿孔[2]。病毒感染存在着将病毒基因整合到宿主基因组的风险,且生产繁琐、成本较高和周期较长。而电穿孔对细胞损伤较大,会扰动细胞正常转录水平和信号转导。因此,建立针对原代细胞的简便、高效和耐受性良好的CRISPR-Cas基因编辑递送系统仍是一个较大的挑战。
2023年4月,Nature Biotechnology期刊上报道了一种多肽辅助的基因组编辑(Peptide-Assisted Genome Editing,PAGE)系统,它由携带细胞穿透肽(cell-penetrating peptide,CPP)序列的Cas蛋白(Cas9或Cas12a)以及额外添加的辅助肽(assist peptide,AP)组成。只需将它们与细胞共同孵育30分钟,即可实现原代细胞简便、高效的基因组编辑,仅有极低的细胞毒性以及基因转录组扰动[3]。
首先,研究者尝试携带不同细胞穿透肽(CPP)来递送CRISPR-Cas系统。将不同CPP、核定位序列(NLS)与Cas9蛋白相融合,构建纯化出一系列Cas9-CPP蛋白(图一a),与过表达靶向mcherry sgRNA的小鼠淋巴瘤EL4报告细胞孵育30分钟,第4天检测mcherry阴性表达的EL4报告细胞比例(图一b)。发现仅有Cas9-T6N 蛋白(TAT-4xNLS-Cas9-2xNLS-GFP)在5 μM的溶度下,可实现细胞穿透率(EGFP阳性细胞)约20%(图一c),以及基因编辑效率(mcherry阴性细胞)约13%(图一d)。此时,携带CPP的递送效率仍然不高。
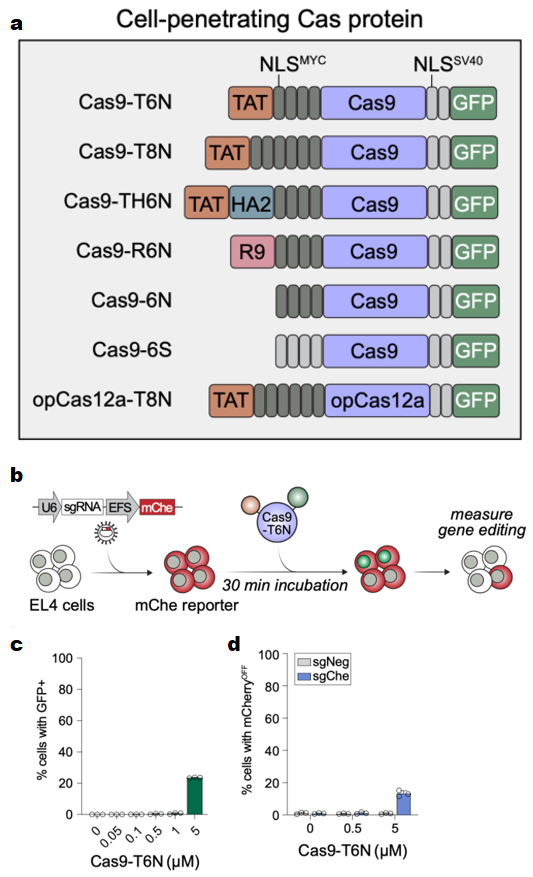
图一 Cas9-CPP系列蛋白的基因编辑效率测试
于是,研究者在Cas9-T6N的基础上(图二a),进一步筛选可提高效率的小分子化合物或辅助肽(AP)(图二b)。发现AP TAT-HA2可显著增强0.5 μM Cas9-T6N的编辑效率,从无法检测到的水平最高提高到约85%(图二c和d),并且其细胞毒性也较小(图二e)。分离细胞组分发现,AP TAT-HA2添加后提高Cas9-T6N的细胞穿透效率约5倍,核定位提高了约62倍(图二f)。研究者将Cas9-CPP和AP TAT-HA2的组合命名为Cas-PAGE,并测试其他原代细胞(图二g),发现在人骨髓细胞、NK细胞和原代T细胞中均显示出80-90%的基因编辑效率(图二h)。以上数据表明,Cas-PAGE系统开发成功,可适用于不同细胞类型的Cas递送及基因编辑。
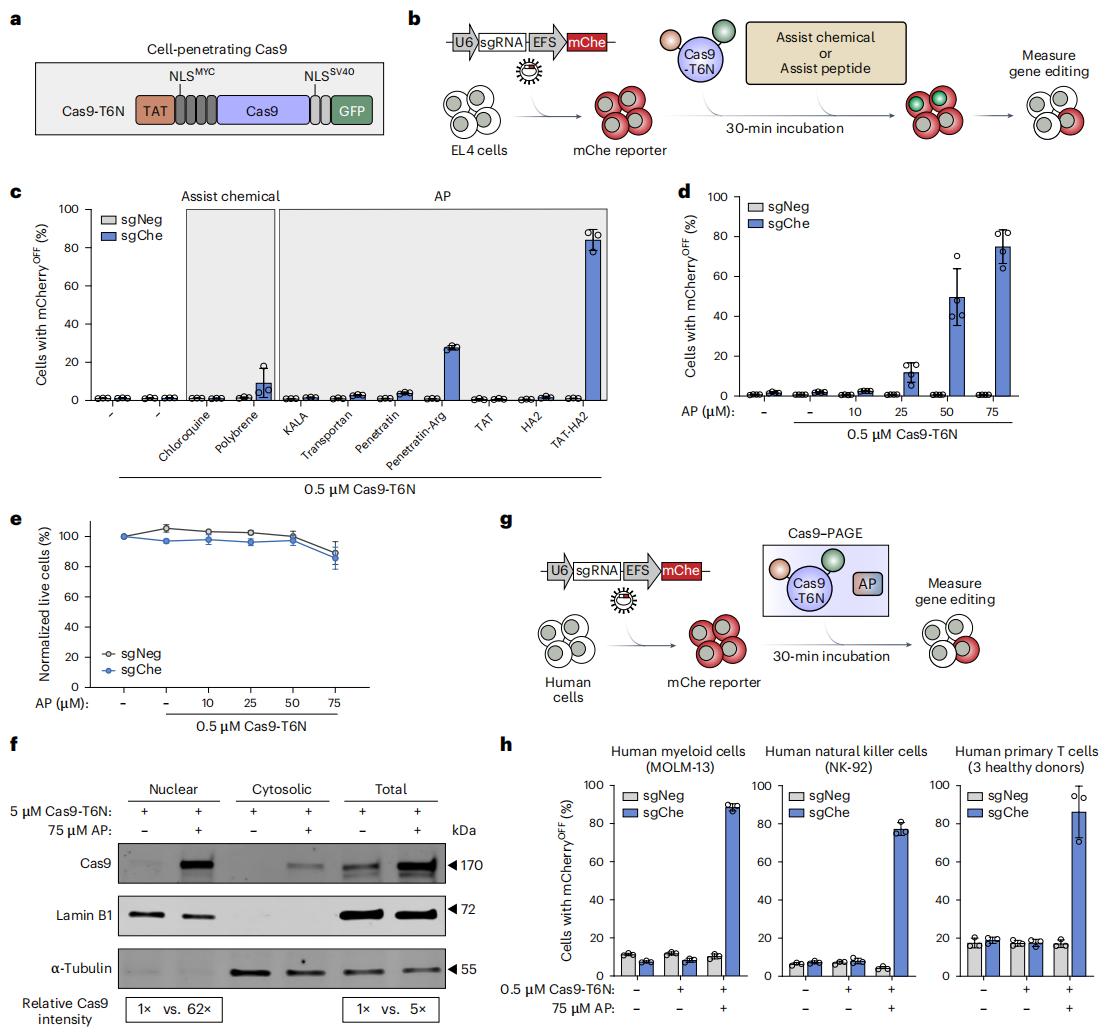
图二Cas-PAGE系统的开发[3]
接下来,研究者进一步测试优化Cas-PAGE系统在小鼠原代CD8+ T细胞中的基因组编辑能力。首先,将sgRNA通过逆转录病毒导入小鼠原代CD8+ T细胞,再与Cas-PAGE系统孵育30分钟(图三a),3天后检测发现携带靶向Thy1 sgRNA的T细胞表面CD90的表达降低了约90%(图三b和c)。其次,测试Cas9-RNP-PAGE的编辑能力,将Cas9-T6N与sgRNA混合成RNP,再与AP一起短暂孵育细胞(图三d),此时编辑效率仅<10%(图三e),表明RNP形式的递送效率不高。推测是由于与100 nt负电荷的sgRNA孵育后,影响了PAGE的递送效果。然后,将Cas9-T6N替换为增加了正电荷的Cas9-T8N(图一a),可惜没能改进Cas9-RNP-PAGE的编辑能力(图三e)。最后,研究者采用优化的Cas12a(opCas12a)替代Cas9蛋白(图一a),因其搭配的是40 nt crRNA,且编辑效率与Cas9相当[4]。与Cas9-RNP-PAGE相比,靶向Thy1的opCas12a-RNP-PAGE基因编辑效率提高了约8倍,达到70%以上(图三e和f)。在opCas12a-RNP-PAGE孵育后分选出GFP阳性细胞,还能进一步将编辑效率提高到约98%(图三g)。以上数据表明,opCas12a-RNP-PAGE系统开发成功。
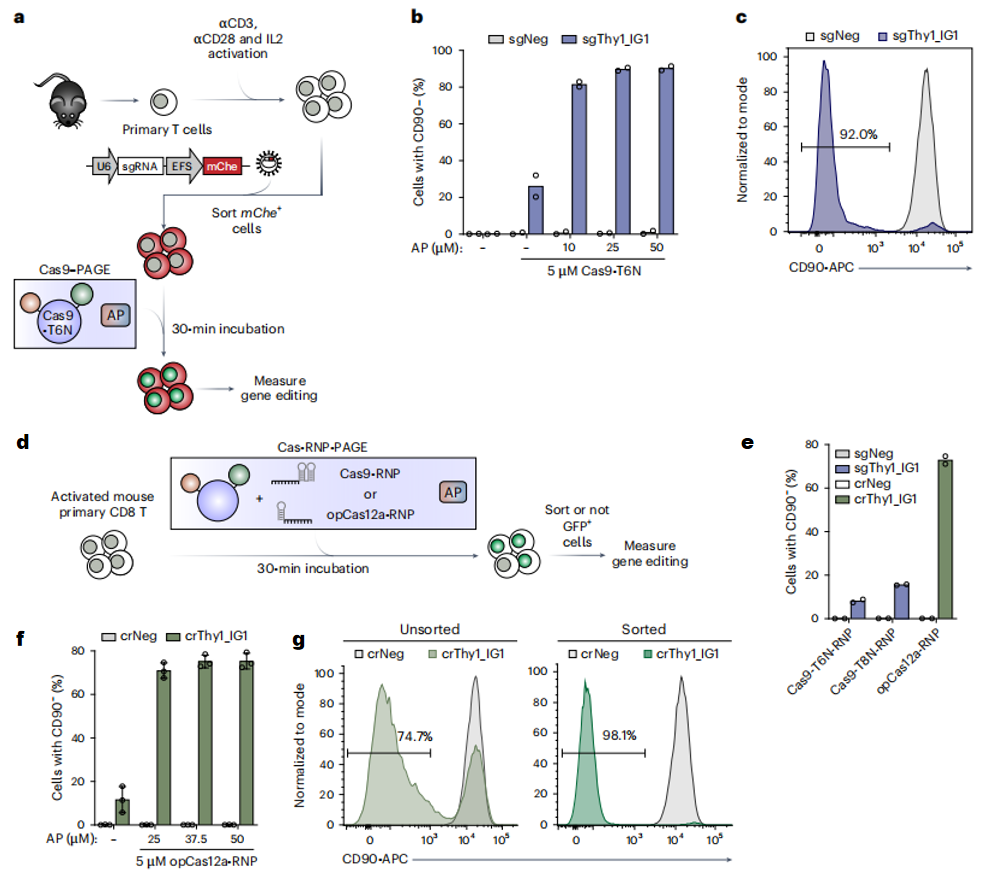
图三 Cas-RNP-PAGE系统的开发[3]
鉴于opCas12a-RNP-PAGE系统优异的基因编辑性能,研究者将其与电穿孔系统进行比较。选用感染CAR19慢病毒4天后分选获得的原代CAR19+ T细胞,分别进行opCas12a -RNP-PAGE孵育或者电转,实现非靶向性的基因编辑(图四a)。结果显示,opCas12a-RNP-PAGE系统具有极低的细胞毒性,被编辑后的CAR19+ T细胞的活细胞率高达98%,而电穿孔方法仅有68%(图四b);且被编辑后的CAR19+ T细胞体外培养10 天也表现出优于电穿孔方法的高效扩增速率(图四c)。RNA-seq主成份分析显示opCas12a-RNP-PAGE编辑后的细胞和对照组CAR19细胞之间具有高度相似性,而电穿孔实验组的差异性大(图四d)。PAGE实验组与对照组细胞无显著性差异表达基因,而电穿孔实验组在处理后6小时和3天分别有1986和421个差异基因(图四e)。以上结果表明,Cas-RNP-PAGE系统相比电穿孔系统更为温和,对细胞转录组的扰动更小。
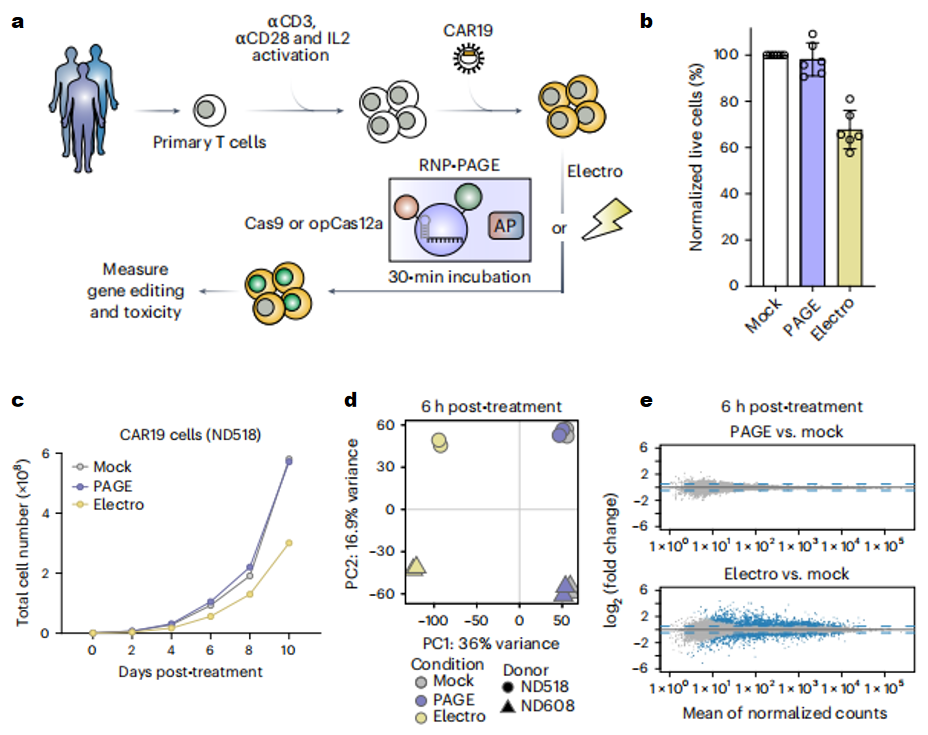
图四 Cas-RNP-PAGE系统与电穿孔系统的比较[3]
最后,研究者进行Cas-RNP-PAGE系统在人CAR T细胞和造血干/祖细胞(HSPC)中的应用评价。采取了连续性敲除和同时三敲的两种策略,利用Cas-RNP-PAGE系统在CAR T细胞上进行多基因敲除(图五a)。先用opCas12a-RNP-PAGE系统靶向CAR19细胞的B2M,2天后再靶向PTPRC(图五a),连续性双敲也表现出极低的细胞毒性(图五b)和50.9%的双敲效率(图五c)。另外,同时对B2M、TRAC和PTPRC进行三敲(图五a),opCas12a-RNP-PAGE系统同样表现出极低细胞毒性和高达88.0%的三敲效率(图五d和e)。另外,研究者还选择人类CD34+ HSPC靶向编辑BCL11A,并体外分化成红细胞进行评价(图五f)。BCL11A是个转录因子,会抑制红细胞中胎儿型血红蛋白(HbF)的表达,通过靶向其红细胞特异性增强子(+58 kb)可用于治疗镰刀型贫血和β型地中海贫血[5]。结果显示,opCas12a-RNP-PAGE系统和电穿孔方法均能实现约100%的靶向性基因编辑(图五g),第6天时PAGE编辑的HSPC产生的红细胞大约是电穿孔实验组的3倍(图五h),表明PAGE系统对细胞活力的损害少于电穿孔方法。qRT-PCR分析证实编辑后细胞的胎儿型血红蛋白转录本表达增加(图五i)以及流式检测HbF+细胞比例增加(图五j和k),并且PAGE系统的阳性产物高于电穿孔方法。以上数据表明,opCas12a-RNP-PAGE系统可用于临床应用型原代细胞基因编辑,相比电穿孔方法,该系统操作简便、效率更高、细胞毒性更小。
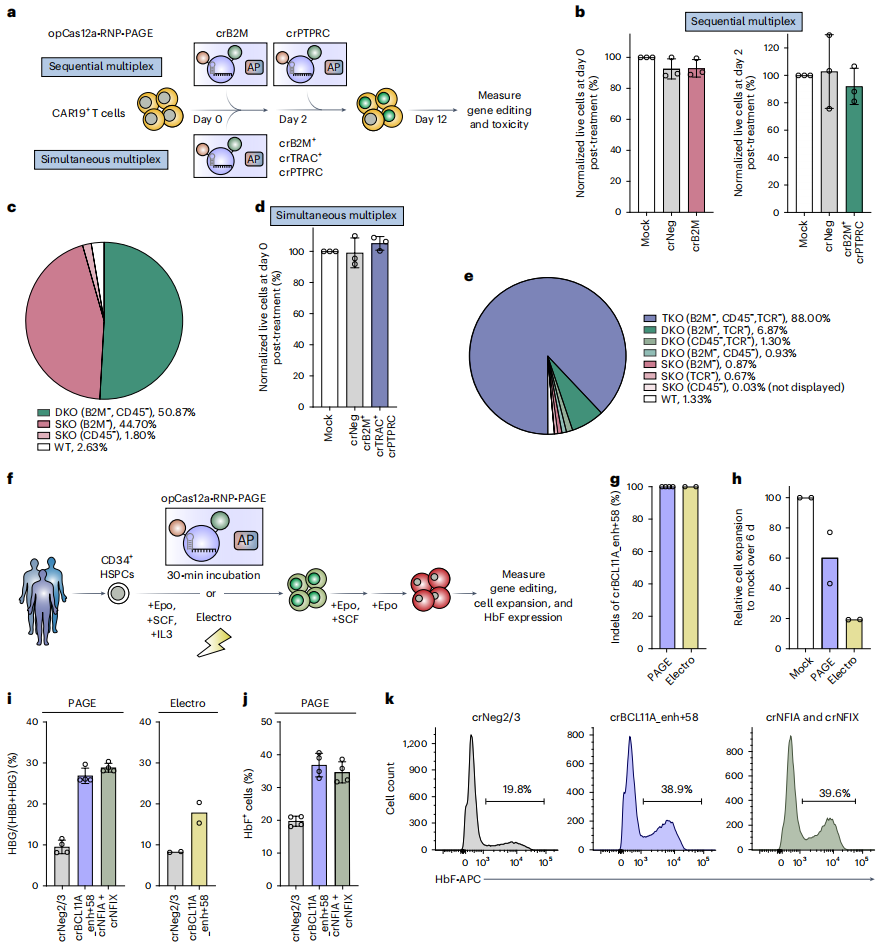
图五 Cas-RNP-PAGE系统在人CAR T细胞和HSPC中的应用评价[3]
综上所述,PAGE 系统提供了一个简便、快速、高效的基因组编辑系统,特别适用于递送困难的原代细胞。通过30分钟短时程的蛋白质孵育,Cas-PAGE和Cas-RNP-PAGE系统在小鼠和人类原代T细胞中的编辑效率可高达98%,在HSPC中的编辑效率接近100%。PAGE系统的生产工艺简便,使用门槛低,相比于电穿孔系统细胞毒性更小。因此,本研究提供了一种可广泛推广的新平台,其在原代细胞展现出简便、高效和耐受性良好的CRISPR-Cas基因编辑能力,将助力于基础研究、细胞治疗等临床应用的快速发展。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Doudna JA: The promise and challenge of therapeutic genome editing. Nature 2020, 578(7794):229-236.
2. Atsavapranee ES, Billingsley MM, Mitchell MJ: Delivery technologies for T cell gene editing: Applications in cancer immunotherapy. EBioMedicine 2021, 67:103354.
3. Zhang Z, Baxter AE, Ren D, Qin K, Chen Z, Collins SM, Huang H, Komar CA, Bailer PF, Parker JB et al: Efficient engineering of human and mouse primary cells using peptide-assisted genome editing. Nature biotechnology 2023.
4. DeWeirdt PC, Sanson KR, Sangree AK, Hegde M, Hanna RE, Feeley MN, Griffith AL, Teng T, Borys SM, Strand C et al: Optimization of AsCas12a for combinatorial genetic screens in human cells. Nature biotechnology 2021, 39(1):94-104.
5. Frangoul H, Altshuler D, Cappellini MD, Chen YS, Domm J, Eustace BK, Foell J, de la Fuente J, Grupp S, Handgretinger R et al: CRISPR-Cas9 Gene Editing for Sickle Cell Disease and beta-Thalassemia. The New England journal of medicine 2021, 384(3):252-260.



