技术分享:克隆性造血增加慢性肝病的患病风险
慢性肝病是全球主要公共卫生负担,以年龄依赖的方式影响着超过30%的美国人[1]。其特征是对初始损伤的炎症和纤维化反应,其中最常见的初始损伤是由过量饮酒、肥胖或病毒性肝炎引起的脂肪变性[2]。然而,对于从脂肪变性进展为炎症和纤维化的影响因素知之甚少。肝脏炎症和纤维化部分是由肝脏的非实质细胞介导的,包括肝窦内皮细胞、淋巴细胞和巨噬细胞等。据报道,肝脏定居型巨噬细胞(Kupffer细胞)和骨髓来源的单核细胞以及巨噬细胞都与肝损伤反应有关[3, 4]。巨噬细胞募集是进展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)所必需的,而抑制单核细胞募集可在小鼠模型中阻止疾病进展[5]。不确定潜能的克隆性造血(clonal haematopoiesis of indeterminate potential,CHIP)是一类来源于血液或骨髓中存在基因突变的多能干细胞。CHIP是一种常见的衰老相关生物学状态,其特征是造血细胞扩增,最常携带DNMT3A、TET2和ASXL1基因的致癌体细胞突变,并引起巨噬细胞和其他炎症细胞的炎症反应失调[6]。鉴于循环免疫细胞的普遍性,CHIP与脂肪性肝炎和肝硬化之间的关系还有待阐明。
2023年4月,Nature上报道了一项CHIP与慢性肝病之间的相关性研究,通过分析比对4个不同数据库(FHS、ARIC、UK Biobank和MGB Biobank)的信息,发现CHIP与慢性肝病的风险增加具有相关性。进而在饮食诱导的NASH小鼠模型中,证明了移植Tet2缺失造血细胞的小鼠表现出更严重的肝脏炎症和纤维化,该过程是由NLRP3炎症小体介导的[7]。
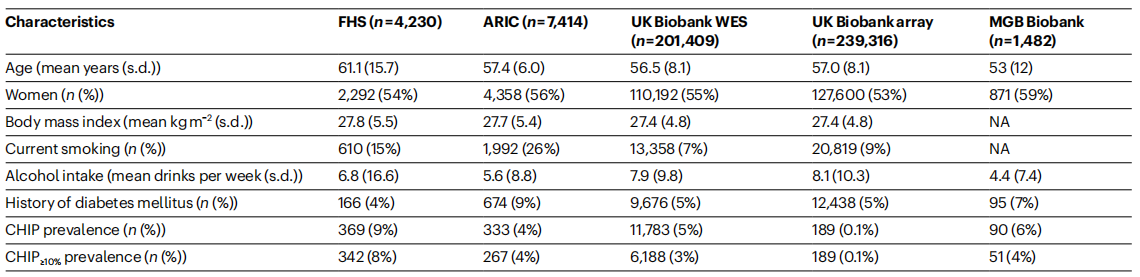
首先,研究者用FHS(Framingham Heart Study,n=4,230)和ARIC(Atherosclerosis Risk in Communities,n=7,414)数据库分析CHIP与流行性慢性肝病的相关性,用UK Biobank数据分析CHIP与偶发性慢性肝病的相关性。结果显示,CHIP患病率在4%-9%区间变化,其中年龄、性别、2型糖尿病、吸烟等均会影响CHIP患病率(表一)。
表一 样本分析的参与者基线特征[7]
单独分析ARIC和UK Biobank样本库,CHIP与慢性肝病之间的相关性没有统计学显著差异,但结合FHS和ARIC数据,具有变异等位基因分数≥10%(CHIP≥10%)的CHIP患者发生流行或慢性肝病的风险增加2倍(图一a)。JAK2 突变型CHIP与慢性肝病的高风险相关,风险增加16倍,这可能是因其建立的血栓前效应,而TET2突变风险增加了5倍。当区分肝脏疾病的亚型时,CHIP患者发生NASH的风险显著升高,但与酒精性肝病(ALD)没有显著相关性(图一b)。研究者进一步在MGB Biobank数据库中,比对分析经活检证实患有NASH的114名患者和1368名匹配对照者,发现NASH患者发生CHIP的风险是对照组的4倍(图一c)。
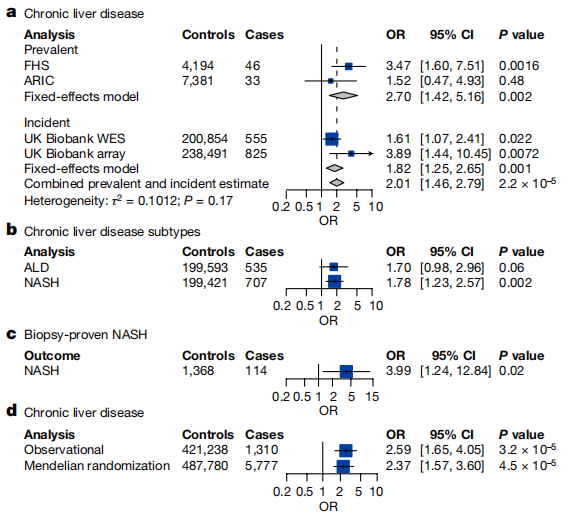
图一 CHIP与慢性肝病具有相关性[7]
为了评估CHIP状态与慢性肝病之间的因果关系,研究者使用孟德尔随机化的稳健调整曲线评分(MR-RAPS)方法,对184个具有CHIP显著性的独立遗传变异进行分析,发现CHIP确实与慢性肝病风险增加2倍有关(图一d)。研究者还对22种疾病表型进行了广泛的孟德尔随机化分析,包括有心脏病、自身免疫性疾病和实体恶性肿瘤等,没有观察到CHIP与其他疾病的显著相关性,表明CHIP与慢性肝病之间的这种相关具有特异性。
接下来,研究者利用UK Biobank数据库中8,251名患者的核磁共振成像数据,研究CHIP与肝脏炎症和纤维化的关系。结果发现,CHIP与肝脏炎症和纤维化的患病率增加具有相关性,但与肝脏脂肪变性不相关(图二a和b)。检测了393,128个体的CHIP和血清生物标志物之间的关系,发现CHIP与丙氨酸转氨酶水平或天冬氨酸转氨酶水平之间没有统计学相关性,但与γ-谷氨酰基转移酶的适度增加显著相关,也与血小板和白细胞计数的适度升高有关。
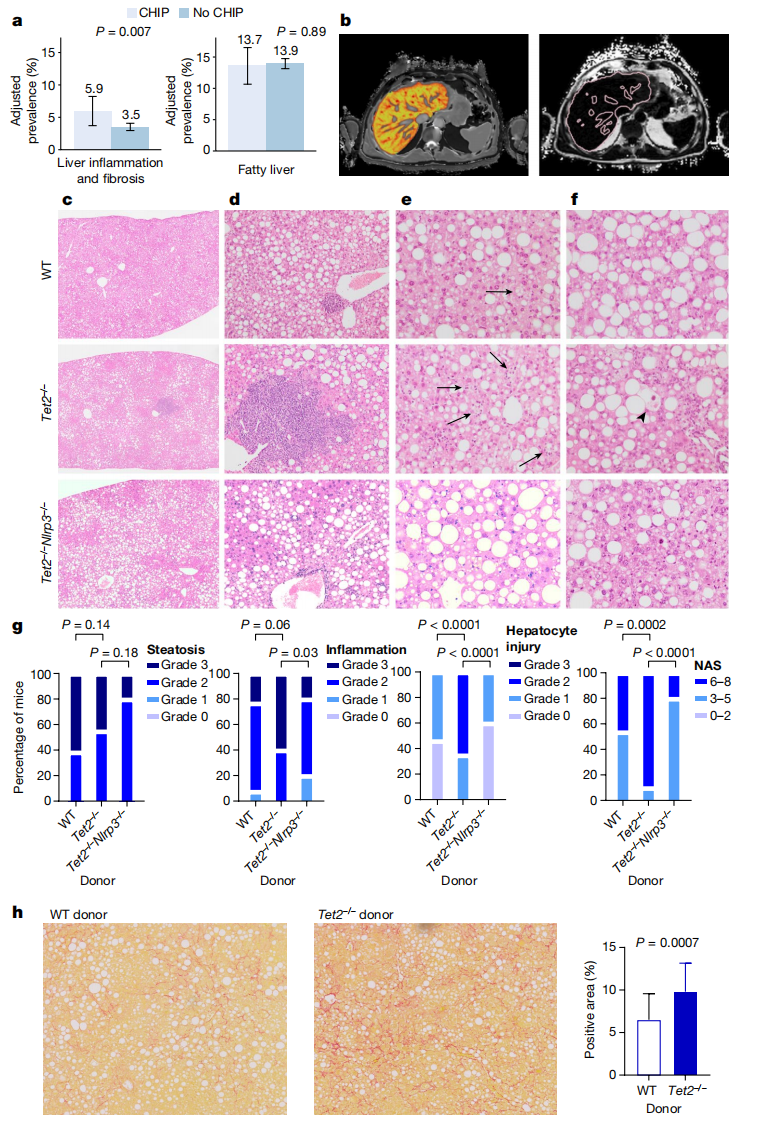
图二 CHIP与脂肪性肝炎相关[7]
为了检验Tet2缺失是否在慢性肝脏炎症中起作用,研究者在B6.SJL小鼠中移植Tet2-/-或对照组骨髓细胞,喂养11周胆碱缺失和L氨基酸限定的高脂肪饮食(CDAHFD),进行饮食诱导的NASH小鼠造模。之后通过组织学评估肝脏脂肪、炎症和肝细胞肿胀损伤,并整合到非酒精性脂肪肝活动性评分(NAS)中。结果发现,尽管Tet2-/-实验组小鼠每天消耗较少的CDAHFD,但与对照组小鼠具有相似的肝脏脂肪积累和血清代谢水平,并且表现出淋巴聚集明显的更多的肝小叶炎症和肝细胞肿胀,而肝脏的脂肪积累没有受到影响(图二c-f),表现为累积性NAS评分增加(图二g)。在移植了Tet2-/-骨髓细胞并喂养西方饮食的高胆固醇血症Ldlr-/-小鼠中,也观察到类似的肝脏炎症和肝细胞损伤增加。以上数据表明,Tet2-/-造血细胞促进了小鼠脂肪性肝炎的发展。
研究者进一步探索突变的造血环境对肝脏损伤的持续性作用,先将Tet2-/-移植小鼠CDAHFD喂食11 周,随后正常喂食10 天。饮食逆转后,尽管脂肪性肝炎的表型得到缓解,但与对照组相比,Tet2-/-实验组小鼠的肝脏炎症和肝细胞肿胀损伤仍然显著升高。此时,肝纤维化特性基因在Tet2-/-实验组小鼠中显著富集,但组织学上未见明显的肝纤维化,进而延长了正常喂养时间。到第19周时,与对照组相比,Tet2-/-实验组小鼠的肝纤维化明显增加(图二h)。以上数据表明,在CDAHFD饮食诱导的NASH模型小鼠中,Tet2缺失的造血细胞促进了脂肪性肝炎向肝纤维化的进展。
最后,为了鉴定出Tet2缺失造血细胞中发挥NASH促进作用的细胞谱系,研究者从小鼠分离出造血细胞,并与正常肝星状细胞进行体外共培养,发现分离出的肝巨噬细胞可激活肝星状细胞的纤维化相关基因转录上调,如Col4a1、Col4a2、Lox、Loxl2和Timp1。于是,从NASH造模小鼠体内分离出移植供体细胞来源的肝巨噬细胞,检测发现Tet2-/-实验组的肝巨噬细胞显示出Il6和Cxcl1的表达水平增加以及促炎基因的富集(图三a),Tet2-/-实验组小鼠血清中IL-6、CXCL1、CCL22和CCL17水平也升高(图三b)。由于CXCL1和IL-6是由NLRP3炎症小体复合物调节的促炎分子,而相关趋化因子CCL17和CCL22通过CCR4促进招募调节性T细胞[8],研究者关注到NLRP3炎症小体。进一步通过巨噬细胞激活实验发现,激活后的Tet2缺失骨髓源性巨噬细胞显示出更多的IL-6、CXCL1、CCL22和CCL17分泌,而Tet2和Nlrp3双缺失的巨噬细胞下降回基线表达水平(图三c),证实了NLRP3介导下游促炎细胞因子分泌的关键作用。以上数据表明,Tet2缺失的造血功能诱导肝脏定居型免疫细胞中NLRP3依赖的促炎信号,从而促进脂肪性肝炎和纤维化。
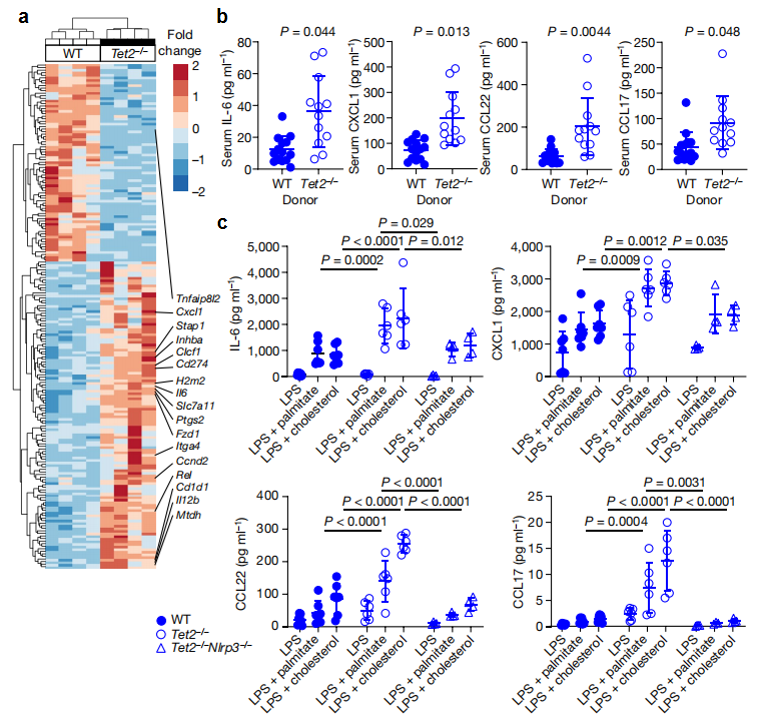
图三 CHIP的促炎信号通路[7]
综上所述,研究者通过将大规模的人类遗传学研究和小鼠模型中克隆性造血的体内模型相结合,证明了CHIP通过异常炎症反应与NASH在内的慢性肝病风险升高相关,可通过介导肝脏中的异常炎症潜在地影响脂肪性肝炎和肝硬化的发展轨迹,提示了通过靶向NLRP3炎症小体或相关下游因子,有可能阻断CHIP对慢性肝病的促进作用。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Anstee QM, Reeves HL, Kotsiliti E, Govaere O, Heikenwalder M: From NASH to HCC: current concepts and future challenges. Nat Rev Gastroenterol Hepatol 2019, 16(7):411-428.
2. Scaglione S, Kliethermes S, Cao G, Shoham D, Durazo R, Luke A, Volk ML: The Epidemiology of Cirrhosis in the United States: A Population-based Study. J Clin Gastroenterol 2015, 49(8):690-696.
3. Brempelis KJ, Crispe IN: Infiltrating monocytes in liver injury and repair. Clin Transl Immunology 2016, 5(11):e113.
4. Krenkel O, Tacke F: Liver macrophages in tissue homeostasis and disease. Nat Rev Immunol 2017, 17(5):306-321.
5. Krenkel O, Puengel T, Govaere O, Abdallah AT, Mossanen JC, Kohlhepp M, Liepelt A, Lefebvre E, Luedde T, Hellerbrand C et al: Therapeutic inhibition of inflammatory monocyte recruitment reduces steatohepatitis and liver fibrosis. Hepatology 2018, 67(4):1270-1283.
6. Steensma DP, Bejar R, Jaiswal S, Lindsley RC, Sekeres MA, Hasserjian RP, Ebert BL: Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 2015, 126(1):9-16.
7. Wong WJ, Emdin C, Bick AG, Zekavat SM, Niroula A, Pirruccello JP, Dichtel L, Griffin G, Uddin MM, Gibson CJ et al: Clonal haematopoiesis and risk of chronic liver disease. Nature 2023, 616(7958):747-754.
8. Oo YH, Weston CJ, Lalor PF, Curbishley SM, Withers DR, Reynolds GM, Shetty S, Harki J, Shaw JC, Eksteen B et al: Distinct roles for CCR4 and CXCR3 in the recruitment and positioning of regulatory T cells in the inflamed human liver. J Immunol 2010, 184(6):2886-2898.



