技术分享:线粒体cGAS通过抑制铁死亡促进肝癌进展
环GMP-AMP合成酶(cGAS)是一种双链DNA传感器,可识别并结合胞质溶胶DNA,催化合成第二信使环GMP-AMP(cGAMP),进而激活干扰素基因刺激因子(STING)免疫防御病原体[1]。近期研究发现,cGAS还可以定位到胞质溶胶以外的亚细胞区室,发挥着非经典的功能。例如,核cGAS锚定在染色质上,抑制同源重组介导的DNA修复,以应对基因毒性应激诱导的DNA损伤[2]。目前尚不清楚cGAS在不同生物学条件下的其他亚细胞定位及其功能,特别是在癌症进展中的作用。肿瘤细胞线粒体可通过提供能量、调控氧化还原稳态、致癌信号和程序性细胞死亡,来支持癌症的发生发展[3, 4]。受损线粒体释放到胞质溶胶中的线粒体DNA(mtDNA)也可以激活cGAS-STING途径。然而,cGAS与肿瘤细胞线粒体之间的相互作用,及其对肿瘤进展的影响仍不清楚。
2023年3月,Cell Research上报道了cGAS在协调线粒体功能和肿瘤进展中的新作用,发现cGAS可定位于肝细胞癌(HCC)线粒体,锚定在线粒体外膜(OMM)上,并在体内外证明线粒体cGAS与动力蛋白相关蛋白1(DRP1)相结合并促进后者的寡聚化,进而抑制线粒体ROS过量积累和铁死亡,具有促进HCC肿瘤生长的作用。敲低cGAS、破坏cGAS的线粒体定位、或者抑制DRP1寡聚化,均可抑制HCC肿瘤生长[5]。
首先,研究者通过基于LC-MS/MS的蛋白质组学分析来寻找可能对HCC有贡献的线粒体蛋白,在Hep3B细胞的线粒体组分中发现了cGAS。通过鉴定细胞核、胞质溶胶和线粒体组分,验证了cGAS在Hep3B、PLC和HepG2肝癌细胞的线粒体中都高表达(图一a)。在Mito-GFP表达的Hep3B细胞中,免疫荧光染色也显示cGAS与线粒体的共定位(图一b)。在HCC临床样品中,也得到相同结果(图一c和d)。经蛋白质序列分析推测cGAS可能携带两个线粒体靶向序列(MTS),分别位于161-200和331-354氨基酸。将推测的两个MTS分别与GFP融合,发现只有161-200的MTS可以将GFP靶向定位到线粒体。研究者分离Hep3B和PLC细胞线粒体,发现线粒体cGAS对蛋白酶K的消化敏感(图一e),表明其定位于线粒体外膜(OMM)。在Hep3B细胞中同时过表达HA-TOM70和cGAS-Flag,可以检测到cGAS与TOM70的相互作用(图一f),后者是线粒体外膜转位酶(TOM)复合物的前蛋白受体。采用shRNA抑制TOM70的表达,导致线粒体cGAS的富集减少(图一g),表明TOM70参与了cGAS的线粒体定位。以上数据表明,cGAS自身含有MTS,使其在肝癌细胞中转位到OMM上。
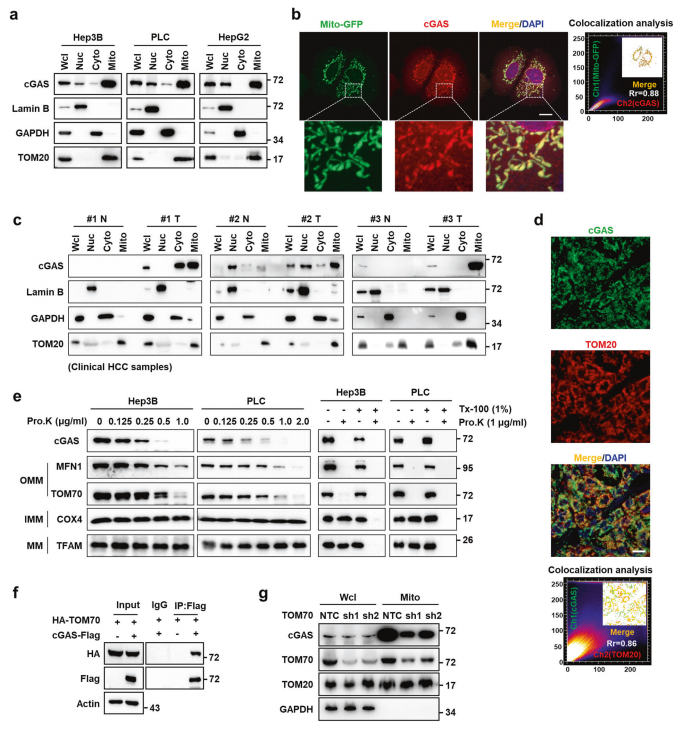
图一 cGAS定位于肝癌细胞的线粒体[5]
接下来,研究者探索了线粒体cGAS对HCC细胞存活和生长的影响。在Hep3B细胞中敲低cGAS(shcGAS),发现显著抑制了HCC细胞生长,并增加了细胞死亡(图二a和b)。于是,构建了MTS融合的cGAS(MTS-cGAS),使其特异性靶向定位于OMM。另外,构建了去除161-200 MTS序列的突变型ΔMTS-cGAS,从而破坏cGAS的线粒体定位。结果显示,过表达MTS-cGAS和野生型cGAS(WT-cGAS)均可显著恢复shcGAS细胞的生长迟缓和细胞死亡,而ΔMTS-cGAS则不行(图二a和b)。为了确定线粒体cGAS影响的细胞死亡类型,研究者在shcGAS+ΔMTS-cGAS实验组中添加不同细胞死亡途径的抑制剂,发现铁死亡抑制剂ferrostatin-1(Fer-1)和liproxstatin-1(Lip-1)很大程度地降低了细胞死亡(图二c)。且Fer-1和Lip-1的添加,与过表达MTS-cGAS显著降低shcGAS细胞死亡的程度相似(图二d)。
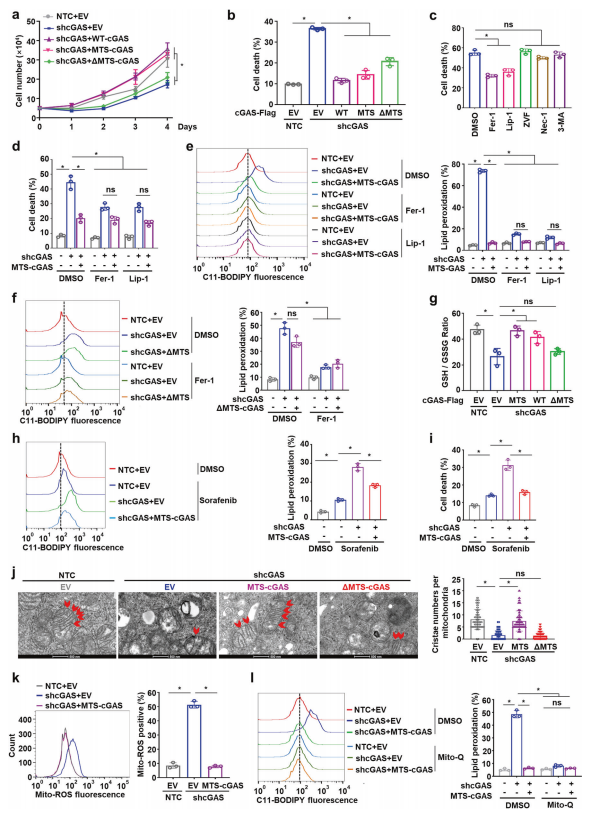
图二 线粒体定位的cGAS可抑制肝癌细胞的铁死亡[5]
铁死亡主要是由脂质过氧化物的过度积累引起的,谷胱甘肽/谷胱甘肽过氧化物酶4(GSH/ GPX4)信号轴是其经典信号通路。过表达MTS-cGAS也能减弱shcGAS诱导的脂质过氧化物增加(图二e),而ΔMTS-cGAS则不能(图二f)。GSH是GPX4介导的脂质过氧化防御系统的必要辅助因子,GPX4将GSH转化成氧化型谷胱甘肽(GSSG),并将细胞毒性脂质过氧化物(L-OOH)还原为相应的醇(L-OH)。研究者观察到过表达MTS-cGAS和WT-cGAS可逆转shcGAS诱导的GSH/GSSG比率降低,而ΔMTS-cGAS同样不行(图二g)。在铁死亡诱导剂Sorafenib处理的细胞中,过表达MTS-cGAS同样消除了shcGAS诱导的高水平脂质过氧化物和细胞死亡(图二h和i)。通过观察线粒体形态和嵴数量,发现与NTC细胞相比,shcGAS细胞显示出线粒体受损以及嵴结构紊乱,过表达MTS-cGAS能显著恢复受损的嵴结构,而ΔMTS-cGAS同样不行(图二j),表明线粒体cGAS负责部分维持线粒体结构。shcGAS细胞诱导的线粒体ROS异常积累,同样可被MTS-cGAS消除(图二k);线粒体靶向抗氧化剂Mito-Q的处理可消除shcGAS细胞的高水平脂质过氧化物和细胞死亡(图二l)。以上数据表明,线粒体cGAS可以通过抑制线粒体ROS的过量积累,来抑制肝癌细胞的脂质过氧化物和铁死亡。
于是,研究者探索线粒体cGAS抑制铁死亡和ROS过量积累的可能性机制,发现该过程并不依赖于经典的cGAS-STING信号通路。进一步在MS数据中筛选与线粒体cGAS相互作用的蛋白,关注到ACSL4、OPA1和DRP1,经co-IP检测发现cGAS仅与DRP1存在相互作用(图三a),分离线粒体蛋白组分的co-IP和免疫荧光染色也验证了线粒体cGAS和DRP1之间的相互作用(图三b和c)。体外下拉实验表明,GST-cGAS与DRP1-His具有直接相互作用(图三d),且cGAS的NTase结构域是两者结合所必需的(图三e)。由于胞质溶胶DRP1可在OMM上形成寡聚体,研究者通过交联实验发现cGAS的敲低可降低Hep3B细胞的DRP1寡聚体,而过表达MTS-cGAS可恢复DRP1的寡聚化水平(图三f),表明线粒体cGAS是DRP1寡聚化所必需的。在添加DRP1特异性抑制剂Mdivi-1的情况下,过表达MTS-cGAS不能降低shcGAS诱导的脂质过氧化物和细胞死亡的水平升高(图三g和h),表明线粒体cGAS通过促进DRP1寡聚化一起抑制铁死亡和脂质过氧化物积累。
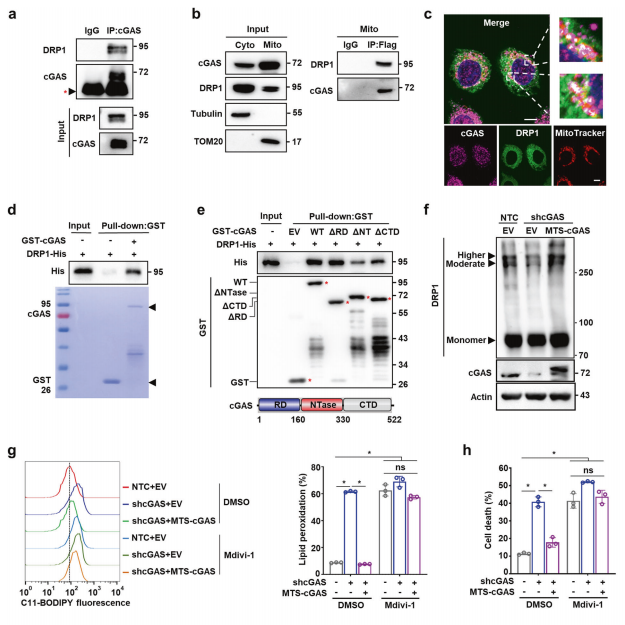
图三 线粒体cGAS与DRP1直接结合,且促进DRP1寡聚化[5]
最后,研究者体内评估抑制线粒体cGAS对HCC进展的干预作用。cGAS敲低显著抑制了小鼠异种移植模型的Hep3B肿瘤生长;过表达WT-cGAS解除了这种抑制作用,促进了肿瘤生长;过表达ΔMTS-cGAS影响不大(图四a和b),表明线粒体cGAS具有促进HCC肿瘤生长的作用。铁死亡抑制剂Lip-1的处理也能解除shcGAS的抑制肿瘤生长作用,并且过表达MTS-cGAS极大促进了肿瘤生长(图四c和d)。Lip-1处理和MTS-cGAS过表达均降低了Hep3B shcGAS异种移植瘤中的4-HNE标识的脂质过氧化反应,且不影响Ki67标识的细胞增殖(图四e),表明线粒体cGAS主要通过抑制铁死亡来促进HCC肿瘤生长。DRP1抑制剂Mdivi-1的处理破坏了过表达MTS-cGAS的肿瘤促进作用以及脂质过氧化反应抑制作用(图四f和g)。以上数据表明,线粒体定位的cGAS通过以DRP1依赖的方式抑制铁死亡,进而促进肿瘤进展 (图四h)。
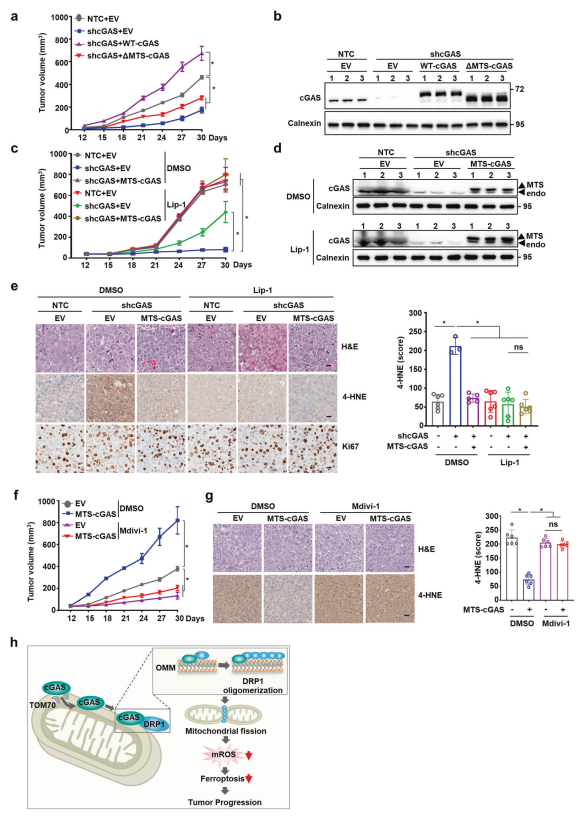
图四 线粒体cGAS通过抑制铁死亡促进肿瘤进展[5]
综上所述,本研究证明了在肝癌细胞中,线粒体定位的cGAS通过促进DRP1寡聚化来抑制ROS过量累积和铁死亡,从而促进HCC肿瘤进展。揭示了cGAS的线粒体定位的促癌新功能,提示cGAS的不同亚细胞定位可具有不同的功能,从而调控不同类型细胞的细胞命运,并且靶向线粒体cGAS可作为新的癌症干预措施的潜在靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Sun L, Wu J, Du F, Chen X, Chen ZJ: Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science 2013, 339(6121):786-791.
2. Liu H, Zhang H, Wu X, Ma D, Wu J, Wang L, Jiang Y, Fei Y, Zhu C, Tan R et al: Nuclear cGAS suppresses DNA repair and promotes tumorigenesis. Nature 2018, 563(7729):131-136.
3. Bock FJ, Tait SWG: Mitochondria as multifaceted regulators of cell death. Nat Rev Mol Cell Biol 2020, 21(2):85-100.
4. Vasan K, Werner M, Chandel NS: Mitochondrial Metabolism as a Target for Cancer Therapy. Cell Metab 2020, 32(3):341-352.
5. Qiu S, Zhong X, Meng X, Li S, Qian X, Lu H, Cai J, Zhang Y, Wang M, Ye Z et al: Mitochondria-localized cGAS suppresses ferroptosis to promote cancer progression. Cell Res 2023, 33(4):299-311.



