技术分享:Ssh2通过调节微丝重塑参与精子顶体形成
非梗阻性无精子症的最常见原因是精子发生受损,约占男性不育的15% [1]。精子发生是指在睾丸曲细精管内产生精子的连续过程,包括未分化精原细胞的有丝分裂、精母细胞的减数分裂以及最终的精子细胞变态三个阶段[2]。减数分裂后精子细胞变态形成成熟精子的过程又被称为精子形成[3],其特征是单倍体精子细胞经过时序性形态变化,包括细胞核压缩,鞭毛和顶体的形成,细胞质丢失等,最终形成精子。球形精子细胞的变形过程涉及到细胞骨架系统,尤其是微丝[4],它通过各种辅助蛋白如肌动蛋白结合蛋白PROFILIN-3协调细胞骨架重塑,将蛋白质和囊泡运送到新生的顶体[5]。细胞骨架系统介导的前顶体囊泡形成、运输及融合,逐渐形成位于精子头部细胞核前方的膜状细胞器顶体。它是精子特有的一种溶酶体样细胞器,在卵子受精中发挥重要作用。尽管在顶体形成方面已经取得一些研究进展,但肌动蛋白组织参与这一过程的分子基础仍有待研究。丝切蛋白磷酸酶2(SSH2)作为一种肌动蛋白重塑调节因子[6],被发现在小鼠精子发生的过程中增加表达[7],提示其可能参与减数分裂。
2023年3月,eLife期刊上报道了丝切蛋白磷酸酶2(Ssh2)参与小鼠精子顶体形成的新机制。研究者通过采用Ssh2敲除小鼠(Ssh2 KO)和敲入血凝素(HA)蛋白标签的Ssh2-HA小鼠,揭示Ssh2通过调节丝切蛋白(Cofilin)的磷酸化,参与微丝结构重塑,进而影响精子顶体形成过程中的前顶体囊泡运输与融合,对于顶体形成和雄性生殖是必不可少的[8]。
首先,研究者构建了敲除第8号外显子的Ssh2 KO小鼠(图一A)来研究Ssh2在雄性生育中的作用。将Ssh2 KO小鼠整个睾丸裂解物进行蛋白质免疫印迹(WB)分析,验证了Ssh2的缺失表达(图一B),且发现雄性小鼠完全不育(图一C)。与同窝WT小鼠相比,Ssh2 KO雄鼠的睾丸大小、体重、睾丸重量、睾丸与体重比并没有差异(图一D-G)。但通过苏木精染色发现,Ssh2 KO雄鼠的精子发生受损,附睾腔中未观察到成熟精子(图一H),附睾尾部的精子计数也证实了这一点(图一I)。以上数据表明,Ssh2对雄性生育能力是至关重要的。
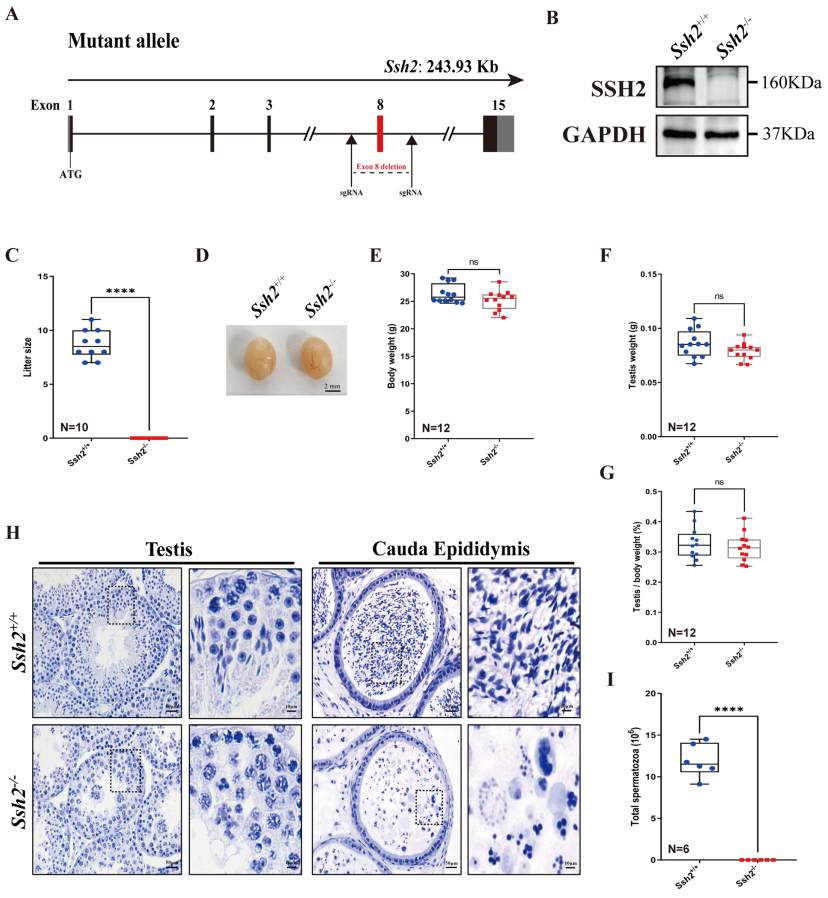
图一 Ssh2敲除导致雄鼠严重的生殖缺陷和雄性不育[8]
为了确定Ssh2 KO雄鼠精子发生的阻滞时间点,研究者使用苏木精和过碘酸希夫(PAS)对睾丸组织切片进行染色,发现Ssh2 KO小鼠的精子发生阻滞在Ⅱ-Ⅲ期(图二A),终止于早期step 1-3球形精子阶段。此外,在Ssh2 KO小鼠曲细精管中还观察到成簇聚集的球形精子细胞(cRS)和凋亡样生殖细胞(aRS)(图二A)。采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)测定睾丸和附睾中的凋亡信号,发现Ssh2 KO小鼠曲细精管和附睾管腔中凋亡精子细胞数量显著增加(图二B-D),并且在睾丸裂解物中检测到促凋亡信号分子BAX,BAD,Caspase-3和裂解Caspase-3蛋白水平显著升高,同时抗凋亡BCL-2的蛋白水平相对降低(图二E)。以上结果表明,Ssh2敲除导致精子发生停滞和生殖细胞凋亡。
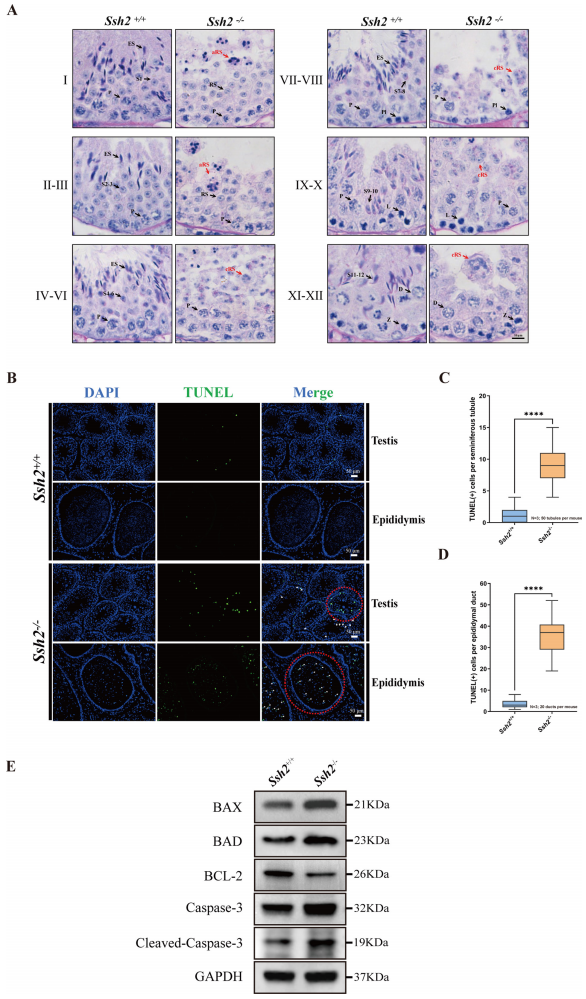
图二 Ssh2敲除导致精子发生停滞和生殖细胞凋亡增强[8]
接下来,研究者评估Ssh2 KO小鼠分化精子细胞的形态。对顶体形成的不同阶段进行花生凝集素(PNA)免疫荧光染色,发现与WT精子细胞中看到的完整顶体囊泡不同,大多数Ssh2 KO精子细胞中存在多个分散的前顶体囊泡,它们并没有相互融合(1-3步)(图三A),表明Ssh2 KO小鼠的顶体形成是从高尔基期开始被破坏的。通过透射电镜(TEM)观察,发现Ssh2 KO精子细胞出现高尔基堆层增厚,尽管前顶体囊泡可被反式高尔基体释放,但是不能融合形成一个完整的顶体泡(图三B)。此外,在核膜附近没有观察到顶体下层板(acroplaxome)样结构(图三B)。这种顶体形成受损表型与Gm130突变小鼠相似[9]。于是,研究者进行Gm130和PNA免疫共染色,发现在WT精子细胞中观察到具有囊泡状和堆叠状形状的Gm130信号与PNA标记的顶体囊泡紧密接触。然而,在Ssh2 KO精子细胞中仅观察到大的Gm130阳性聚集体,且与PNA阳性前顶体囊泡并不接触(图三C)。以上数据表明,Ssh2 KO导致前顶体囊泡融合失败,提示Ssh2在精子细胞顶体形成过程中发挥了重要作用。
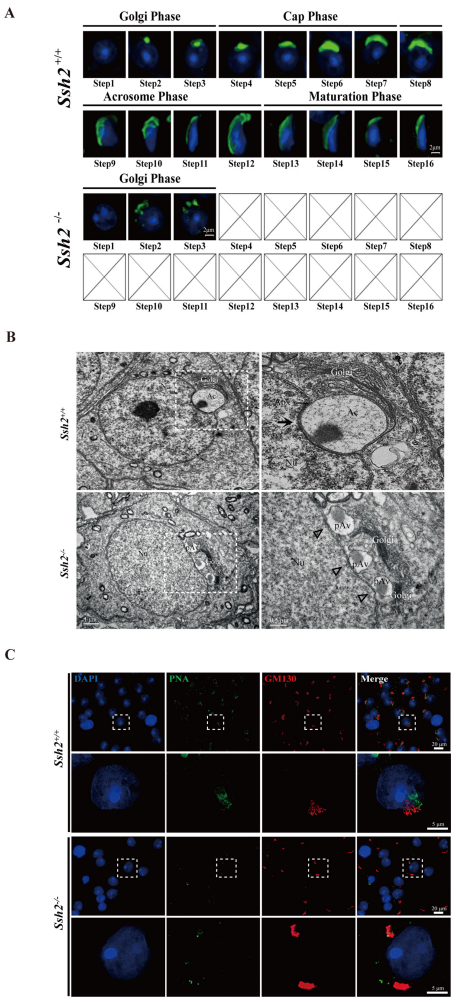
图三 Ssh2敲除导致顶体形成被破坏[8]
为了研究Ssh2在精子发生中的功能,研究者检测了不同睾丸发育时期的Ssh2蛋白表达谱式,发现其在小鼠精子发生过程中逐渐增加(图四A),并且主要表达在精母细胞和球形精子细胞中(图四B)。与WT小鼠相比,Ssh2 KO小鼠精子细胞无Ssh2信号,且出现碎片化顶体(图四B和C)。此外,研究者构建了Ssh2-HA标签小鼠来检测顶体形成过程中Ssh2的动态性表达情况,利用HA标签,同样观察到Ssh2-HA主要定位于精母细胞和球形精子细胞的细胞质中,并在顶体区密集积累(图四D和E)。以上数据表明,Ssh2的功能与顶体形成具有相关性。
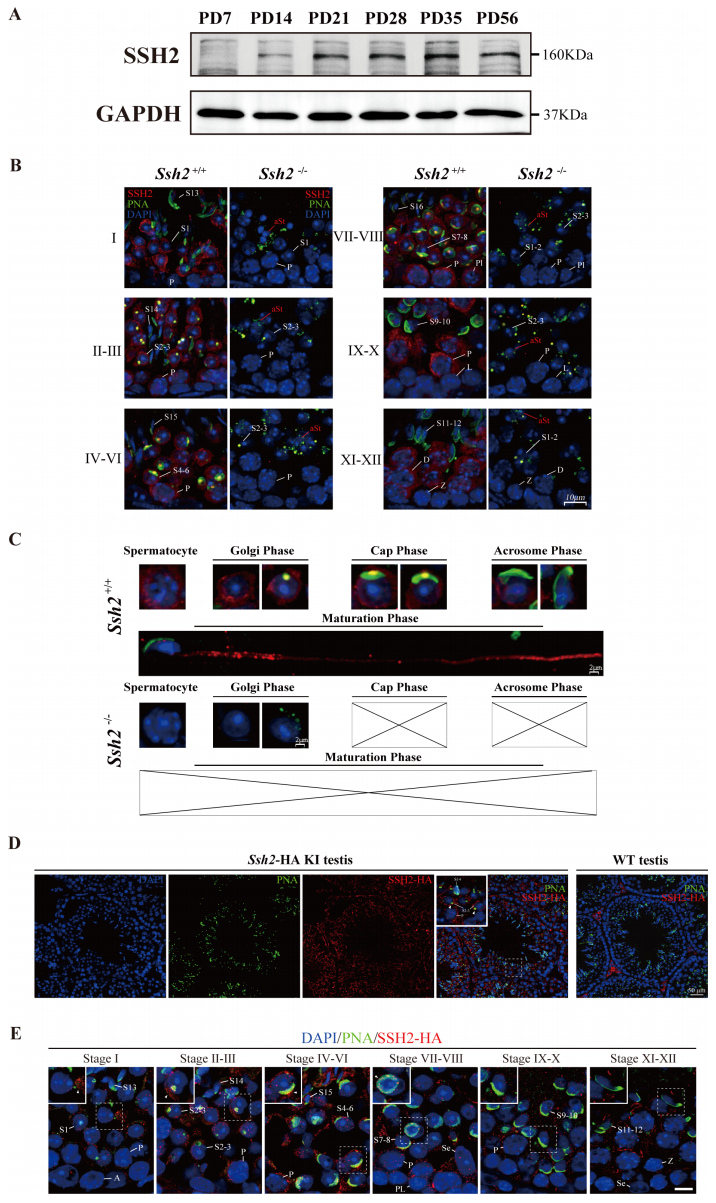
图四 Ssh2表达积累在精子细胞的顶体区[8]
据报道SSH2可结合在F-肌动蛋白(F-actin)上拮抗LIMK1介导的肌动蛋白聚合[10]。于是,研究者用鬼笔环肽染色来标记F-actin,发现Ssh2 KO精子细胞的F-actin结构发生改变,出现许多异常聚集信号(图五A和B),提示Ssh2 KO加速了微丝生长。Ssh2是丝切蛋白(Cofilin)的特异性磷酸酶[10],后者负责特异性解聚微丝蛋白。研究者进一步发现,Ssh2 KO小鼠睾丸的磷酸化Cofilin蛋白水平升高,而总Cofilin以及Cofilin蛋白激酶Limk1和Limk2的蛋白水平没有显著差异(图五C);免疫荧光染色也证明了磷酸化Cofilin在细胞核和细胞质的表达均显著增加,特别是在精子细胞(图五D);随着磷酸化Cofilin的增加,相应的F-actin的表达增加(图五E),并且普遍存在的磷酸化Cofilin信号与结构异常的F-actin聚集物具有共定位(图五F)。以上数据表明,在顶体形成过程中,Ssh2通过调控Cofilin磷酸化来协调F-actin重塑。
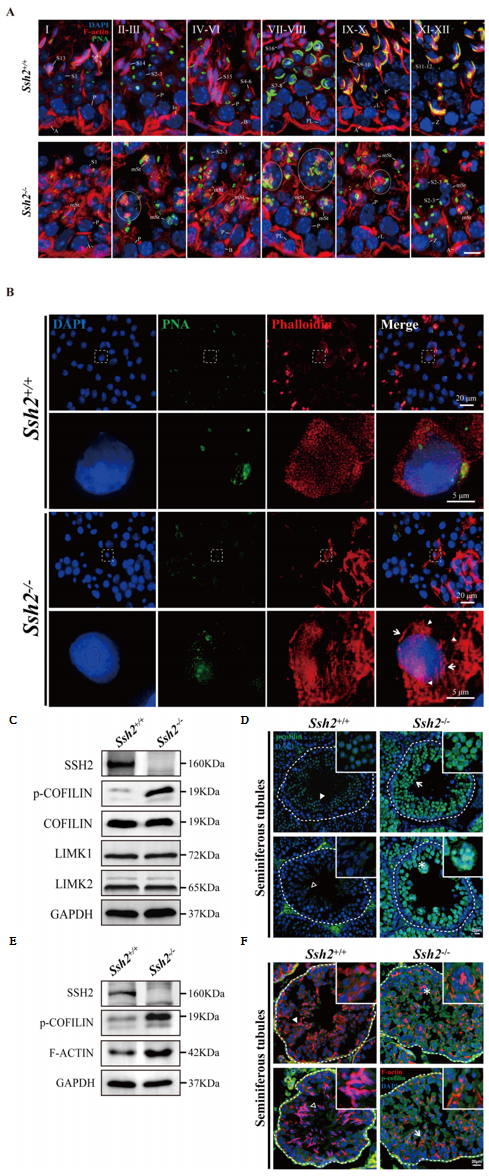
图五 Ssh2敲除导致Cofilin磷酸化调节受损以及微丝结构异常[8]
综上所述,本文揭示了Ssh2在顶体形成和雄性生育能力中的重要调控作用。利用Ssh2 KO小鼠发现了精子发生阻滞的生殖表型和增强的生殖细胞凋亡现象,最终导致雄性不育。Ssh2定位于减数分裂后的球形精子细胞,并在顶体区积累,这一点在Ssh2-HA小鼠中得到了证实。在精子形成过程中,Ssh2 KO精子细胞顶体异常,前顶体囊泡没有融合,并伴有F-actin结构紊乱,同时Cofilin过度磷酸化。本文揭示了Ssh2通过调节Cofilin的磷酸化,参与微丝结构重塑,进而影响精子顶体形成的新机制,为非梗阻性无精子症的致病机制提供了新的思路。

文章中涉及的Ssh2-HA小鼠(图四D和E)具体信息,可在GTP研发中心的标签小鼠(GTP ID: 20001589)产品列表中进行查询。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Agarwal A, Baskaran S, Parekh N, Cho CL, Henkel R, Vij S, Arafa M, Panner Selvam MK, Shah R: Male infertility. Lancet 2021, 397(10271):319-333.
2. Nakata H, Wakayama T, Takai Y, Iseki S: Quantitative analysis of the cellular composition in seminiferous tubules in normal and genetically modified infertile mice. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society 2015, 63(2):99-113.
3. Bao J, Bedford MT: Epigenetic regulation of the histone-to-protamine transition during spermiogenesis. Reproduction 2016, 151(5):R55-70.
4. Soda T, Miyagawa Y, Fukuhara S, Tanaka H: Physiological role of actin regulation in male fertility: Insight into actin capping proteins in spermatogenic cells. Reproductive medicine and biology 2020, 19(2):120-127.
5. Umer N, Arevalo L, Phadke S, Lohanadan K, Kirfel G, Sons D, Sofia D, Witke W, Schorle H: Loss of Profilin3 Impairs Spermiogenesis by Affecting Acrosome Biogenesis, Autophagy, Manchette Development and Mitochondrial Organization. Frontiers in cell and developmental biology 2021, 9:749559.
6. Xu X, Gera N, Li H, Yun M, Zhang L, Wang Y, Wang QJ, Jin T: GPCR-mediated PLCbetagamma/PKCbeta/PKD signaling pathway regulates the cofilin phosphatase slingshot 2 in neutrophil chemotaxis. Molecular biology of the cell 2015, 26(5):874-886.
7. Fang K, Li Q, Wei Y, Zhou C, Guo W, Shen J, Wu R, Ying W, Yu L, Zi J et al: Prediction and Validation of Mouse Meiosis-Essential Genes Based on Spermatogenesis Proteome Dynamics. Molecular & cellular proteomics : MCP 2021, 20:100014.
8. Xu K, Su X, Fang K, Lv Y, Huang T, Li M, Wang Z, Yin Y, Muhammad T, Liu S et al: The Slingshot phosphatase 2 is required for acrosome biogenesis during spermatogenesis in mice. eLife 2023, 12.
9. Han F, Liu C, Zhang L, Chen M, Zhou Y, Qin Y, Wang Y, Chen M, Duo S, Cui X et al: Globozoospermia and lack of acrosome formation in GM130-deficient mice. Cell death & disease 2017, 8(1):e2532.
10. Ohta Y, Kousaka K, Nagata-Ohashi K, Ohashi K, Muramoto A, Shima Y, Niwa R, Uemura T, Mizuno K: Differential activities, subcellular distribution and tissue expression patterns of three members of Slingshot family phosphatases that dephosphorylate cofilin. Genes to cells : devoted to molecular & cellular mechanisms 2003, 8(10):811-824.



